新疆某规模化猪场母猪伪狂犬病的净化效果评价
刘俊飞 刘英玉 刘宏杰
(1 新疆农业大学动物医学学院, 新疆乌鲁木齐 830052; 2 昌吉天康畜牧科技有限公司, 新疆昌吉 831100)
猪伪狂犬病是由伪狂犬病毒(Pseudorabies virus,PRV)引起猪的以繁殖障碍和呼吸道疾病为主要特征的传染性疾病。PRV 是疱疹病毒Ⅰ型,其显著特征是形成持续潜伏感染,可伴随宿主一生。PRV 主要潜伏在三叉神经节、骶神经节和扁桃体,潜伏期的PRV 具有潜在的活化和排出感染性病毒的危险,因此潜在带毒动物是疾病控制的主要威胁。猪是PRV 的唯一自然宿主,但病毒也可以自然感染牛、羊、猫、犬和老鼠,并可以引起致命性疾病,只有猪在感染PRV 后能够存活[1]。尽管不同区域、不同毒株的PRV 毒力不同,但均可引起仔猪死亡、怀孕母猪流产、育肥猪的呼吸道症状,给养猪户带来惨重损失[1]。PRV 只有一个血清型,市场上的疫苗无论是国外的Bartha 株还是国内的地方毒株对变异的流行毒株仍然具有免疫保护力。目前的问题是随着毒株变异后毒力增强、侵袭力变强,在猪场出现免疫空白或免疫薄弱环节时,猪群更容易被感染,因此,完整的免疫显得尤为重要[2]。
净化是彻底控制猪场伪狂犬病的唯一出路,国务院出台的《国家中长期动物疫病防治规划(2012—2020年)》,将猪伪狂犬病列入国家需中长期防控的动物疫病。由于PRV-gE 基因缺失疫苗的推广使用,使得应用与之配套的商品化鉴别ELISA 诊断试剂盒区分疫苗免疫和野毒感染成为了可能,也给PRV 的控制和净化提供了有效的检测手段。研究中的试验猪场是新疆某规模化商品猪场,在实施净化方案前经检测是猪伪狂犬病野毒感染阳性猪场,而引进种猪的猪场是猪伪狂犬病野毒感染阴性猪场,且生产数据全面优于试验猪场。因此,实行借鉴国内PRV 净化的成功案例并结合该猪场的实际情况,在该试验猪场制定切实可行的伪狂犬净化方案,即引进无伪狂犬病感染的阴性后备种猪快速替换本场原有母猪,利用本场实际情况实现猪群之间的隔离,结合免疫、检测、淘汰等手段实现母猪猪伪狂犬病gE 抗体检测阴性,计划在3 年内初步实现全场母猪的PRV 净化目标。
1 材料和仪器
IDEXX PRV-gE 抗体检测试剂盒,IDEXX PRV-gB抗体检测试剂盒,美国Thermo MK3 酶标仪,深圳雷杜RT-3000 洗板机,德国Eppendorf 微量移液器。
2 方法
采样方法:对猪采用前腔静脉采血,室温静置后将自然析出的血清,收集于离心管中,冷藏保存,当日送检。
采样要求:依据中国动物疫病预防控制中心《规模化养殖场动物疫病净化示范场评估标准(试行)》(2015 版),制定了试验猪场PRV 免疫净化评估方法。如表1,基础群和已经配种的后备猪每季度按照采样要求抽检1 次,后备猪培育阶段按照引进批次每月抽检1次,配种前逐头检测。
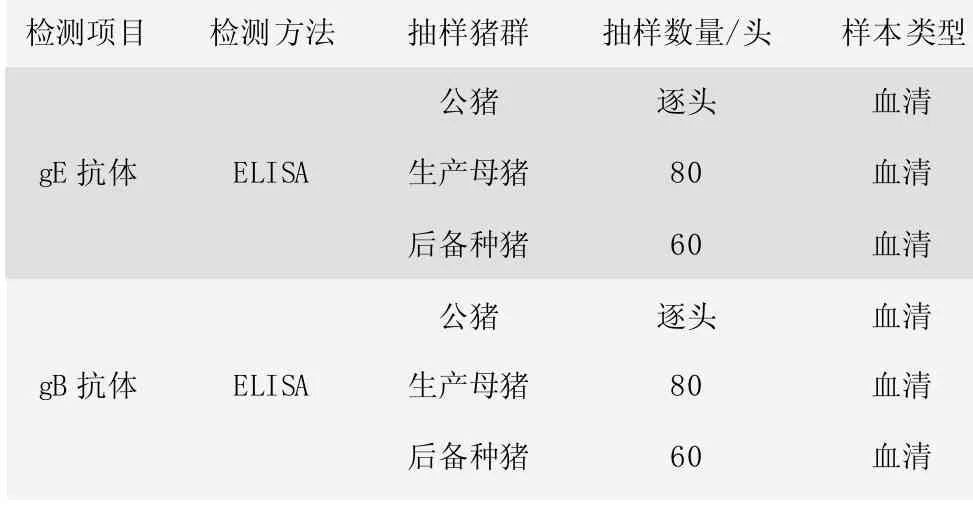
表1 PRV 免疫净化评估实验室检测方案
gE 和gB 抗体检测方法:按照IDEXX PRV-gE、PRV-gB 试剂盒说明进行操作,并采用Herdchek 软件进行结果判定。判断标准:①如果S/N 值低于或等于0.60 时,样品应判定为PRV gpI 抗体阳性。②如果S/N值大于0.60 但小于或等于0.70,样品应重测,如果结果不变,间隔一定时间后重新采样、检测。③如果S/N值大于0.70,样品应判定为PRV gpI 抗体阴性。
3 结果与分析
3.1 方案实施前猪群评估结果
实施方案前按照采样要求采集后备母猪血清60 份、基础母猪血清80 份、公猪血清16 份进行PRV 野毒gE抗体和gB 抗体检测,了解猪场猪伪狂犬病野毒(gE)感染背景和猪群gB 抗体情况。
gE 阳性率在10%以下,为轻度感染,采取直接淘汰措施;阳性率在10%以上,采取引种、隔离、调整免疫、淘汰等分段措施[3-5]。该试验猪场的gE 抗体阳性率均在35%以上,如表2 所示,处于重度感染,因此,采取引种、隔离、调整免疫、淘汰等措施来实施净化过程。
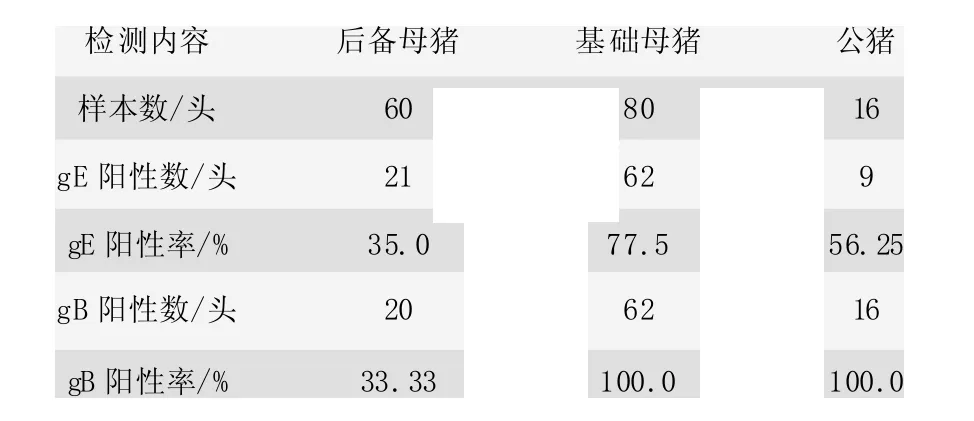
表2 猪群野毒(gE) 感染背景
猪群gB 抗体合格率大于90%以上视为合格,低于90%则应加强免疫[6]。从表2 可看出试验猪场后备猪的gB 抗体监测不合格,应加强后备猪群的免疫。结合gE和gB 抗体数据可知,该猪场的公猪和基础母猪存在野毒感染,gB 抗体阳性率虽高但应该是野毒感染和疫苗株共同作用所致,而后备猪群gB 抗体较差,且存在较高的gE 阳性,提示猪群感染PRV 时间不长,猪场内存在野毒感染种猪排毒现象,应加强所有猪群的免疫[7,8]。
3.2 引种
引种前对即将引入的后备种猪进行抽检,抽检比例为后备母猪的20%,公猪逐头检测gE 抗体。为了减少引种次数过多可能造成的潜在危害,每4 个月引种1次,每次800 头,1 年引种2 400 头,后备猪利用率按92%计算,每年补入基础群2 200 头,试验场基础母猪3 800 头,年更新率58%。猪场在母猪伪狂犬病净化方案执行过程中共引入9 批种猪,全部为gE 抗体阴性。
3.3 调整免疫程序
根据猪群野毒(gE)感染情况和猪群gB 抗体监测结果(表2),需调整原有免疫程序。参考国内成功净化伪狂犬病的案例,主要是在原有弱毒苗免疫的基础上增加灭活苗免疫[9],具体改变如表3,基础母猪和公猪减少1 次弱毒苗免疫,增加灭活苗免疫,后备猪的2 次免疫中都加入灭活苗的免疫。免疫程序调整在方案开始的第1 个月(2016 年4 月)开始执行。
3.3.1 免疫程序调整后猪群gB 抗体阳性率和保护率的持续监测
在gB 抗体阳性率(S/N<0.6)、保护率(S/N<0.2)中,保护率更能说明猪群对PRV 野毒的抵抗力。进入妊娠期的后备母猪和基础母猪群,每个季度全群抽检血液,进行猪伪狂犬病gB 抗体的检测,猪群gB 抗体持续监测结果如图1 所示,净化方案实施3 个月后全群的gB 抗体阳性率和保护率均达到90%以上,9 个月后阳性率一直维持在100%,而24 个月以后全群的gB 抗体阳性率和保护率一直维持在100%。gB 抗体有可能是疫苗免疫和野毒感染的综合作用[10],因此,本文先对gB抗体的持续监测结果做一展示,后续结合gE 抗体的变化综合讨论。
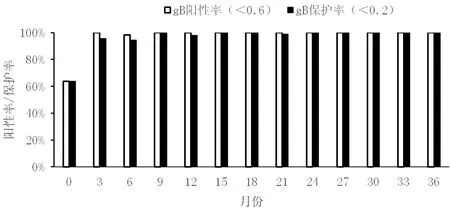
图1 免疫程序调整后gB 抗体持续监测结果
3.3.2 免疫程序调整后猪群gB 抗体平均值和离散度的持续监测
gB 抗体的值越低,对猪只的保护力越强,平均值越低,对群体保护力越强;离散度的值越小,说明抗体整齐度越好[11]。gB 抗体离散度和平均值持续监测结果见图2,抗体平均值在调整免疫程序后的第3 个月就已经下降到0.06,后续一直维持较低的平均值,但离散度到第15 个月才下降到较低水平,24 个月后达到理想水平,且稳定维持。整体呈下降且逐步稳定趋势,表明抗体保护力较好。

表3 免疫程序的调整
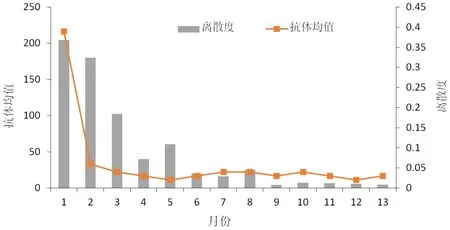
图2 免疫程序调整后gB 抗体离散度和平均值走势图
3.4 调整免疫基础上的隔离效果
试验猪场分2 条繁育生产线,生产一区和生产二区,有专门的育成区和保育区。4 个区之间直线距离150 m 以上,每个区各圈舍之间相距15 m 以上,可以按照猪群类别做到分区和分圈的相对隔离。
3.4.1 引入的后备种猪在执行新免疫程序并实行分区隔离后各批次gE 抗体阳性检出率
育成区改成后备区,彻底消毒后引入猪伪狂犬病毒阴性后备种猪,后备母猪在育种、配种、妊娠阶段都在后备区,不与生产一区和二区的基础群接触,做到分区隔离。
后备猪在育种阶段采取每个月抽检、配种前逐头检测、检出阳性即淘汰的方案。引入的后备母猪都为猪伪狂犬病毒阴性个体,养殖过程中不接触猪伪狂犬野毒,阳性检出率应为0。但如图3 显示在前4 个批次的检测中都有阳性检出,原因可能是第1 次消毒不彻底,或是生产过程中人为带入病毒,环境中有野毒存在,导致感染。但检出率逐渐降低并且后面的批次再无检出,表明分区隔离的执行过程逐渐得到完善,减少了人为带入野毒的概率;此外,在加强免疫后,基础群中的野毒感染猪排毒得到控制,母猪排毒数量减少,环境中野毒数量降低,减少了带入的风险。初步证明“调整免疫+分区隔离”有效。
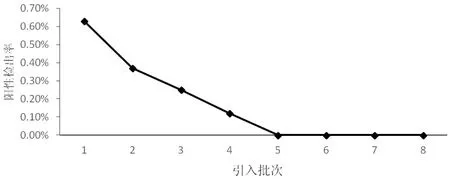
图3 各批次后备猪引入后gE 抗体阳性检出率
3.4.2 后备种猪进入繁育生产线与原有基础母猪采取分圈隔离后猪群gE 抗体持续监测
伪狂犬病毒阴性后备猪在后备区经过育种、配种、妊娠后,从分娩开始需要转移到基础母猪所在生产线,这时要做到与生产线原有的母猪不混群,即分圈隔离。这部分猪进入生产线后,从分娩—断奶—再配种—再分娩始终坚持不与原有猪群混群。
本方案中采取集中替换生产一区的基础母猪,即后备母猪分娩、断奶、再配种等生产过程都在生产一区,其中,高胎龄的母猪会淘汰或转入生产二区,单向流通。生产一区的母猪全部替换完毕后,逐步将已替换过的较高胎龄母猪转入生产二区,后备猪补充还在生产一区进行。
试验猪场猪群每季度的野毒感染持续检测结果见图4,由于是分区管理,各区之间净化进度不一样,因此3个区分开检测。监测结果显示,3 个区伪狂犬病毒gE 抗体阳性率整体都呈持续下降趋势。后备区妊娠母猪最初检测出阳性应该和养殖过程(图3)前4 个批次检出阳性原因相同,第12 个月以后gE 抗体阳性率一直维持在0,符合预期目标。一区gE 抗体阳性率在第11 个月已降至10%以下,二区gE 抗体阳性率在第26 个月降至10%以下。按照引种的年更新率为58%,12 个月生产一区替换完毕,24 个月生产二区的猪群替换完毕。结合图1 和图2 结果,第12 个月和第24 个月的2 个节点处,监测数据较前期都有较明显的改观,证明此次净化达到了预期的目标。而从图1、图2、图3 的综合分析中,在gB 抗体阳性率和保护率升高并维持稳定以及离散度和平均值不断降低并维持稳定的同时,gE 抗体阳性率是不断下降的,因此,图1 和图2 的结果显示可以排除野毒感染导致,而是免疫的效果。综合图1 至图4 证明该试验猪场采取的“引种+调整免疫+隔离”的净化方法是有效的。
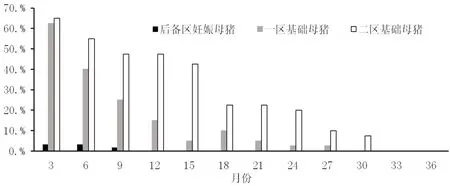
图4 猪群的gE 抗体阳性率持续监测结果
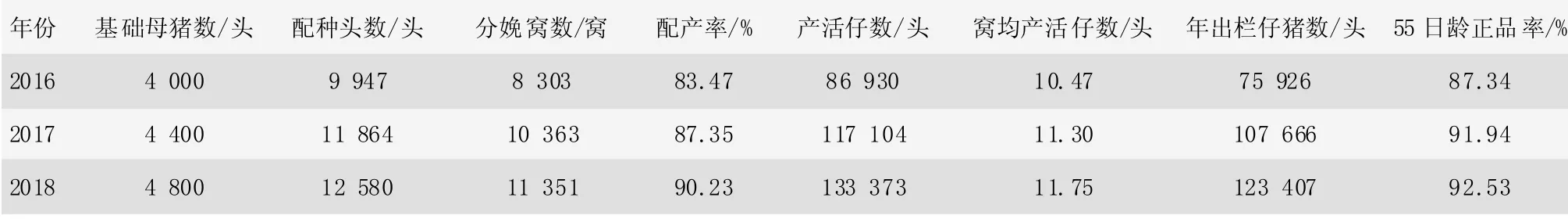
表4 2016—2018 年猪场的各项生产数据
3.5 淘汰
如图4 显示,该猪场第27 个月和30 个月的季度监测结果显示,gE 抗体阳性率都维持在10%以下,因此,在第31 个月进行了全群检测,共检出并淘汰PRV 感染阳性母猪126 头,后续的2 个季度监测结果如图4 显示,全群PRV 野毒感染持续维持阴性。初步证明本次制定的净化方案整体有效。
3.6 净化效果
该试验猪场在猪伪狂犬病的净化实施过程中不仅增加了基础母猪的存栏,而且各项生产指标都有所提升,如表4,从2016 年至2018 年猪场配产率和55 日龄正品率(55 日龄时可用于做后备猪的仔猪数占断奶活仔猪数的百分比)都有了稳步提升,分别提高到90.23%和92.53%,通过净化程序的实施,2018 年母猪的产活仔数比2016 年增加了46 443 头,2018 年出栏仔猪比2016 年增加了47 481 头。
4 结论
该试验猪场利用3 年时间,通过“引种+隔离+免疫+监测+淘汰”的方案,初步实现了猪场内基础母猪PRV 的净化。净化过程中引入PRV 阴性的后备母猪并实现快速换种是净化的前提条件。免疫是净化过程的基础,控制和减少已经被感染的猪继续排毒,减少环境中的野毒数量,提高猪体自身对病毒的抵抗力,从而降低阴性猪被感染的概率。隔离是整个净化过程的关键,如何让阴性和阳性猪群能够在生产过程中实现不直接接触,生产环节不交叉感染,是兽医和生产管理者必须提前计划和现场监督的工作。持续的监测是净化的辅助手段,用客观的检测数据论证工作是否有效,过程是否需要改善。淘汰是净化的一个暂时收尾,淘汰完以后还需持续监测。

