NH2-UIO-66负载RuCuMo纳米催化剂的制备及其催化产氢
张翊青,刘 梨,张淑娟,万正睿,刘红英,周立群
(湖北大学 化学化工学院,有机化工新材料湖北省协同创新中心,有机功能分子合成与应用教育部重点实验室,武汉 430062)
金属有机骨架(MOFs)是一类有序多孔材料,因其丰富的骨架和多孔特性,在气体存储与分离、非线性光学材料、磁性材料、超导材料以及多相催化等方面具有良好的应用前景。在众多 MOFs材料中,NH2-UIO-66备受关注[1],它具有高的热稳定性和化学稳定性,大的比表面积,而且通过氨基改性后同时具有路易斯酸和路易斯碱的特征,可以为金属离子提供配位点,并且氨基作为锚锭基团更容易使金属固定,阻止团聚。另外,NH2-UIO-66还具有介孔结构,使得反应物分子更容易进入其孔道之中,因此可以通过在MOFs孔隙内引入金属等活性位点或者对MOFs的配体进行修饰引入活性位点制备高催化性能的催化剂[2]。目前NH2-UIO-66在光催化[3]、吸附[4]、荧光检测[5]等领域得到了应用。
氢能源作为一种二次能源,被视为21世纪最具发展潜力的清洁能源,高效生产和制备洁净的H2一直是科学家们追寻的目标。氨硼烷(AB)是一种潜在的固态储氢材料,氢含量高(19.6wt%),常温常压下为固态且稳定,不易燃易爆[6],而且其水溶液在催化剂作用下发生水解可以得到高纯H2,因此氨硼烷的催化水解已成为研究热点。目前很多金属纳米粒子用于催化 AB水解产氢,其中贵金属表现出优异的催化活性,如 Ru/g-C3N4[7]和 Pd/MIL-101[8],但是贵金属价格昂贵,储量有限,阻碍其应用与发展。而Fe[9]、Co[10]、Cu[11]、Mo[12]等非贵金属的催化活性较差,在水解条件下缺乏所需的稳定性,易于团聚,导致催化活性降低。最近研究表明,催化剂的稳定性和催化活性可以通过掺杂Cu、Mo、W等纳米粒子来提高,因为这些掺杂粒子无论是以金属或氧化态存在,均可以作为原子屏障,阻止金属纳米粒子(NPs)的聚集。此外,这些过渡金属还可以作为电子供体,与催化剂的母体结合造成活性金属原子的电子密度增大[13]。因此添加非贵金属并选择比表面积大的载体将有效改善 AB催化能力和稳定性,如PdNi@MIL-101[14]、AgCo@g-C3N4[15]、RuCo@MIL-53(Al)[16]、 RuCuNi/CNTs[17]、 RuCuCo@MIL-101[18]等。采用NH2-UIO-66负载RuCuMo作为催化剂,用于高效催化AB水解产氢至今未见报道。本工作通过溶剂热法合成 NH2-UIO-66载体,再通过简单的浸渍还原法负载三金属RuCuMo纳米粒子,制备RuCuMo@NH2-UIO-66催化材料。
1 实验方法
1.1 主要试剂及仪器
试剂:氯化锆、N,N-二甲基甲酰胺(DMF)、乙酸、无水甲醇、钼酸钠、三水硝酸铜和硼氢化钠均购于国药集团化学试剂有限公司;2-氨基对苯二甲酸和氨硼烷购于安耐吉化学;三氯化钌水合物购于阿拉丁化学试剂有限公司。实验所用试剂均为分析纯。
仪器:D8-Advance X射线粉末衍射仪(德国Bruker公司),CuKα (λ=0.1540 nm)为射线源,测试温度为室温,工作电压为40 kV,工作电流为40 mA,扫描范围为 2θ=5°~80°,扫描速度为 10 (°)/min。Tecnai G20 U-Twin 透射电子显微镜(美国FEI公司);Sigma 500型场发射扫描电镜(德国ZEISS公司);ESCALAB 250Xi型光电子能谱仪(XPS,美国 Thermo公司);电感耦合等离子体原子发射光谱(ICP-AES,IRIS Intrepid IIXSP,美国 Thermo公司);Micromeritics ASAP 2020比表面积分析仪(美国麦克公司);Impact 420型FT-IR红外光谱分析仪(美国Nicolet公司)。
1.2 催化剂的制备
NH2-UIO-66 的合成[19]:0.0373 g 氯化锆,0.036 g 2-氨基对苯二甲酸,25 mL DMF和2.75 mL乙酸混合均匀后加入到50 mL反应釜内,在120 ℃条件下反应24 h,室温下自然冷却,抽滤得到白色粉末。再用 DMF和无水甲醇洗涤数次以除去残留的 DMF,最终产物在60 ℃下真空干燥12 h。
Ru1Cu2Mo0.5@NH2-UIO-66的制备:取 50 mg合成的NH2-UIO-66分散在30 mL去离子水中,通过超声处理 15 min,以获得分散良好的悬浊液,再分别将5 mL 0.01 mol/L的RuCl3,1 mL 0.1 mol/L的CuCl2⋅2H2O 和 0.25 mL 0.1 mol/L 的 Na2MoO4加入到NH2-UIO-66悬浊液中持续搅拌5 h,然后将50 mg NaBH4溶解于10 mL去离子水中,并将该溶液逐滴加入到上述悬浊液中还原Ru(Ⅲ)、Cu(Ⅱ)和Mo(Ⅵ),继续搅拌3 h后抽滤,60 ℃真空干燥12 h。
采用上述相似步骤合成含有相同金属含量的催化 剂 Ru@NH2-UIO-66、RuCu@NH2-UIO-66、CuMo@NH2-UIO-66以及不同金属Cu/Mo摩尔比的催化剂RuCuxMoy@NH2-UIO-66。
1.3 催化活性测试
通过产氢速率测定RuCuMo@NH2-UIO-66催化氨硼烷水解的效率。为了检测 RuCuMo@NH2-UIO-66催化剂在氨硼烷水溶液中的产氢催化活性,采用排水法记录产氢体积和时间[20]。实验温度通过水浴装置控制在 25 ℃,将 10 mg RuCuMo@NH2-UIO-66催化剂分散在 10 mL去离子水中并倒入双颈圆底烧瓶中,其中一颈连接到气体检测装置,另一颈连入恒压漏斗引入氨硼烷。当恒压漏斗中的AB水溶液(18.5 mg,0.6 mmol)加入到含有催化剂的双颈烧瓶时反应即开始,以特定时间间隔(30 s)记录产生氢气的体积。采用相同的步骤也可以进行不同RuCuMo摩尔比的 RuCuMo@NH2-UIO-66催化实验,AB的量始终保持在18.5 mg,以比较AB的催化产氢速率。
为了获得反应活化能,AB水解实验分别在不同温度(25、30、35、40 ℃)下进行。为了测试催化剂的循环稳定性,将 30 mg Ru1Cu2Mo0.5@NH2-UIO-66分散在 10 mL去离子水中转入圆底烧瓶,按照上述方法,通过重新加入 AB(18.5 mg)至前一次的反应液中,连续进行4次以获得循环稳定性。
2 结果与讨论
2.1 物相分析
图1为载体NH2-UIO-66和不同催化剂的XRD图谱,发现合成的载体衍射峰的位置与文献[19]相一致,说明 NH2-UIO-66已被成功合成。而且,当Ru、Cu和Mo含量完全相同时,Ru@NH2-UIO-66、CuMo@NH2-UIO-66、RuCu@NH2-UIO-66以及Ru1Cu2Mo0.5@NH2-UIO-66四组衍射峰的形状和位置与NH2-UIO-66也一致,表明NH2-UIO-66骨架结构在催化剂的合成和催化过程中保持不变。当负载金属后,NH2-UIO-66衍射峰强度略有下降,这可能是由于RuCuMo纳米粒子包裹在晶体表面以及它们和骨架原子亲电表面的相互作用改变了电荷分布和静电场[21]。另外,从图1中观察不到Ru、Cu、Mo的特征衍射峰,这可能与其负载量较少有关[22]。
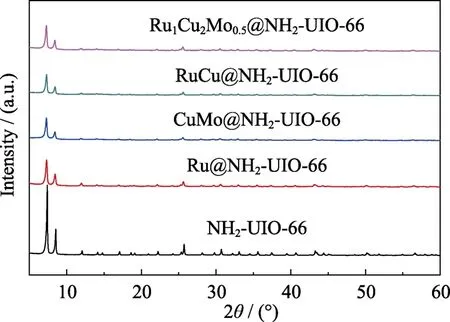
图1 NH2-UIO-66、Ru@NH2-UIO-66、CuMo@NH2-UIO-66、RuCu@NH2-UIO-66和Ru1Cu2Mo0.5@NH2-UIO-66的XRD图谱Fig.1 XRD patterns of NH2-UIO-66,Ru@NH2-UIO-66,CuMo@NH2-UIO-66,RuCu@NH2-UIO-66 and Ru1Cu2Mo0.5@NH2-UIO-66
2.2 形貌和组分分析
图2(a,b)是载体NH2-UIO-66的TEM照片,从图中可以看到,NH2-UIO-66具有规整的八面体结构,表面光滑。图2(c)为 Ru1Cu2Mo0.5@NH2-UIO-66催化剂的TEM照片,发现NH2-UIO-66负载金属之后仍然保持着规则的八面体形貌,金属RuCuMo纳米粒子能均匀地分布在表面,没有团聚现象。图2(d)为 Ru1Cu2Mo0.5@NH2-UIO-66中负载金属的粒径分布图,分布在0.4~1.6 nm,平均粒径为0.95 nm。图2(e)为纯RuCuMo纳米粒子的TEM照片,其粒径位于48~58 nm(图2(f)),平均粒径为52.7 nm。可见在没有载体时,金属粒子易发生团聚,且颗粒尺寸变大。
图3(a,c)为 Ru1Cu2Mo0.5@NH2-UIO-66 的 SEM照片,可以看出催化剂仍然保持载体 NH2-UIO-66的八面体结构,且负载的 RuCuMo金属分布均匀,尺寸均为纳米级。图3(b)为其相应的EDS谱图,发现该催化剂中含有 Ru、Cu、Mo、Zr、O 元素。图3(d~f)为Ru1Cu2Mo0.5@NH2-UIO-66的元素分布图像,表明Ru、Cu、Mo金属粒子已成功地负载到NH2-UIO-66,且载体属于含Zr的金属有机骨架。
2.3 元素及价态分析
图4为 Ru1Cu2Mo0.5@NH2-UIO-66催化剂的XPS图谱。从XPS全谱图(图4(a))可以看出,该催化剂含有Ru、Cu、Mo、Zr、C、O、N七种元素。图4(b)显示 Ru(0)的 3p3/2和 3p1/2的峰值分别位于 463.3和485.5 eV[23]。图4(c)为Cu的2p信号峰,943.8和962.6 eV处的峰分别对应Cu2p3/2和Cu2p1/2,证明催化剂中存在Cu(Ⅱ)[24-25]。位于932.7、934.3和935.3 eV处的峰分别归属于 Cu(Ⅰ)、Cu(Ⅱ)和 Cu(0) 的 2p3/2,在942.3和 943.8 eV处观察到的震动卫星峰归属于Cu(Ⅱ)。位于952.2和954.3 eV处的峰分别归属于Cu(0)和 Cu(Ⅱ)的 2p1/2[26]。从图4(d)中可以看出,Mo3d信号峰可以分解为2个峰,231.7和234.8 eV处的峰分别对应Mo(Ⅵ)的3d5/2和3d3/2的自旋电子衍射峰[27]。从图4(e)可以看出,N1s信号峰可以分解为2个峰,位于398.3 eV为N-C结合键的峰,位于399.9 eV为C-NH2结合键的峰,证明催化剂中存在-NH2。上述结果表明,在 Ru1Cu2Mo0.5@NH2-UIO-66催化剂中,Ru单质十分稳定,而 Cu、Mo在制备过程中可能发生了一定程度的氧化。

图2 (a,b) NH2-UIO-66、(c) Ru1Cu2Mo0.5@NH2-UIO-66、(e) RuCuMo纳米粒子的TEM照片;(d) Ru1Cu2Mo0.5@NH2-UIO-66和(f) RuCuMo纳米粒子的粒径分布图Fig.2 TEM images of (a,b) NH2-UIO-66,(c) Ru1Cu2Mo0.5@NH2-UIO-66,(e) RuCuMo NPs,(d,f) particle size distributions of (d) Ru1Cu2Mo0.5@NH2-UIO-66 and (f) RuCuMo NPs

图3 (a,c) Ru1Cu2Mo0.5@NH2-UIO-66的场发射扫描电镜照片,(b) EDS能谱分析和(d~f)相应的元素分布图像Fig.3 (a,c) FESEM image,(b) EDS analysis of Ru1Cu2Mo0.5@NH2-UIO-66 and (d-f) elemental mappings of Ru,Cu and Mo

图4 Ru1Cu2Mo0.5@NH2-UIO-66催化剂的XPS能谱图Fig.4 XPS spectra of the Ru1Cu2Mo0.5@NH2-UIO-66 catalysts survey,(b) Ru3p,(c)Cu2p,(d) Mo3d,(e)N1s
2.4 比表面积和骨架结构分析
对所制备的载体和催化剂采用N2吸附BET比表面积和孔结构分析,结果显示,NH2-UIO-66和Ru1Cu2Mo0.5@NH2-UIO-66的比表面积分别为1015.91和57.03 m2/g;孔体积分别为1.23和0.041 cm3/g。与载体NH2-UIO-66相比,催化剂Ru1Cu2Mo0.5@NH2-UIO-66的比表面积和孔体积显著减小,表明RuCuMo纳米粒子成功地负载到 NH2-UIO-66的表面和孔洞中,导致比表面积和孔体积显著降低。
图5为载体NH2-UIO-66、催化剂Ru1Cu2Mo0.5@NH2-UIO-66和五次催化循环后的 Ru1Cu2Mo0.5@NH2-UIO-66的红外光谱图。从图中可看出,三种样品在3362 cm-1处均有吸收峰,此峰对应N-H的特征吸收峰,表明三个样品中均存在-NH2。位于1573~1657 cm-1的强峰对应-COO-的反对称伸缩振动峰,位于1394~1435 cm-1的强峰为-COO-的对称伸缩振动峰,同时1570 cm-1处的峰显示-COOH与Zr4+形成了配位[28]。1494 cm-1处的峰对应苯环骨架中C=C伸缩振动峰;940~1150 cm-1处的峰显示苯环骨架中C-H面内和面外摇摆振动峰;760 cm-1附近峰对应苯环骨架中C-C面内和面外弯曲振动峰[29]。由此可见三种样品的红外图谱较为相似,说明负载三金属RuCuMo纳米粒子以及5次催化循环后,载体NH2-UIO-66的骨架结构仍保持不变。

图5 NH2-UIO-66、Ru1Cu2Mo0.5@NH2-UIO-66和循环5次后Ru1Cu2Mo0.5@NH2-UIO-66的红外光谱图Fig.5 FT-IR spectra of NH2-UIO-66,Ru1Cu2Mo0.5@NH2-UIO-66 and Ru1Cu2Mo0.5@NH2-UIO-66 after 5 runs
2.5 金属负载量分析
表1为催化剂中不同金属摩尔比的理论加入量和实际负载量的对比,通过 ICP-AES分别测定了Ru1Cu2Mox@NH2-UIO-66(x=0.25,0.5,1.0)负载的元素含量。由表可见,在三种样品中,Ru、Cu的实际负载量与理论值接近,表明浸渍还原法成功地将金属还原并负载到载体上。而Mo的实际值与理论值有一定的差异,这是由于Eθ(Ru3+/Ru)=0.3862 V,Eθ(Cu2+/Cu)=0.342 V,Eθ(MoO42-/Mo)= -1.05 V,MoO42-的电极电势较低,在金属还原过程中具有较高的稳定性,不易被还原。但随着 Mo的理论值之比增加(0.25,0.5,1,即 1 :2 :4),实际负载量也随之增加(0.04,0.09,0.19,即 1.00 :2.25 :4.75),且负载量之比相近。结果显示,催化剂Ru1Cu2Mo0.5@NH2-UIO-66中 Ru、Cu、Mo的实际负载量分别为5.48wt%、9.97wt%和0.052wt%。
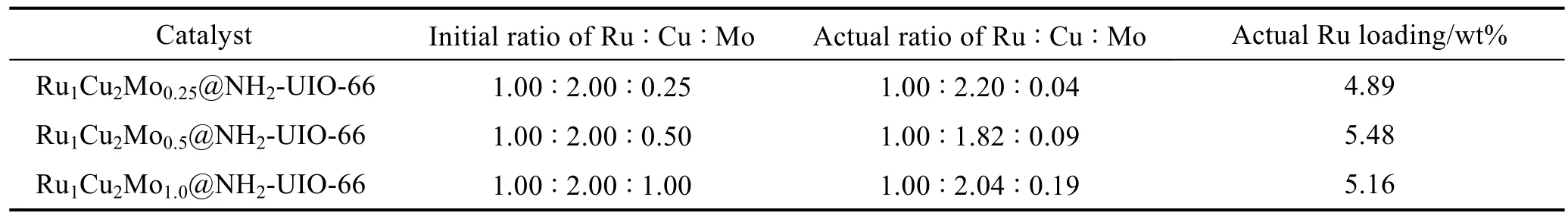
表1 ICP-AES对RuCuMo@NH2-UIO-66催化剂中的元素分析结果Table 1 ICP-AES analyses of RuCuMo@NH2-UIO-66 catalysts with different molar ratios
2.6 催化性能分析
图6为催化剂RuCuMo@NH2-UIO-66在25 ℃下对氨硼烷(AB)水解产氢的性能分析。图6(a)表明,与单金属和双金属负载型催化剂相比,三金属RuCuMo@NH2-UIO-66表现出更高的催化活性,且产氢速率是单金属 Ru负载型的 2倍,是双金属RuCu负载型的1.75倍,充分证实贵金属Ru和非贵金属CuMo纳米颗粒之间存在明显的协同作用,Cu和Mo的引入能显著增强RuCuMo@NH2-UIO-66对AB水解的活性,这种协同作用可能是由Ru、Cu、Mo之间的电子效应和几何效应引起的[30-31]。Ru、Cu和Mo的电负性分别为2.20、1.90、2.16,Ru与Cu的电负性差值较大,它们之间将产生强的电子效应。而Ru与Mo的电负性相近,且晶体结构相似,在金属合金的形成过程中,Mo金属原子会替代少部分 Ru原子而保持 Ru纳米晶的密堆积结构,使得 Ru和Mo的协同作用表现出几何效应。基于三金属强的电子效应和几何效应,使三金属负载型催化剂比单金属负载型催化剂具有更高的催化活性。此外,由于受到 NH2-UIO-66空间上的限制,负载后的金属纳米粒子尺寸明显减小,增大了纳米粒子与氨硼烷分子的有效接触面积,同时 NH2-UIO-66骨架中苯环的π键电子云将与纳米金属颗粒的d电子云相互叠加,从而增强金属表面的电子密度,促进催化中心与氨硼烷分子形成活性中间体,提供更多有利于氨硼烷水解反应进行的位点。上述双功能效应使得三金属负载型催化剂表现出优异的催化活性,因此加入非贵金属CuMo对于提高AB催化活性具有重要意义。
此外,当 Ru、Cu和 Mo单金属含量与催化剂Ru1Cu2Mo0.5@NH2-UIO-66中金属含量保持相同时,单金属混合型催化剂 Ru@NH2-UIO-66 +Cu@NH2-UIO-66 + Mo@NH2-UIO-66以及纯RuCuMo纳米粒子的活性远低于三金属催化剂Ru1Cu2Mo0.5@NH2-UIO-66,而纯载体 NH2-UIO-66没有催化活性。由此可见,RuCuMo纳米粒子与NH2-UIO-66的结合可以增强RuCuMo@NH2-UIO-66催化剂的反应活性,这是由于 RuCuMo纳米粒子具有更强的协同作用,而且 NH2-UIO-66也为RuCuMo纳米粒子提供了良好的 3D框架,同时-NH2作为锚锭基团,与金属离子产生强配位作用[32],使金属牢固地负载到载体上,从而使金属纳米粒子在NH2-UIO-66上分布均匀、尺寸小、不易团聚、催化活性高。

图6 (a) RuCuMo纳米粒子,Ru@NH2-UIO-66+Cu@NH2-UIO-66+Mo@NH2-UIO-66,Ru@NH2-UIO-66;Ru1Cu2@NH2-UIO-66,CuMo@NH2-UIO-66,Ru1Cu2Mo0.5@NH2-UIO-66,NH2-UIO-66;(b) Ru1Cux Mo0.5@NH2-UIO-66和(c)Ru1Cu2 Moy@NH2-UIO-66的氨硼烷水解产氢速率曲线Fig.6 Plots of time vs.n(H2)/n(NH3BH3) from the hydrolysis of AB (18.5 mg):(a) RuCuMo NPs,Ru@NH2-UIO-66+Cu@NH2-UIO-66+Mo@NH2-UIO-66,Ru@NH2-UIO-66,Ru1Cu2 @NH2-UIO-66,CuMo@NH2-UIO-66,Ru1Cu2Mo0.5@NH2-UIO-66,NH2-UIO-66;(b) Ru1CuxMo0.5@NH2-UIO-66,and (c) Ru1Cu2Moy@NH2-UIO-66
图6(b)表示当摩尔比n(Ru)/n(Mo)=1.0:0.5时(Ru的加入量为0.05 mmol),改变Cu的加入量,研究了RuCuxMo0.5@NH2-UIO-66 (x=1,2,3) 在25 ℃时的催化活性,发现当Cu的加入量为0.1 mmol时,产氢速度最快,活性最高。但随着Cu量的增大,过量的Cu会掩盖Ru的活性位点,反而使催化活性降低。图6(c)表示当n(Ru)/n(Cu)=1 :2时,改变Mo的加入量,研究了Ru1Cu2Moy@NH2-UIO-66 (y=0.25,0.50,1.00)的催化活性,发现当Mo的加入量为0.025 mmol时,催化剂的产氢速度最快。上述结果表明,当 Ru、Cu、Mo 的摩尔比为 1.00 :2.00 :0.50 时,Ru1Cu2Mo0.5@NH2-UIO-66对AB水解的活性最强。
为了测定 Ru1Cu2Mo0.5@NH2-UIO-66催化水解AB 反应的活化能(Ea),分别在不同温度(25~40 ℃)下进行实验。图7(a)表明催化反应速率随温度的升高而加快。图7(b)为相应的催化反应的阿伦尼乌斯曲线(lnK~1/T),通过计算得到反应活化能(Ea)为30.1 kJ⋅mol-1,转化频率(TOF)为180.83
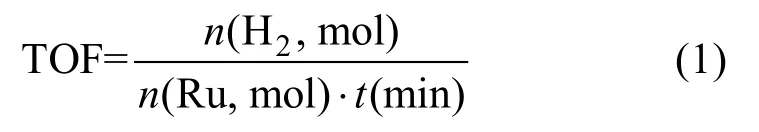
与其他钌基催化剂相比(表2),合成的催化剂Ru1Cu2Mo0.5@NH2-UIO-66的Ea低,TOF高,优势显著。为了探究其稳定性,进行了5次循环性能测试实验,结果如图7(c)所示。经过5次循环后,催化活性分别保持100.0%、93.1%、83.7%、80.0%、60.0%,可见该催化剂具有较好的循环稳定性。催化剂在五次循环后活性有所降低,可能与水解过程中溶液的粘度增加或偏硼酸盐浓度增加有关[33]。
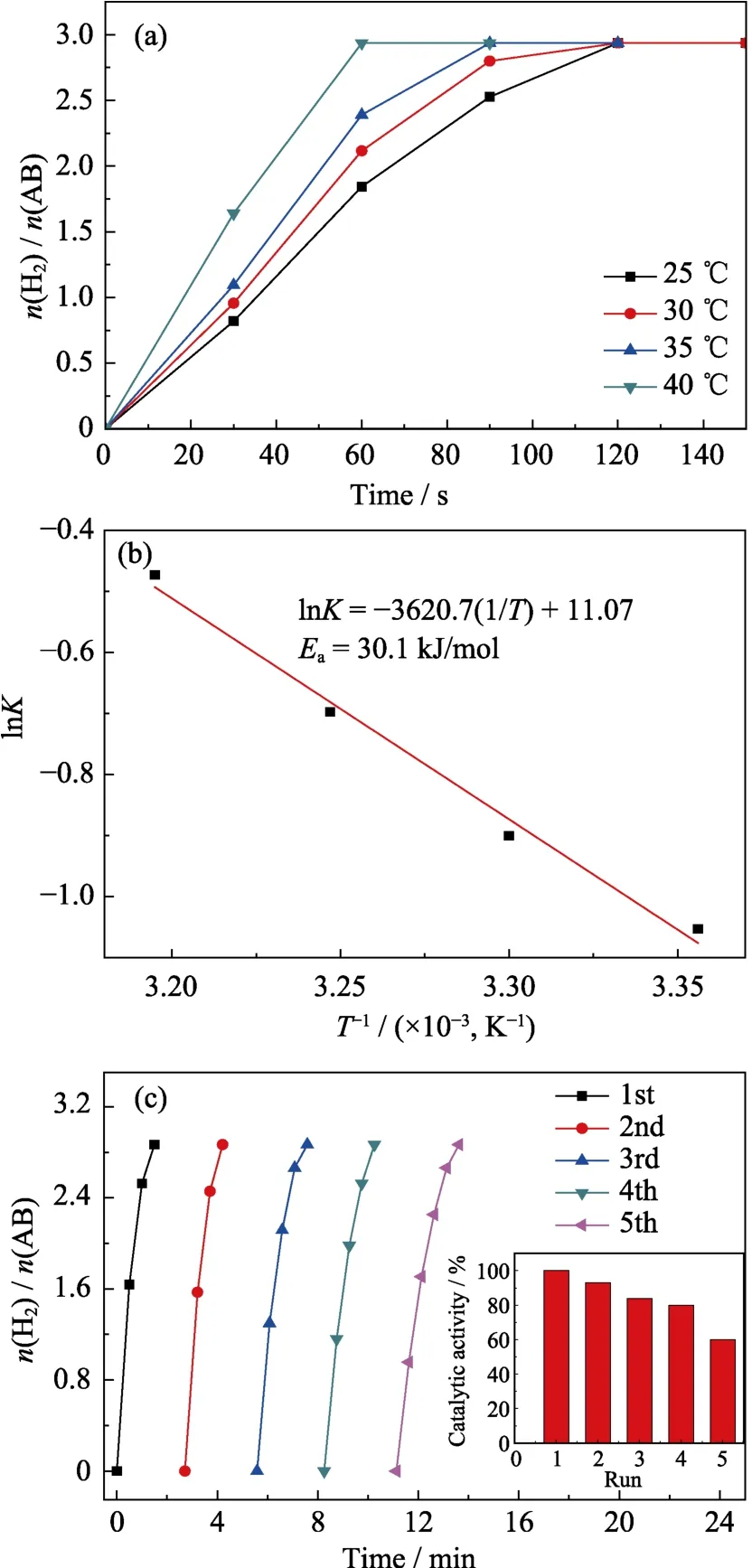
图7 温度对 Ru1Cu2Mo0.5@NH2-UIO-66催化水解氨硼烷的影响曲线(a)及其相应的阿伦尼乌斯图(b),Ru1Cu2Mo0.5@NH2-UIO-66的5次循环稳定性图(c)Fig.7 Plots of time vs.n(H2)/n(NH3BH3) for the hydrolysis of AB (18.5 mg) aqueous solution catalyzed by Ru1Cu2Mo0.5@NH2-UIO-66 at different temperatures(a),and the corresponding Arrhenius plot (b),and reusability test for the Ru1Cu2Mo0.5@NH2-UIO-66 within five cycles(c)
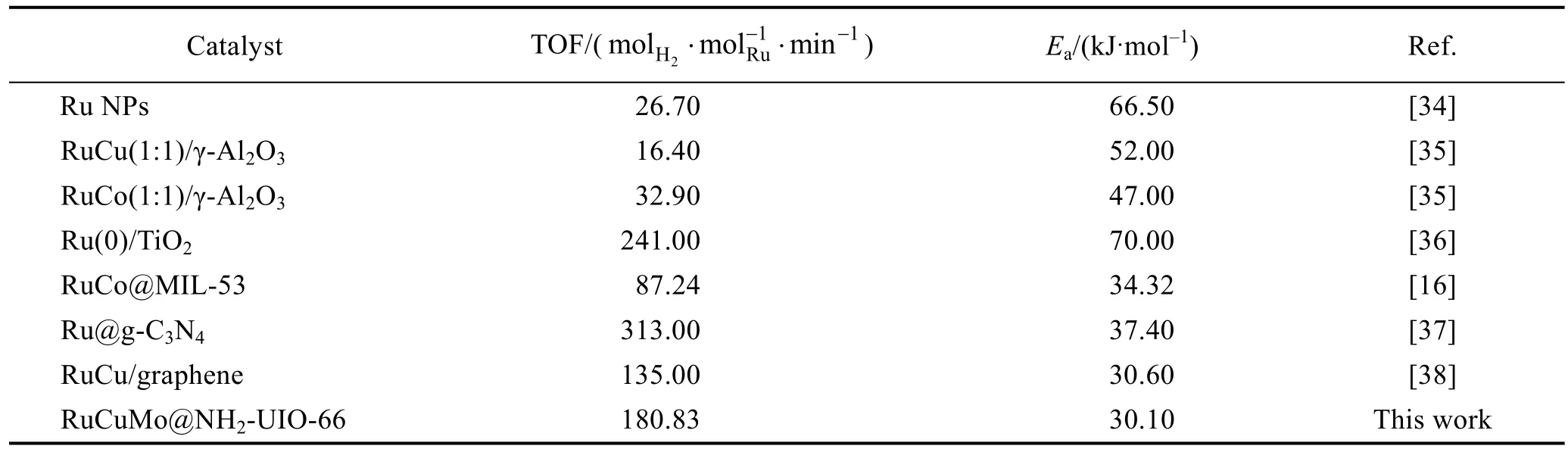
表2 不同钌基催化剂用于AB水解脱氢的催化活性Table 2 Catalytic activities of different Ru-based catalysts used for the hydrolytic dehydrogenation of AB
3 结论
通过浸渍还原法成功合成出一系列 Ru@NH2-UIO-66、RuCu@NH2-UIO-66、CuMo@NH2-UIO-66、RuCuMo@NH2-UIO-66等负载型纳米催化剂并用于催化 AB水解产氢。实验证明,三金属催化剂Ru1Cu2Mo0.5@NH2-UIO-66表现出最高的催化活性,这归因于Ru、Cu和Mo纳米颗粒之间的强协同作用、RuCuMo纳米粒子与 NH2-UIO-66之间的双功能效应以及 MOF上氨基的锚锭作用。催化反应的活化能(Ea)和转化频率(TOF)分别为 30.1 kJ⋅mol-1和选择特殊结构载体和引入非贵金属 CuMo可以显著提高催化剂的活性,对于催化剂的应用和发展具有重要意义。
- 无机材料学报的其它文章
- C/SiOC Composites by a Modified PIP Using Solid Polysiloxane:Fabrication,Microstructure and Mechanical Properties
- Fabrication and Property of Yb:CaF2 Laser Ceramics from Co-precipitated Nanopowders
- Preparation of CeO2/Flake-like CdS Composites as High-performance Photoanodes for Photoelectrochemical Cathodic Protection
- TiO2@SiO2复合材料的制备及其光催化与抗菌性能的研究
- 一步法合成特异性pH响应碳量子点及其发光机理研究
- 高质量水系钠离子电池正极Fe4[Fe(CN)6]3的合成及其电化学性能

