冠心病患者外周血T细胞免疫球蛋白黏蛋白分子3表达变化及临床意义
陈武奇,谢佳佳,杨瑶琳
(广东省第二人民医院,广州 510317)
冠状动脉粥样硬化性心脏病(CAD)是因冠状动脉粥样硬化引发冠状动脉狭窄、硬化、堵塞,从而导致心肌供血不足或坏死的一种心脏疾病。CAD是最为常见的心血管疾病之一,日趋成为引发全球人民死亡的主要原因[1]。动脉粥样硬化是CAD的发病基础,且动脉粥样硬化不稳定斑块的破裂、血小板的聚集及血栓形成后造成的冠状动脉急性狭窄和闭塞是导致急性冠状动脉综合征(ACS)的重要原因[2]。动脉粥样硬化斑块中存在着多种多样的免疫细胞,其中单核/巨噬细胞和T细胞是最主要的免疫成分,当单核细胞和T细胞向血管内膜迁移时便触发了动脉粥样硬化的过程[3]。近年发现的一种新型免疫调节分子——T细胞免疫球蛋白黏蛋白分子3(Tim-3)是适应性免疫反应的负调控分子,在炎症反应中发挥着重要作用[4]。且Tim-3对T细胞、巨噬细胞等免疫细胞都有调节作用[5],而这些免疫细胞都参与到动脉粥样硬化的进程中,提示我们Tim-3可能参与到动脉粥样硬化的免疫调节。因此本研究观察了CAD患者外周血T细胞免疫球蛋白、Tim-3和炎症因子的表达情况,探讨Tim-3在CAD中与炎症因子及病情的关系。
1 资料与方法
1.1 临床资料 选取2018年3月~2018年11月收入我院的CAD患者88例。所有患者因主诉胸痛而入院,进行冠状动脉造影、心电图、体格等检查后,依据美国心脏病学会和美国心脏病协会(ACC/AHA)指南[6],冠状动脉造影确诊为冠状动脉病变(冠状动脉中至少有一支血管病变直径狭窄程度≥50%)的患者为CAD患者。排除标准:自身有免疫系统疾病者;糖尿病、肝肾功能不全者;合并感染性疾病、脑血管疾病或恶性肿瘤者;近年来接受过免疫抑制治疗者。88例CAD患者根据病情分为ACS 46例(ACS组)、稳定型心绞痛(SAP)42例(SAP组)。ACS组男22例、女24例,年龄(58.92±5.36)岁,BMI(22.48±3.06)kg/m2;SAP组患者男21例、女21例,年龄(58.02±5.09)岁,BMI(22.63±3.12)kg/m2。同时选取同期因胸痛入院,但冠状动脉造影确诊为正常的受试者40例为对照组。对照组男21例、女19例,年龄(57.98±5.26)岁,BMI(21.93±3.02)kg/m2。所有患者自愿签署知情同意书,且试验得到本院伦理委员会的批准。三组患者的基线资料间的差异均无统计学意义,具有可比性。
1.2 方法 所有患者于清晨空腹时采集静脉血3 mL,采用梯度离心法分离得到外周血单个核细胞(PBMC)。采集静脉血5 mL,制备血清以备免疫球蛋白、炎症相关因子的检测。
1.2.1 外周血不同T细胞亚群上Tim-3的表达 将100 μL PBMC置于流式管中,其中一份加入荧光标记的抗人CD4和Tim-3单克隆抗体来检测Tim-3在CD4+T细胞上的表达。另外一份加入荧光标记的抗人CD8和Tim-3单克隆抗体用来检测Tim-3在CD8+T细胞上的表达。当抗体标记完毕后,在4 ℃避光条件下孵育30 min,PBS洗涤2次后,4 ℃避光条件下1 500 r/min离心5 min,弃去上清后加入500 μL PBS重悬后利用流式细胞仪(美国Beckman-Coulter)进行检测。荧光标记的单克隆抗体购自美国美国Beckman-Coulter公司。
1.2.2 外周血免疫球蛋白检测 利用免疫散射比浊法(美国BECKMAN ARRAY 360 SYSTEM)检测患者外周血中的IgA、IgG、IgM及补体C3、C4。
1.2.3 血清炎症相关指标检测 采用ELISA检测三组血清超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)。ELISA试剂盒购自上海晶抗生物工程有限公司,按照说明书进行操作。
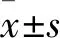
2 结果
2.1 三组外周血T细胞上Tim-3表达比较 ACS组、SAP组外周血CD4+T、CD8+T细胞中Tim-3表达率均高于对照组(P均<0.05),且ACS组均高于SAP组(P均<0.05)。见表1。
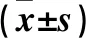
表1 三组外周血CD4+T细胞和CD8+T细胞中Tim-3的表达比较
注:与对照组相比,*P<0.05;与SAP组相比,#P<0.05。
2.2 三组外周血免疫球蛋白、补体水平比较 ACS组、SAP组外周血IgG、补体C3和C4水平高于对照组(P均<0.05),且ACS组高于SAP组(P均<0.05),三组IgA和IgM水平比较差异无统计学意义。

表2 三组血清免疫球蛋白、补体水平比较
注:与对照组相比,*P<0.05;与SAP组相比,#P<0.05。
2.3 三组血清炎症相关因子水平比较 ACS组、SAP组血清TNF-α、hs-CRP水平高于对照组(P均<0.05),且ACS组高于SAP组(P均<0.05)。
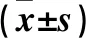
表3 三组血清炎症相关因子水平比较
注:与对照组相比,*P<0.05;与SAP组相比,#P<0.05。
2.4 炎症相关因子、T细胞免疫球蛋白与Tim-3表达率的相关性 ACS组CD4+T细胞中Tim-3的表达率与TNF-α、hs-CRP、IgG、C3和C4呈正相关(r分别为0.610、0.631、0.522、0.457、0.436,P均<0.05);CD8+T细胞中Tim-3的表达率与TNF-α、hs-CRP、IgG、C3和C4亦呈正相关(r分别为0.623、0.537、0.469、0.451、0.416,P均<0.05)。SAP组CD4+T细胞中Tim-3的表达率与TNF-α、hs-CRP、IgG、C3和C4呈正相关(r分别为0.579、0.533、0.539、0.422、0.412,P均<0.05);CD8+T细胞中Tim-3的表达率与TNF-α、hs-CRP、IgG、C3和C4亦呈正相关(r分别为0.553、0.447、0.411、0.402、0.396,P均<0.05)。
3 讨论
CAD是一个多种因素参与的缓慢发展的疾病,其发病基础为动脉粥样硬化。而动脉粥样硬化不稳定性斑块的破裂、血小板聚集导致血栓的形成造成的冠状动脉急性狭窄是导致ACS的重要原因。其中免疫反应和炎症反应在动脉粥样硬化斑块中的形成、在促进动脉粥样硬化发生发展中起着不可忽视的作用。外周T细胞亚群分为CD4+T细胞和CD8+T细胞。CD4+T细胞又称为辅助/诱导性T细胞(Th),分为Th1、Th2、Th17和调节性T细胞等多个亚型。CD4+T细胞的功能为合成并产生细胞因子,协助B细胞分泌抗体、调节其他T细胞的免疫应答,达到维持免疫平衡的作用。CD8+T细胞为抑制性/细胞毒T细胞,主要发挥抑制体液和细胞免疫的功能,表现出细胞毒活性[7]。动脉粥样硬化斑块中的T细胞亚群主要以CD4+T细胞为主,T细胞特异识别动脉粥样硬化抗原后,氧化低密度脂蛋白和热休克蛋白,导致IL-2、TNF-α、hs-CRP等促炎因子的分泌,促进免疫细胞在血管中的粘附,加重血管炎症反应,进一步加快动脉粥样硬化斑块的形成和发展[8,9]。有研究发现,Th分化失衡是诱导动脉粥样硬化发展的重要因素之一。人体研究已证实,Th分化失衡会加速动脉粥样硬化斑块的发展、诱导斑块的不稳定性从而导致斑块的破裂[10,11]。故而炎症免疫调节的机制逐渐成为研究的热点,同时炎症免疫调节机制的研究也有可能成为动脉粥样硬化治疗的新途径。本研究发现,ACS组、SAP组中IgG、补体C3和C4的水平均较对照组高,且ACS组较SAP组升高的更为显著。另一方面,ACS组血清炎症因子TNF-α、hs-CRP水平高于SAP组、对照组,且SAP组高于对照组。其中可能的原因为:IgG的增高会拮抗已经暴露的平滑肌细胞支架成分,会加重血管的损伤。同时补体激活后会产生大量的驱化因子,会加剧缺血组织的损伤。此外,补体及其产物也可通过非中性粒细胞依赖的机制来损害缺血心肌功能,加速免疫复合物的沉积,与炎症因子TNF-α和hs-CRP共同加速动脉粥样硬化的形成过程[12]。说明TNF-α、hs-CRP、IgG和补体与CAD病变的过程以及冠状动脉狭窄的程度具有一定的联系。故而ACS患者外周血T细胞免疫球蛋白及炎症因子表达最多。
Tim-3是一种新型免疫调节分子,其选择性表达在分化中末期的Th细胞上,介导免疫耐受反应。因此Tim-3表达的抑制已成为部分实体瘤的免疫治疗方法之一[13,14]。Tim-3除了在T细胞上表达外,也在巨噬细胞、树突细胞上表达,参与天然免疫调节。Tim-3与其配体半乳糖结合蛋白-9结合后会导致T细胞的凋亡,起到负调控作用,抑制T细胞的功能,促进炎症发展[15,16]。本研究结果显示,ACS组、SAP组外周血CD4+T、CD8+T细胞中Tim-3表达率显著高于对照组。Tim-3的高表达可能说明了T细胞功能的紊乱和耗竭,同时ACS组Tim-3表达显著高于SAP组,可能也提示着Tim-3的表达率与CAD的病情严重程度、冠状动脉狭窄程度有密切的关系。即在CAD早期,Tim-3与受体结合后通过抑制T细胞的活性,造成机体免疫功能失衡,而随着病情的加重,免疫失衡作用更为严重。这也为Tim-3在检测CAD疾病进展中作为关键的标记物和治疗靶点提供了新的思路,但是Tim-3在不同病情的CAD(ACS和SAP)中调控CD4+T、CD8+T细胞的机制仍需进一步深入研究。Pearson相关性分析结果显示:CD4+T、CD8+T细胞中Tim-3的表达率均与TNF-α、hs-CRP、IgG、C3和C4呈正相关,显示TNF-α、hs-CRP、IgG和补体与CAD病变的过程以及冠状动脉狭窄的程度具有一定的相关性。Tim-3对CD4+T、CD8+T细胞在CAD病情发展中具有重要的调控作用。即Tim-3通过NF-κB调控TNF-α增加后,表达增多的hs-CRP与脂蛋白结合后激活补体系统,产生大量终末蛋白,在与TNF-α的共同作用下导致血管损伤、促使动脉粥样硬化形成,使斑块不稳定性增加[17,18]。
综上所述,Tim-3在CAD患者外周血CD4+T、CD8+T细胞高表达,且Tim-3与CAD患者的病情和冠状动脉狭窄程度有一定的关系,有望成为监测CAD病情变化的新指标。

