TGF-β诱导早期基因1对MG-63细胞成骨分化能力的调控作用及其机制
延育强,唐蓉,刘小溪,高博宇,殷霄
(1 西安交通大学医学院附属西安市中心医院,西安 710003;2榆林市中医医院)
成骨细胞分化是骨形成、重建及损伤修复的始动环节,促进成骨细胞分化对临床治疗骨质疏松、加速骨折愈合等有积极意义。众多研究表明,TGF-β/Smads和Wnt/β-catenin信号通路都参与了间充质前体细胞向成骨细胞分化的过程[1~3],同时这两种信号通路之间存在紧密联系并在细胞分化过程中相互作用[4~6]。TGF-β诱导早期基因1(TIEG1)是人成骨细胞中的TGF-β信号下游分子[7]。我们前期研究结果表明,在诱导骨肉瘤来源的MG-63细胞系向成骨细胞分化时,RNA干扰抑制TIEG1会导致细胞中成骨标志物的表达量降低[8]。这表明TIEG1参与了MG-63向成骨细胞分化的调控,然而其中的机制却并不明确。有研究表明,在包括MG-63在内的多种骨肉瘤来源细胞向成骨细胞分化时,Wnt信号通路发挥着不可或缺的作用并且能够直接诱导细胞表达成骨细胞分化标志物Runt相关转录因子2(Runx2)[9]。因此本研究应用小RNA干扰技术建立了TIEG1表达抑制的MG-63细胞系,通过观察其在被诱导分化后的生物学特性及Wnt信号下游因子变化情况,以探讨TIEG1对成骨细胞分化可能的调控机制。
1 材料与方法
1.1 材料 人MG-63细胞系购于ATCC公司;α-MEM培养基、胎牛血清、脂质体转染试剂Lipofectamine2000、RNA提取试剂TRIzol、Geneticin(G418)、Alexa Fluor 594标记荧光二抗、RevertAid First Strand cDNA Synthesis Kit反转录试剂盒购于Thermofisher公司;定量PCR用SYBR Premix EX Taq酶购于TaKaRa公司;细胞全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒购于凯基生物科技发展有限公司;抗TIEG1抗体、抗β-actin抗体、抗β-catenin抗体购于Abcam公司;HRP标记的山羊抗兔二抗购于Millipore公司;碱性磷酸酶(ALP)检测试剂盒购于南京建成生物工程研究所;配置成骨细胞分化诱导培养液所用的L-抗坏血酸、β-磷酸甘油、地塞米松以及茜素红S购于Sigma-Aldrich公司。
1.2 TIEG1表达抑制MG-63细胞株的建立 将MG-63细胞系培养于添加10%胎牛血清的α-MEM培养液中,培养条件为37 ℃、5% CO2、饱和湿度细胞培养箱。针对TIEG1的RNA干扰序列的shRNA表达质粒pGPH1/GFP/Neo TIEG1 KD已于先前试验中建立且已验证TIEG1敲减效率[8]。取生长状态良好的MG-63细胞,按照操作手册中的方法用Lipofectamine2000转染shRNA表达质粒,24 h后传代,再过24 h后给细胞中添加400 μg/mL(浓度已由预试验确定)的G418抗生素压力筛选稳定表达shRNA的细胞株,培养2周后荧光显微镜观察细胞绿色荧光,将获得稳定转染的TIEG1表达抑制细胞系命名为MG-63/TIEG1 KD细胞用于后续试验。
1.3 MG-63/TIEG1 KD细胞中TIEG1 mRNA表达检测 采用实时定量PCR法。分别取正常MG-63(MG-63/WT)细胞及MG-63/TIEG1 KD细胞,用TRIzol分别提取两种细胞总RNA并测定RNA浓度。之后用RevertAid First Strand cDNA Synthesis Kit试剂盒将各组样本中1 μg RNA逆转录成cDNA进行实时定量PCR检测。合成TIEG1引物。取1 μL cDNA配制20 μL SYBR Premix EX Taq反应体系,用Bio-Rad CFX96实时PCR系统读取反应数据,使用2-ΔΔCt法得出TIEG1 mRNA相对表达量。
1.4 MG-63/TIEG1 KD细胞中TIEG1蛋白表达检测 采用Western blotting法。分别取MG-63/WT细胞及MG-63/TIEG1 KD细胞,按照试剂盒操作手册中的方法提取细胞全蛋白并用BCA蛋白浓度测定试剂盒进行定量,加入5×SDS Loading Buffer后开水煮沸5 min进行蛋白变性。配制SDS-聚丙烯酰氨凝胶,各组取等量蛋白样本及蛋白marker上样进行电泳。之后取出凝胶根据蛋白分子量大小按照marker指示的位置截取凝胶并转移至PVDF膜上,用5%脱脂牛奶的TBST封闭1 h。分别用抗TIEG1抗体(1∶500稀释),抗β-actin抗体(1∶1 000稀释)室温孵育1 h,4 ℃过夜后TBST洗涤4次。加入HRP标记的山羊抗兔二抗(1∶5 000稀释)室温孵育1 h,TBST洗膜4次后用GE Amersham ECL prime化学发光剂显影,ImageQuant 350成像系统中照相。
1.5 MG-63/TIEG1 KD细胞成骨分化及矿化能力检测 取MG-63/WT细胞及MG-63/TIEG1 KD细胞,分别将细胞按5×104个细胞/孔的密度接种至24孔培养板中培养24 h。之后将培养液换成含有50 ng/mL的L-抗坏血酸、10 mmol/L的β-磷酸甘油钠及1×10-8mol/L地塞米松的分化诱导培养液[10]。每隔3 d更换培养液前收集上清液,用ALP检测试剂盒配置反应液,通过检测反应后混合液在405 nm波长的吸光度,比较两种细胞分泌ALP能力。在诱导培养24 d后,对两种细胞形成的矿化结节进行茜素红S染色,光镜下观察。
1.6 MG-63/TIEG1 KD细胞分化过程中Wnt/β-catenin信号通路变化检测 将MG-63/WT细胞及MG-63/TIEG1 KD细胞按2×105个细胞/孔的密度接种至6孔培养板进行成骨分化诱导培养,7 d后收集细胞提取RNA及全蛋白,检测Runx2以及β-catenin的mRNA及蛋白表达。另将两种细胞以1×105个细胞/皿的密度接种至35 mm玻底皿中成骨分化诱导培养,7 d后采用细胞免疫荧光法观察MG-63/WT和MG-63/TIEG1 KD在成骨诱导分化后细胞中β-catenin蛋白分布情况。
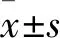
2 结果
2.1 MG-63/TIEG1 KD细胞TIEG1 mRNA及蛋白表达 MG-63/TIEG1 KD细胞稳定表达绿色荧光,说明shRNA表达质粒pGPH1/GFP/Neo TIEG1 KD已整合在细胞基因组DNA上并稳定表达目的shRNA。MG-63/TIEG1 KD细胞TIEG1 mRNA及蛋白相对表达量分别为0.27±0.15、0.37±0.06,MG-63/WT细胞分别为1.00±0.23、0.76±0.02,MG-63/TIEG1 KD细胞中TIEG1 mRNA及蛋白相对表达量较MG-63/WT细胞降低(P均<0.05)。
2.2 MG-63/TIEG1 KD细胞分化矿化能力的变化 对MG-63/WT及MG-63/TIEG1 KD细胞进行成骨分化诱导后,细胞ALP分泌能力均有所增强。但诱导第12天开始,MG-63/TIEG1 KD细胞培养液中ALP水平低于MG-63/WT细胞(P<0.05),且随着诱导时间增加,其分泌ALP能力有所降低(P均<0.05)。见表1。茜素红S染色光镜下观察,在诱导第4周,MG-63/WT细胞已经广泛分泌出较多且大的矿化结节,而MG-63/TIEG1 KD则仅能观察到少量散在的小矿化结节。

表1 MG-63/WT及MG-63/TIEG1 KD 细胞诱导后不同时间ALP分泌水平比较(吸光度,
注:与MG-63/WT细胞同时间点比较,*P<0.05。
2.3 MG-63/TIEG1 KD细胞成骨分化过程中成骨标志物Runx2及Wnt信号通路变化 诱导前,两种细胞Runx2 mRNA表达差异无统计学意义(P>0.05),MG-63/TIEG1 KD细胞中Runx2蛋白表达高于MG-63/WT细胞(P<0.05)。诱导分化刺激后,两种细胞Runx2 mRNA及蛋白表达均上升(P均<0.05),MG-63/TIEG1 KD细胞上升幅度较MG-63/WT细胞低(P均<0.05)。见表2。诱导分化前,两种细胞β-catenin mRNA表达差异无统计学意义差别(P>0.05);诱导分化后,两种细胞中β-catenin mRNA均较诱导前上升(P均<0.05),MG-63/TIEG1 KD细胞中β-catenin mRNA上升幅度较MG-63/WT细胞低(P<0.05)。 MG-63/TIEG1 KD细胞β-catenin蛋白表达则在诱导前后都低于MG-63/WT(P均<0.05)。见表3。免疫荧光方法观察结果表明,MG-63/WT细胞分化后β-catenin蛋白主要分布于细胞核且分布明显,而MG-63/TIEG1 KD细胞中β-catenin蛋白则较少。
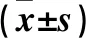
表2 MG-63/WT及MG-63/TIEG1 KD细胞诱导前后Runx2 mRNA及蛋白表达比较
注:与本组诱导前比较,*P<0.05;与MG-63/WT细胞同时间点比较,△P<0.05。
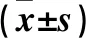
表3 MG-63/WT及MG-63/TIEG1 KD细胞诱导前后β-catenin mRNA及蛋白表达比较
注:与MG-63/WT细胞同时间点比较,*P<0.05。
3 讨论
研究表明,许多经典下游信号分子通过smads参与调节成骨相关蛋白形成,如Runx2、ALP、骨钙蛋白(OCN)等[6,11]。TGF-β是成骨细胞分化过程中重要的信号通路。TIEG1作为TGF-β下游分子,其参与成骨细胞分化调控的研究较少。有学者研究显示,在包括肿瘤的多种细胞中,过表达TIEG1都可促进细胞分化、抑制细胞增殖并诱导细胞凋亡[12~14]。成骨发育研究表明TIEG1参与了机体成骨调控[15],离体实验表明其参与了机械应力诱导人牙周膜细胞的成骨向分化[16],能够正向促进潜能细胞分化为成骨细胞。在本研究中,我们通过建立稳定的TIEG1基因抑制细胞株并观察其分化特性,揭示TIEG1对MG-63成骨分化后分泌ALP并生成矿化产物有着重要的调控作用。有研究发现,过表达TIEG1能够促进牙乳头间充质细胞分化为成牙本质细胞,并促进细胞分泌ALP及形成矿化结节的能力[17],本研究结果与此类似,说明TIEG1同时参与调控形成人体矿化组织时细胞的胞外基质分泌功能。
TIEG1作为下游分子参与了TGF-β信号通路对成骨细胞表达分化标志性蛋白的调控,如Runx2、OPG等[18],然而TIEG1是如何作用于这些效应分子却缺乏研究。我们的研究结果表明,TIEG1基因敲减会造成MG-63/WT细胞在分化诱导时Runx2表达量不足。Wnt信号直接通过其下游核心分子β-catenin调控Runx2,且Runx2的调控可能是TGF-β和Wnt信号相互作用的结果,因此我们猜想TIEG1可能与β-catenin存在一定联系。本研究检测TIEG1基因敲减后β-catenin的表达,表明缺乏TIEG1的MG-63/WT细胞β-catenin表达也显著下降,说明TIEG1对β-catenin有着正向调控作用。β-catenin作为转录因子,其对细胞作用需要通过与目的基因启动子结合而实现。β-catenin的调控主要包含3种方式:调节其蛋白表达水平及稳定性、辅助或阻碍其核转位、影响其转录调节活性[19]。我们免疫荧光结果发现,TIEG1缺失的细胞在诱导分化后大多数β-catenin表达仍位于细胞核,但其表达量却较正常细胞减少,提示TIEG1对β-catenin的调控可能是第1种方式。TIEG1是一个包含480个氨基酸的蛋白,在其C末端有3个锌指结构域,这3个锌指结构域可与DNA结合,而其N末端则富含蛋白间结合结构。这表明TIEG1是一个功能丰富的转录因子,它可通过与效应分子的启动子结合,直接在转录水平调节其表达[7]。但是,最终确定其是否通过这种方式调节β-catenin仍需要进一步通过基因免疫共沉淀等手段进行验证。

