Survivin、AQP9和HLA-G在子痫前期患者中的表达水平及相关性
曾玲娟 汤艳 喻玲 丁依玲 赖微斯 胡芸
1中南大学湘雅二医院妇产科(长沙410000);2湖南省妇幼保健院B 超室(长沙410008)
子痫前期是一种妊娠并发症,严重危害产妇和婴儿的健康,其发病机制目前尚未明确。临床研究指出,胚胎滋养细胞凋亡以及其侵袭力异常是造成子痫前期发病重要原因[1]。Survivin 是近几年新发现的凋亡抑制蛋白,Smac 与Survivin 之间具有紧密的联系[2],目前关于Survivin 是否参与子痫前期发病,相关研究较少。水通道蛋白9(aquaporin9,AQP9)在细胞的分化和迁移过程中发挥着重要作用,AQP9 显示高表达,会导致滋养细胞加速凋亡,其迁移能力降低,抑制细胞分化和融合,造成胎盘组织发生缺血缺氧[3]。有研究指出,子痫前期的发生发展主要和绒毛膜外滋养细胞的侵袭能力下降有关,人类白细胞抗原G(human leukocyte antigen G,HLA-G)属于HLA-Ⅰ类分子,对母体与胎儿的免疫耐能力起到诱导作用[4-5]。本文旨在研究Survivin、AQP9 和HLA-G 在子痫前期患者中的表达水平及相关性。
1 资料与方法
1.1 一般资料本文选取2016年6月至2018年6月在我院就诊的子痫前期患者50例,分为子痫前期组,年龄23~40 岁,平均(31.5 ± 5.1)岁,孕周30~40 周,平均(35.1±3.0)周;另外选取在我院进行产检的健康妊娠期产妇50例作为正常组,年龄22~38 岁,平均(30.5 ± 5.3)岁,孕周28~40 周,平均(34.8 ± 3.6)周。两组研究对象在平均年龄、平均孕周上比较,无统计学差异(P>0.05),具有可比性。纳入标准:均符合子痫前期的诊断标准;有完整的产检记录患者;正常孕妇无任何妊娠期合并症。排除标准:排除有严重心肺功能不全的患者;排除患有精神疾病的患者;排除病例资料不全的患者,畸形胎儿患者;患者孕前患有心血管疾病并且服用治疗心血管的药物患者。本次研究均得到所有研究对象及其家属均知情,并签署了家属知情同意书,且经过我院伦理委员会批准,伦理批准文号(2014)伦审批第(27)号。
1.2 方法
1.2.1 标本采集搜集孕妇分娩5 min 内留取脐带根部的胎盘组织1 cm × 1 cm × 1 cm,使用生理盐水将残留的血液清洗干净,之后使用滤纸将组织上的水分吸干,在冻存管中保存。
1.2.2 免疫透射比浊法检测Survivin 表达水平取3 个试管,分别标记为空白管、标准管以及测定管。空白管中加入15 μL 生理盐水和350 μL Tris缓冲液,标准管中加入15 μL CRP 定标液和350 μL Tris 缓冲液,测定管中加入15 μL 待测标本和350 μL Tris 缓冲液,对3 个试管分别摇晃混匀后,在37 ℃的环境中保存5 min,在波长340~700 nm处读各管吸光度。之后在3 个试管中分别加入羊抗人CRP 抗血清,分别摇晃混匀后在37 ℃的环境中保存5 min,在波长340~700 nm 处读各管吸光度,并对Survivin 水平进行计算。
1.2.3 酶联免疫吸附测定AQP9 和HLA-G 表达水平采用酶联免疫吸附测定检测:50 mmol/L碳酸盐包被缓冲液将抗原进行溶解,浓度为10-20 μg/mL,在96孔酶标板中加入100 μL/孔,4 ℃过夜保存。第二天舍弃包被液,采用PBST 洗涤3 次,没孔中加入1%的150 μL BSA,在37 ℃环境中封闭1 h。之后采用PBST洗涤3次,在每孔中加入100 μL不同倍比稀释度的血清,加入对照样品,37 ℃孵育2 h。采用PBST 洗涤5 次,加入100 μL,稀释后的HRP 标记的二抗,37 ℃孵育1 h。PBST 洗涤5 次,之后,使用显色剂显色20 min 后,在酶标仪上读取A405 吸收值,从而测定AQP9和HLA-G的表达情况。
1.3 统计学方法采用SPSS 20.0 统计软件进行分析,计量资料采用()进行描述,两组间比较采用实施独立样本t检验,P<0.05 则说明差异具有统计学意义。相关性采用Pearson 相关性分析。
2 结果
2.1 正常组、子痫前期组两组Survivin、AQP9 和HLA-G 表达水平比较如表1 所示,子痫前期组患者Survivin、HLA-G 表达水平低于正常组,AQP9表达水平高于正常组,差异具有统计学意义(P<0.05)。说明Survivin、HLA-G 可能参与子痫前期疾病发生发展。
表1 两组Survivin、AQP9 和HLA-G 表达水平比较Tab.1 Comparison of Survivin,AQP9 and HLA-G expression levels in two groups ±s
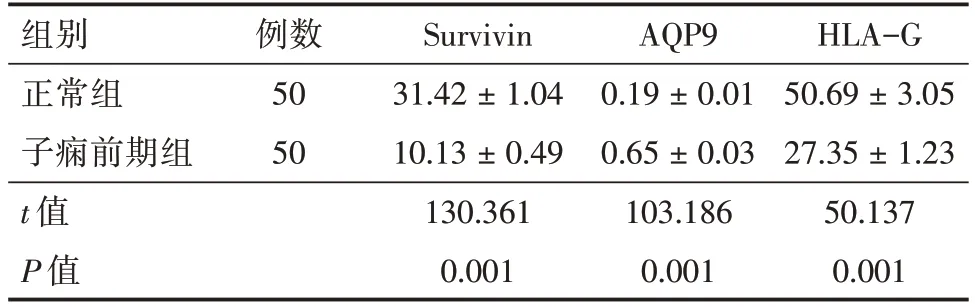
表1 两组Survivin、AQP9 和HLA-G 表达水平比较Tab.1 Comparison of Survivin,AQP9 and HLA-G expression levels in two groups ±s
组别正常组子痫前期组t 值P 值例数50 50 Survivin 31.42±1.04 10.13±0.49 130.361 0.001 AQP9 0.19±0.01 0.65±0.03 103.186 0.001 HLA-G 50.69±3.05 27.35±1.23 50.137 0.001
2.2 Survivin、AQP9 和HLA-G 表达水平与子痫前期患者临床相关性比较如表2 所示,Survivin、AQP9 和HLA-G 表达水平与子痫前期患者年龄、孕周无相关性(P>0.05)。Survivin、AQP9 和HLA-G表达水平与子痫前期患者流产次数、病情严重程度有关(P<0.05)。流产次数≥3 次、重度子痫患者Survivin、HLA-G 表达水平较低,AQP9 表达水平较高,具有统计学差异(P<0.05)。说明Survivin、HLA-G、AQP9 表达水平与子痫前期患者流产、子痫程度有关。
2.3 Survivin、AQP9 和HLA-G 之间的相关性分析如表3 所示,Survivin、AQP9 和HLA-G 之间进行相关性分析,Survivin 和AQP9 之间呈负相关,AQP9 和HLA-G 之间之间呈负相关,Survivin 和HLA-G 之间之间呈正相关,具有统计学差异(P<0.05)。说明Survivin、AQP9 和HLA-G 之间具有相关性,参与了子痫前期的发病过程。
表2 Survivin、AQP9 和HLA-G 表达水平与子痫前期患者临床相关性比较Tab.2 Comparison of Survivin,AQP9 and HLA-G expression levels with clinical correlation in patients with preeclampsia±s

表2 Survivin、AQP9 和HLA-G 表达水平与子痫前期患者临床相关性比较Tab.2 Comparison of Survivin,AQP9 and HLA-G expression levels with clinical correlation in patients with preeclampsia±s
临床资料年龄(岁)流产次数(次)病情严重程度孕周(周)<30≥30<3≥3轻度子痫前期重度子痫前期<35≥35例数26 24 15 35 28 22 25 25 Survivin 10.02±0.55 10.16±0.57 15.23±1.44 10.23±0.53 15.27±0.49 5.438±0.17 10.20±0.48 10.21±0.49 t 值0.902 18.062 90.093 0.092 P 值0.372 0.001 0.001 0.927 AQP9 0.61±0.03 0.63±0.04 1.02±0.06 0.67±0.02 1.09±0.20 0.22±0.02 0.71±0.04 0.69±0.04 t 值2.293 31.805 20.125 1.768 P 值0.026 0.001 0.001 0.083 HLA-G 27.34±1.47 27.56±1.32 35.78±2.12 28.72±0.76 38.46±1.34 20.06±0.94 28.38±0.51 28.11±0.98 t 值0.551 17.430 54.553 1.248 P 值0.584 0.001 0.001 0.218

表3 Survivin、AQP9 和HLA-G 之间的相关性分析Tab.3 Correlation analysis among Survivin,AQP9 and HLA-G
3 讨论
在正常妊娠过程中,绒毛内细胞会分化为合体滋养细胞以及绒毛外滋养细胞。在妊娠早期,绒毛外滋养细胞会脱离绒毛基底部,侵入蜕膜层及蜕膜组织,会取代血管内皮细胞,对血管中层肌的弹力纤维产生破坏作用,导致螺旋动脉扩张,实现子宫螺旋动脉重铸[6-7]。研究数据显示,滋养细胞侵袭能力降低会导致子宫内膜浸润缺乏,导致子宫螺旋动脉重铸出现障碍,全身血管内皮受到损伤,造成子痫前期的病理以及生理表现[8]。
Survivin 属于一种最强的凋亡抑制因子。研究[9-10]指出,Survivin 对滋养细胞的存活和增殖有一定的促进作用,参与胚胎着床和胎盘发育,有助于维持产妇正常妊娠。Survivin 表达异常与滋养细胞凋亡及侵袭有关,造成胎盘绒毛发育不良,导致胎盘缺血以及缺氧,对新生儿的体重以及胎盘质量产生直接的影响,严重的会导致新生儿和产妇死亡[11-12]。本文研究结果显示,子痫前期患者的胎盘组织中,Survivin 表达水平降低,说明Survivin能够对妊娠期产妇的情况进行表达,可能参与了疾病的发病过程。周小娜[13]研究发现,子痫前期组患者的胎盘组织中Survivin 表达水平下降,与本文研究保持一致。因为Survivin 表达水平降低造成滋养细胞增殖能力与细胞侵袭性降低,滋养细胞大量凋亡,导致胎盘着床较浅,胎盘组织缺乏血液供应,表明Survivin 参与子痫前期的发病[14-15]。
重度子痫前期患者的AQP9 表达水平高于轻度子痫患者,AQP9 参与滋养细胞凋亡过程,对滋养细胞凋亡有促进作用,造成胎盘缺氧,导致患者发病[16]。研究发现,在羊膜上皮细胞中AQP9 水平与正常妊娠孕妇已经妊娠高血压患者相比,其表达水平较高[17]。本文研究数据显示,子痫前期患者的胎盘组织中,AQP9 表达水平升高,推测AQP9参与子痫前期的发生和发展,AQP9 表达异常在胎盘组织滋养细胞中作用更加重要。HLA-G 表达水平下降会造成滋养细胞受到母体免疫细胞攻击,导致子宫螺旋动脉重铸受到阻碍,胎盘缺氧,最终子痫前期发生[18-19]。本文结果显示,子痫前期患者的胎盘组织中,HLA-G 表达水平降低,说明HLA-G参与子痫前期发病过程。骆守玲[20]研究显示,子痫前期患者血清中HLA-G 水平与HLA-GmRNA 呈正相关,进一步表明,HLA-G 参与了胎盘组织相应血管的生理性变化。
本文研究数据显示,流产次数≥3 次、重度子痫患者Survivin、HLA-G 表达水平较低,AQP9 表达水平较高,说明Survivin、AQP9 和HLA-G 表达水平与子痫前期患者流产次数、病情严重程度有关,Survivin、HLA-G 表达随着子痫前期患者病情进展降低,AQP9 表达随着子痫前期患者病情进展升高。本文研究数据显示,AQP9 和Survivin、HLA-G之间具有负相关性,当AQP9 表达升高时,Survivin、HLA-G 受到抑制,Survivin、AQP9 和HLA-G参与了子痫前期的发展,在子痫前期中起到重要的调节作用。
综上所述,Survivin、AQP9 和HLA-G 表达与子痫前期具有相关性,Survivin、AQP9 和HLA-G 的异常表达,参与了子痫前期的发展,在子痫前期的临床诊断中具有重要意义。

