老年与非老年食管癌患者经影像学引导下经皮胃造瘘术治疗中的效果比较
王谭 黎海亮 胡鸿涛
郑州大学附属肿瘤医院微创介入科(郑州450008)
食管癌是临床常见的恶性肿瘤之一,我国的食管癌死亡率已位于世界首位,癌症调查显示其死亡率位于我国的第5 位[1]。失去手术切除机会的食管癌患者由于放化疗的副作用,吞咽困难及严重的肿瘤负荷,如果不加干涉,患者的营养状态会持续恶化[3]。而食管癌患者的营养状态也会影响患者对放化疗的耐受性和总生存期[4]。经影像引导下经皮胃造瘘术(percutaneous radiologic gastrostomy,PRG)是指在影像设备引导下,将胃造瘘管通过腹部体表置于患者胃腔内,提供肠内营养[5]。随着这项技术的开展,其在临床上的应用越来越广泛,已成为一种安全、有效的肠内营养手段,为不能进食的患者提高生存质量、改善营养状态、提高原发疾病治疗效果提供重要帮助[6]。在已经步入老龄化社会的中国,老年食管癌患者的比例越来越高,老年患者身体合成代谢功能较差,加上肿瘤负荷对营养需求的增加,发生营养不良的风险更高。但既往有关PRG 的报道或研究很少有评价PRG 在老年食管癌患者治疗中的安全性及临床效果,迄今为止还没有相关报道对老年食管癌与非老年食管癌患者进行PRG 的安全性和临床预后进行比较。本研究对150例行经影像引导的经皮胃造瘘术提供肠内营养的老年与非老年食管癌患者的临床资料进行回顾性分析,现报告如下。
1 资料与方法
1.1 一般资料选取2014年7月至2018年7月间于我院行PRG 治疗的食管癌患者共150例,纳入标准:(1)经病理活检确诊食管癌;(2)有明确的吞咽困难或饮食呛咳症状;(3)肿瘤分期为Ⅱ期及以上;(4)意识清醒,能够理解并签署知情同意书。本手术的排除标准如下:(1)合并严重其他疾病;(2)大量腹水;(3)胃底静脉曲张;(4)妊娠;(5)过度肥胖(BMI >40 kg/m2);(6)严重凝血功能障碍。根据年龄分为2 组:A 组(年龄<70 岁)84例,男64例,女20例,平均年龄(61.0 ± 8.0)岁;B组(年龄≥70岁)66例,男41例,女25例,平均年龄(75.0 ± 6.0)岁。本研究已经过我院伦理委员会批准。
1.2 方法
1.2.1 操作方法术前行血常规、血生化、凝血功能及心电图检查,通过上消化道造影、上腹部CT或MRI 判断腹腔脏器位置关系和食管狭窄程度。嘱患者禁食水12 h。在术前0.5~1 h 常规注射止血针及山莨菪碱。手术过程见图1。

图1 经影像学引导下经皮胃造瘘术操作步骤Fig.1 Procedure of percutaneous radiologic gastrostomy
1.2.2 术后处理术后禁食水24 h 后,复查造影确认造瘘管位置正常后,交代患者及其家属正确使用方法及注意事项,当天经造瘘管灌注流食。所有患者2 周后复查拆线。
1.3 观察指标及随访方式术后记录患者的手术并发症、PRG 相关死亡情况,所有患者术后1~2个月来院复查,行血常规检查。由医院行政随访人员通过电话或门诊等方式每1 个月随访1 次,随访截止日期为2019年2月,平均随访时间为5.77(3~26)个月,了解患者生存与否,并发症等情况,随访终点为任何原因导致的死亡,记录所有患者的术后总生存期(overall survival,OS)。
1.4 统计学方法采用SPSS 22.0 软件,定量资料以均数± 标准差或四分位数间距表示;定性资料以例数和率(%)表示。采用t检验比较两组的年龄、阻塞长度、营养与免疫指标的差异,采用χ2检验比较两组患者性别、肿瘤分期、是否伴有食管气管瘘或纵膈瘘、肿瘤分布、组织学、PRG 引导方式、放化疗史、并发症、术后30 d 内死亡、额外治疗需求的差异。采用Kaplan-Meier 法计算所有患者的生存率,log-rank 检验评价两组生存率的差异。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本资料两组患者均没有接受外科切除治疗。84例A 组患者中,Ⅱ、Ⅲ、Ⅳ期的患者分别有7、9 和68例,57例接受了化疗,66例接受了放疗。66例B 组患者中,Ⅱ、Ⅲ、Ⅳ期的患者分别有5、15 和46例,39例接受了化疗,52例接受了放疗。两组患者除年龄外,基本资料差异均无统计学意义(P>0.05)。患者基本资料比较见表1。
2.2 生存分析150例患者中,中位生存期为177 d,其中A 组中位生存期180 d,B 组中位生存期170 d。Kaplan-Meier 曲线显示,A 组和B 组生存率差异无统计学意义(P=0.283,图2)。
2.3 次要结局两组患者手术成功率均为100%。两组分别有3例患者30 d 内死亡,死亡原因有食管气管瘘或纵膈瘘引起肺部严重感染,放疗中咯血休克和肿瘤恶病质多器官功能衰竭等,无一例PRG 相关死亡。30例患者发生并发症,其中22例(14.7%)患者于胃造瘘术后一定时间内发生吸入性肺炎,3例发生造瘘口感染,5例发生消化道出血。14例患者需要额外附加治疗,其中4例造瘘管脱出,2例造瘘管堵塞,1例造瘘管断裂,后均在X 线下重置造瘘管,5例患者因持续呛咳行食管支架置入,1例患者因造瘘口感染难控去除造瘘管,1例患者因消化道出血行外科手术。术后1~2 个月,A 组有81例复查,血清白蛋白变化平均值为(-2.4±8.2)g/L,淋巴细胞变化平均值为(-0.47± 3.6)× 109/L,体质量变化平均值为(-0.41 ± 1.32)kg;B 组有63例复查,血清白蛋白变化平均值为(-2.7 ± 5.5)g/L,淋巴细胞变化平均值为(-0.45 ±2.9)× 109/L,体质量变化平均值为(-0.45 ± 2.14)kg。两组的术后30 d 内死亡率、并发症发生率、附加治疗次数,以及术后1~2 个月血清白蛋白、体质量和淋巴细胞计数的变化的差异均无统计学意义(P>0.05)。两组并发症的比较见表2。
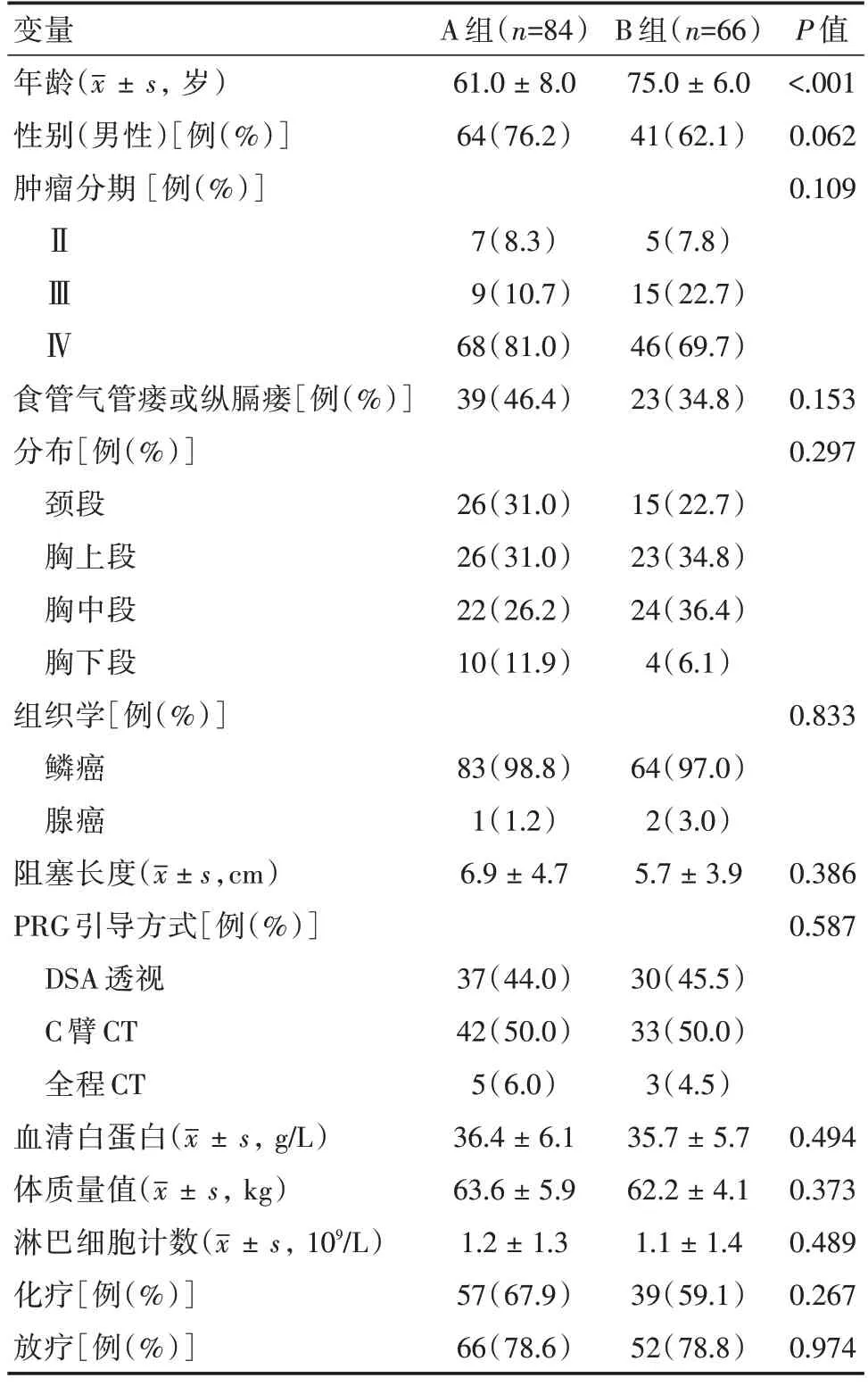
表1 基线资料比较Tab.1 General information of the patients

表2 并发症的比较Tab.2 Comparison of complications between two groups例(%)
3 讨论
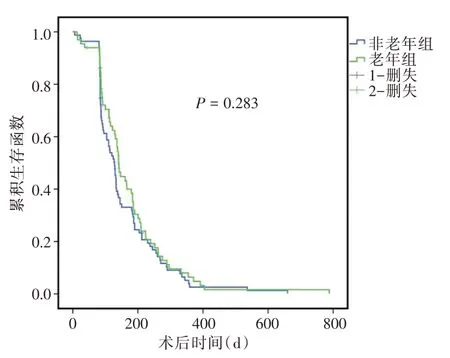
图2 两组患者的生存分析Fig.2 The Kaplan-Meier Curve shows the long-term outcome of overall survival for the two groups
食管癌是我国常见的恶性肿瘤之一,与其他肿瘤不同,患者的营养状态是影响其手术效果及术后恢复的直接因素,也会影响患者对放化疗的耐受性和总生存期,放化疗的副作用会加重患者的营养状态的恶化[2,7]。因此,食管癌患者在治疗期间良好的营养管理,对改善临床疗效和治疗耐受性具有重要意义。
美国胃肠病学会(ACG)成人住院患者营养治疗临床指南指出,与肠外营养相比,对需要特殊营养治疗的患者,如果没有肠内营养的禁忌证,应首选肠内营养[8]。其符合人体生理状态,有助于刺激胃肠道蠕动,预防肠内菌群失调,并发症较少[9]。对于食管癌患者来说,肠内营养的提供方式有食管支架置入、鼻饲营养管置入及胃造瘘术等。食管支架置入能够为患者可以短时间缓解吞咽困难,恢复经口进食,且不需要携带外管,但是其不良事件的发生率高,患者的生存质量较低,生存时间不理想[4,10-11]。鼻饲营养管置入操作简便,手术并发症发生率低,但其管口位于面部,极其影响患者的生活质量和心理状态,特别是影响癌症患者的治疗积极性,另外,其有误吸、反流、食道黏膜损伤等缺点[4]。传统胃造瘘术手术创伤大,并发症发生率较高,术后恢复时间长。
随着PRG 在临床上的开展,其以手术成功率高,创伤小,手术时间短,并发症低等优势[2],在临床上的应用越来越广泛,但其毕竟属于有创的肠内营养提供方式。既往对于PRG 应用于食管癌患者的临床研究中,尚没有针对年龄因素进行分析,年龄是否影响该手术对于食管癌人群的预后,临床上尚无定论。所以本研究对150例行PRG 治疗的食管癌患者,根据年龄因素分为A 组(年龄<70岁)和B 组(年龄≥70 岁),分析年龄因素对该人群治疗过程中生存和次要结局的影响。
老年人群体质相对较差,对PRG 这类有创手术的耐受性和术后的恢复能力都具有一定劣势。而本研究中两组患者的手术成功率、手术相关死亡率、术后30 d 内死亡率、并发症发生率、附加治疗次数的差异均无统计学意义,结果表明PRG 应用于老年食管癌人群的安全性理想,且能够达到非老年人群的水平。理论上,老年食管癌患者身体合成代谢功能较差,加上肿瘤负荷对营养需求的增加,营养不良的风险和对各种治疗的耐受性不如非老年食管癌人群[12]。而本研究中纳入的两组患者的生存率差异、术后1~2 个月血清白蛋白和体质量变化值的差异均无统计学意义(P>0.05)。结果显示,PRG 对于老年食管癌患者的营养状态的稳定和远期疗效尚佳,不亚于非老年人群的水平。总之,本研究的数据显示PRG 在老年食管癌患者的应用中的近远期疗效和安全性均比较理想。
影像引导下经皮胃造瘘术的引导方式有数字减影血管造影(digitalsubtraction angiography,DSA)透视、C 臂CT、全程CT 及超声[13-14]。本研究纳入的患者中,有67例通过DSA 透视下引导,75 通过C臂CT 引导,8例通过全程CT 引导。全程CT 引导的8例患者,有5例为DSA 引导或C 臂CT 引导操作失败的患者,其余3例为术前经胃镜或上消化道造影判断食管严重狭窄的患者。DSA 透视下引导操作时间短,患者及医生所受辐射少,设备要求低,可动态监测穿刺方向与腹腔脏器,但不能准确判断腹腔各脏器的位置关系,无法准确设计穿刺角度和深度,操作过程中容易误伤肝脏、横结肠等器官。所以,术前应通过上腹部CT 扫描准确了解腹腔各脏器的位置关系。C 臂CT 引导除了具有DSA 透视引导的优势外,还能准确定位穿刺点,精确测量和设计进针角度和深度,可通过轴位图像判断腹腔各脏器的位置关系,避免误伤周围结构。另外,若食管梗阻程度较重,不能经鼻口插管时,在C 臂CT 引导下细针穿刺胃腔后或可成功。但C 臂CT 轴位图像不够清晰,在胃腔无充盈的情况下,穿刺胃腔非常困难。全程CT 引导CT 扫描速度快,图像分辨率高,能够更准确地定位穿刺点和判断腹腔脏器的位置关系,手术成功率高[15]。一般情况下,经胃镜、DSA 透视、C 臂CT 和超声引导失败的病例,在CT 引导下均能获得成功,特别适合食管完全梗阻的患者。但全程CT 引导需行多次CT 扫描,辐射剂量大,操作时间久,且操作过程无法动态监测。
本研究中有6例患者术后30 d 内死亡,A 组患者有2例死于肺部严重感染,1例放疗中咯血休克死亡,B 组患者有1例死亡原因为肿瘤恶病质多器官功能衰竭,2例患者死于肺部严重感染。4例肺部严重感染的患者术前皆合并食管气管瘘或食管纵膈瘘,术后肺部严重感染未能有效控制。术后发生造瘘口感染的患者中,A 组有1例,B 组有2例,后均经过增加换药次数,加用抗生素治疗后好转。术后消化道出血的患者,A 组有2例,B 组有3例,后均经止血治疗后停止出血。造瘘管移位的患者,A 组有5例,B 组有6例,后均在DSA 透视下重置。术后吸入性肺炎共22例发生,A 组16例,B组6例,18例经积极抗生素治疗后控制,4例未能控制而死亡。两组患者共有14例需要额外治疗。A 组有7例,5例因造瘘管移位重置造瘘管,1例因造瘘口感染暂行鼻饲营养管提供肠内营养,1例因食管气管瘘行食管支架治疗。B 组患者有7例,6例因造瘘管移位重置造瘘管,1例因食管气管瘘行食管支架治疗。
综上所述,经影像学引导下经皮胃造瘘术治疗老年与非老年食管癌人群的临床预后相仿,手术并发症发生率均较低,能够为老年与非老年食管癌人群提供肠内营养,减缓其营养状态的下降,为后续治疗保证营养状态,延长生存时间。但本研究为单中心的回顾性研究,存在包括偏倚等不足之处,在进一步的研究中,笔者将采取多中心的随机对照研究,更科学地探讨PRG 在食管癌患者中的应用价值。

