Delta阿片受体激活通过调节JAK2/STAT3通路减轻肝硬化大鼠缺血再灌注损伤
刘珏莹 潘钱玲 殷文渊 王苑 俞卫锋
上海交通大学医学院附属仁济医院麻醉科(上海200127)
肝脏缺血再灌注(ischemia reperfusion,IR)损伤是肝脏外科手术常见的并发症。临床上为了减少手术失血量,常阻断肝脏血流,当血流恢复即再灌注后,肝脏细胞出现功能障碍和结构损伤的现象即IR 损伤[1]。在合并肝硬化的患者肝脏手术时,肝脏IR 损伤可引起术后大量肝脏细胞的坏死和凋亡、残肝细胞再生功能的推迟和抑制,严重者会导致肝功能的衰竭[2]。我国肝硬化患者众多,行肝脏手术的患者多数合并肝硬化。因此,研究硬化肝脏围术期器官功能保护,减轻肝硬化IR 损伤,具有十分重要的临床意义。
很多药物预处理[3-4]被应用于治疗IR 损伤,并且取得相应的疗效。阿片受体激动剂是肝脏手术麻醉中常用的镇痛药物,如芬太尼、舒芬太尼和吗啡等。阿片受体主要有3 种亚型:Mu(μ)、Kappa(κ)和Delta(δ)。笔者前期实验[6]证明阿片受体激动剂吗啡可以有效地保护硬化肝脏,减轻IR 损伤[5]。然而这种保护作用是通过激活哪种阿片受体亚型还未知。肝脏细胞主要表达Delta 阿片受体,因此笔者推断直接激活Delta 阿片受体可以有效地减轻硬化肝脏IR 损伤。为了深入研究Delta受体激活的作用机制,本研究选择了对Janus 激酶2(Janus kinase 2,JAK2)和信号转导及转录激活因子-3(signal transducer and activators of transcription 3,STAT3)通路进行探索。前期的研究[5]表明,阿片受体激活可以上调正常大鼠肝脏JAK2、STAT3蛋白磷酸化的表达。并且JAK2/STAT3 对抑制IR损伤引起的细胞凋亡,促进细胞再生具有重要的调节作用[7]。然而,JAK2/STAT 通路是否介导了Delta 阿片受体对硬化肝脏IR 损伤的作用机制,需要深入探究。
本研究拟在大鼠肝硬化模型基础上建立肝脏IR 损伤,分别应用Delta 阿片受体特异性激动剂和拮抗剂,研究Delta 阿片受体在肝脏保护中的作用以及相关信号通路,为临床硬化肝脏围术期保护提供可靠的研究依据。
1 材料与方法
1.1 实验动物和试剂32 只无特定病原体(SPF)级8~10 周雄性Sprague-Dawley(SD)大鼠(购于上海交通大学医学院动物中心),体质量为250 ~300 g,自由饮水和活动。本研究通过上海交通大学医学院附属仁济医院实验动物饲养管理中心,批号:RJ-2017-07-10。Delta 阿片受体激动剂[DAla2,D-Leu5]enkephalin(DADLE)、Delta 阿片受体拮抗剂Natrindole 以及β-actin、JAK2 和STAT3 抗体购于英国Abcam 公司。丙氨酸氨基转移酶(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、白介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒均购于美国R&D Systems 公司。抗兔二抗购于Cell Signaling Technology 公司。
1.2 方法
1.2.1 大鼠肝硬化模型制备根据前期试验[5]描述制造模型。99%四氯化碳橄榄油溶液(1∶1 稀释)2 mL/100 g 体质量皮下注射,每周2 次,持续7周。模型动物均经组织学验证肝硬化的形成。
1.2.2 大鼠肝脏IR 损伤模型制备根据前期试验[5]描述制造模型。肝硬化的大鼠在戊巴比妥(50 mg/kg,腹腔注射)麻醉下,取正中切口,暴露肝脏。夹闭支配右侧肝叶(右叶、尾叶和三角叶)的肝动脉、门静脉60 min,随后松开夹子,随后用3号缝线关腹。再灌注6 h 后,取大鼠右侧肝叶和血清标本。血清置于-80 ℃冰箱保存,肝脏标本用液氮迅速冷冻后,亦置于-80 ℃冰箱保存。
1.2.3 实验分组肝硬化大鼠随机分为4 组,每组8 只。(1)假手术组(SHAM 组):仅进行开腹手术,分离出肝门血管后,不进行血管阻断,观察后关腹,尽量使得开关腹时间和其他组保持一致。(2)对照组(CON 组):大鼠开腹后,分离肝门血管,用微量注射器下腔静脉注射生理盐水500 μL,10 min 后进行IR 损伤。(3)Delta 阿片受体激动剂组(DADLE 组):开腹分离肝门血管后,从下腔静脉注射Delta 阿片受体激动剂DADLE 5 mg/kg(生理盐水稀释至500 μL),10 min 后进行IR 损伤。(4)Delta 阿片受体拮抗剂组(NTD 组):开腹分离肝门血管后,下腔静脉注射DELTA 阿片受体拮抗剂Natrindole 5 mg/kg(生理盐水稀释至500 μL),10 min 后进行IR 损伤。
1.2.4 肝细胞损伤情况血清ALT 和AST 含量根据ELISA 试剂盒的操作步骤进行检测。
1.2.5 肝脏组织形态学改变三角叶肝脏组织使用多聚甲醛固定,脱水石蜡包埋后切片为5 μm 薄片,苏木精&尹红(H&E)染色。在400 ×光学显微镜下观察,并拍照。结果用SUZUKI 分级[8]:根据组织淤血、细胞气球样变以及坏死面积分为5 个等级(0~4 级),没有组织淤血、气球样变和坏死记为0 级;严重组织淤血、严重气球样变以及坏死面积超过60%为4 级。
1.2.6 血清TNF-α 和IL-1β 含量测定根据ELISA 试剂盒说明书的步骤进行检测。
1.2.7 SYBER Green 荧光定量RT-PCR冻存标本在Trizol 试剂中超声乳化,形成组织匀浆,提取总RNA。逆转录为cDNA 后,建立10 μL 的反应体系:SYBER Green 2 μL,上游引物0.2 μL,下游引物0.2 μL,双蒸馏水(ddH2O)2.6 μL,cDNA 2 μL。PCR 反应条件为:预变性,95 ℃× 30 s;PCR 循环(40 个循环)95 ℃× 10 s,60 ℃× 60 s;溶解曲线,95 ℃× 15 s,60 ℃× 60 s,95 ℃× 15 s。引物由生工生物工程(上海)有限公司提供。JAK2 的上游引物为:5′-GGTATTACGCCTGTGTATCAT-3′,下游引 物 为:5′-GGTTGACTCATCTATGTGGAA-3′。STAT3 的上游引物为:5′-CTAGTCGTCCAATCAACATCA-3′,下游引物为5′-GGTACACAGACAAGGAGTAAT-3′。β-actin 上 游 引 物 为:5′-GGCTGTATTCCCCTCCATCG-3′,下游引物为:CCAGTTGGTGGTAACAATGCCATGT-3′。目的基因的mRNA表达水平以标本内β-actin 为基准,计算2-△△CT,比较各组差异。
1.2.8 蛋白印迹法(Western Blot)将适量肝脏组织研磨,超声乳化,形成组织匀浆,加入蛋白提取液提取。随后取上清液进行蛋白定量,绘制标准曲线,计算蛋白浓度。蛋白变性后,配胶电泳,转膜后孵育一抗和二抗,曝光显影,获得条带,用Image Lab 分析软件分析条带,计算灰度值。以βactin 为内参,进行分析。
1.3 统计学方法使用Graphpad Prism 6.0 统计作图软件进行图片绘制和数据统计。多组数据结果使用单因素方差分析,CON 组数据和DADLE 组数据比较使用t检验。数据结果用均数± 标准差表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 Delta 阿片受体激活降低血清ALT 和AST 水平再灌注6 h 后,与CON 组相比,DADLE 明显降低血清ALT[138 ± 33.369)U/Lvs.(267 ± 106.173)U/L,t=3.728,P=0.005 5]和AST[(210±102.666)U/Lvs.(374 ± 64.021)U/L,t=3.384,P=0.001 8]。然而NTD 组ALT 和AST 含量与CON 组相比,差异无统计学意义(图1)。

图1 各组再灌注6 h 后血清ALT 和AST 水平(n=8)Fig.1 Serum ALT and AST levels at 6 h after reperfusion(n=8)
2.2 Delta 阿片受体激活对肝脏组织形态学变化的影响和SUZUKI 评分再灌注6 h 后,H&E 染色结果表示,DADLE 组相比于CON 组,肝小叶相对完整,坏死面积小,组织淤血轻。而CON 组肝小叶结构不完整,肝窦边界不清,内可见大量红细胞淤积,细胞疏松,有气泡样变性以及有大量坏死面积(图2)。DADLE 组的SUZUKI 评分和CON 组相比,差异有统计学意义(P=0.002 1)。然而NTD 组的肝脏形态学改变以及SUZUKI 分级与CON 组相比差异无统计学意义(表1)。
2.3 Delta 阿片受体激活降低血清TNF-α 和IL-1β 的含量与CON 组相比,DADLE 明显降低了TNF-α[(15.561 ± 5.12)pg/mLvs.(32.289 ± 9.23)pg/mL,t=4.483,P=0.000 5]和IL-1β的含量[(46.444 ± 7.777)pg/mLvs.(68.841 ± 9.225)pg/mL,t=5.250,P=0.000 1]。NTD 组合CON 组相比,血清TNF-α 和IL-1β 的含量差异无统计学意义(图3)。
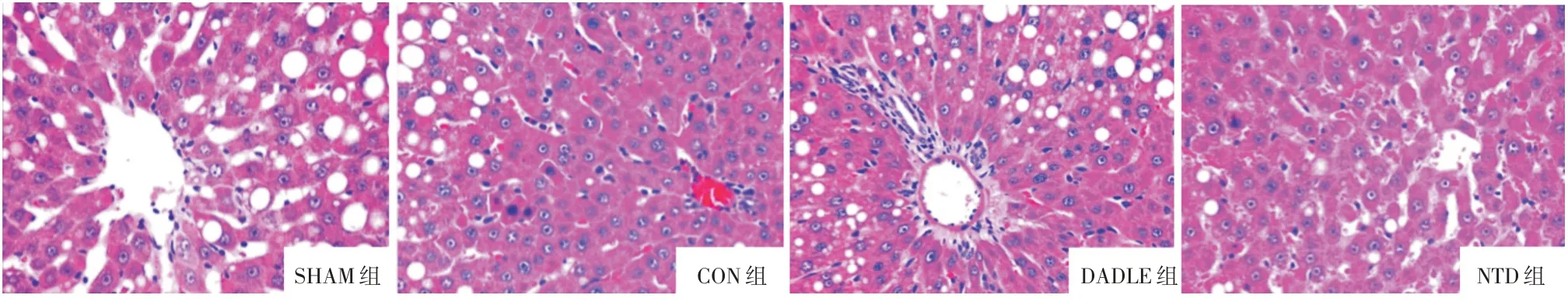
图2 各组H&E 染色结果(×400)Fig.2 Histological changes by H&E staining(×400)
表1 各组SUZUKI 评分(n=8)Tab.1 Comparison of SUZUKI′s scores(n=8)±s
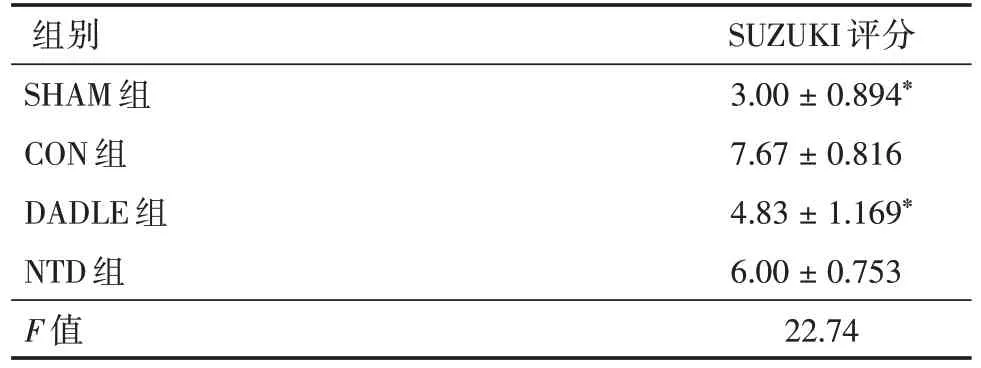
表1 各组SUZUKI 评分(n=8)Tab.1 Comparison of SUZUKI′s scores(n=8)±s
注:与CON 组相比,*P <0.05
组别SHAM 组CON 组DADLE 组NTD 组F 值SUZUKI 评分3.00±0.894*7.67±0.816 4.83±1.169*6.00±0.753 22.74
2.4Delta 阿片受体激活上调 JAK2 和STAT3mRNA 的表达DALDE 组JAK2 和STAT3 mRNA 的表达明显高于CON 组,分别为[(2.686 ±0.410)vs.(1.356 ± 0.695),t=4.662,P=0.000 4]和[(2.729 ± 1.495)vs.(0.770 ± 0.265),t=3.649,P=0.002 6]。然而NTD 组的mRNA 含量与CON组相比差异无统计学意义(图4)。

图3 各组血清TNF-α 和IL-1β 的含量(n=8)Fig.3 Serum TNF-α and IL-β levels(n=8)
2.5 Delta 阿片受体激活增加JAK2 和STAT3 蛋白磷酸化的表达与CON组相比,DALDE组磷酸化JAK2[(217.54±7.99)vs.100,t=41.62,P<0.000 1]和STAT3(Ser727 位点)[(192.54 ± 47.19)vs.100,t=5.546,P<0.000 1]蛋白含量明显增高,而NTD组差异无统计学意义(图5)。
3 讨论
肝脏IR 损伤是肝移植、肝肿瘤切除术以及肝脏外伤等手术中常见的并发症,一直困扰着临床医生。然而其发生机制十分复杂,目前缺乏有效的治疗手段。
缺血预处理(ischemia preconditioning,IPC)是之前被广泛应用的针对IR 损伤的脏器保护策略。1986年MURRY 等[9]首次在心脏IR 损伤上提出了“缺血预处理”的概念,即在长时间缺血前进行数次短暂缺血、再灌注的循环可以减轻IR 损伤引起的损伤。1993年LLORIS 等[10]发现该预处理同样对大鼠肝脏的IR 损伤也具有保护作用。尽管如此,IPC 的方案、保护时限和保护机制尚未完全阐明,并且因为伦理限制了其临床运用。近年来,用药物尤其是麻醉药物模拟IPC 以调动内源性保护机制已成为肝脏麻醉领域的研究热点。阿片受体激动剂是肝脏手术中常用的镇痛药,分为3个亚型。研究表明Delta 阿片受体激活其对心[11]、脑[12]和肝[13]IR 损伤具有保护作用。然而Delta 阿片受体的激活对硬化肝脏的作用如何,还未有研究。本研究结果首次显示Delta 阿片受体激动剂DADLE 降低大鼠硬化肝脏血清ALT 和AST 水平。并且从H&E 染色可以看出,与CON 组相比,DADLE 组肝小叶相对完整,少量血液淤积和坏死面积。然而使用Delta 阿片受体拮抗剂的肝组织IR后,肝小叶破坏严重,肝索肝窦边界不清,大量坏死面积。这些说明Delta 阿片受体激活可以减轻硬化大鼠肝脏IR 损伤,当Delta 阿片受体被拮抗后,这种保护作用被逆转。这表明Delta 阿片受体对硬化肝脏IR 损伤的关键作用。
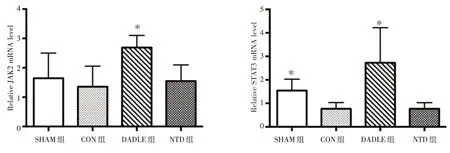
图4 各组JAK2 和STAT3 mRNA 表达水平(n=8)Fig.4 The expression of JAK2 and STAT3 mRNA(n=8)

图5 各组JAK2 和STAT3 蛋白表达(n=8)Fig.5 The expression of JAK2 and STAT3 protein(n=8)
肝脏IR 损伤的机制很复杂,目前有早发相和迟发相的假说。早发相与肝脏Kuppfer 细胞诱导的促前炎性因子如TNF-α 和IL-1 产生和释放有关[14]。迟发相与中性粒细胞趋化有关[15]。由于再灌注6 h 是肝脏IR 早期损伤最严重的时候[16],因此本研究选取再灌注6 h 的肝脏组织和血清进行研究,并且主要研究肝脏IR 损伤早期相的相关机制。本研究发现DADLE 组大鼠血清TNF-α 和IL-1β 的含量比CON 组低,而NTD 组TNF-α 和IL-1β的含量与CON 组相比差异无统计学意义。这表明Delta 阿片受体激活可以减轻前炎性因子TNF-α 和IL-1β 的释放,从而达到抗炎的作用。
JAK2/STAT3 是生存活化因子增强(survivor activation factor enhancement,SAFE)的 关 键 通路[17]。STAT3 有两个磷酸化的位点:络氨酸(T705)和色氨酸(Ser727)位点。一旦STAT3 被JAK2 磷酸化,STAT3 蛋白即可通过其SH2 区形成二聚体而活化和隐藏T705 位点,随后Ser727 位点磷酸化后的STAT3 转移到细胞核内与靶基因的启动子结合,诱导靶基因的转录[18]。有研究[19]表明JAK2/STAT3 通路的激活可以减轻肝脏IR 损伤。STAT3 蛋白激活可以控制下游基因如BCL2 和BAX 转录,进而起到抗炎的作用[20]。还有研究[21]表明Delta 阿片受体可以激活JAK2/STAT3 通路来减轻心脏IR 损伤,而这种保护作用被STAT3 抑制剂AG490 所逆转,JAK2/STAT3 通路是Delta 阿片受体介导的心脏保护作用的关键蛋白通路。本研究发现JAK2 和STAT3 的mRNA 表达以及磷酸化蛋白的含量在DADLE 组明显增高。这表明Delta 阿片受体激活上调JAK2/STAT3 通路,进而减少前炎性因子TNF-α 和IL-1β 的释放达到抗炎的效果。这与上述文献研究的结果相符合。然而JAK2/STAT3 通路是否是DADLE 肝脏保护的关键通路需要进一步研究。
由于样本量小,使得本研究具有局限性。并且确定JAK2/STAT3 的关键作用,还需要使用特异性的抑制剂或其他基因技术,这将在以后的基础实验中,进一步深入研究。
综上所述,本研究首次表明Delta 阿片受体激活能够有效地减轻硬化肝脏IR 损伤,其机制可能与上调JAK2/STAT3 通路进而抑制的炎性介质释放有关。为临床阿片受体的肝脏IR 损伤保护,提供基础依据。

