盐酸小檗碱对脓毒症诱导急性呼吸窘迫综合征小鼠的保护作用及机制研究
武晓灵 喻莉 龙鼎 杨军辉
华中科技大学附属武汉中心医院重症医学科(武汉430014)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症医学科常见的临床综合征,可由肺内及肺外多种原因导致,其中脓毒症是ARDS 最主要的原因,脓毒症所致的ARDS 患者病情更加严重,病死率也更高[1-4]。研究表明炎症反应在ARDS 的发生发展过程中起到重要作用。因此,如何抑制ARDS 的炎症反应,从而减轻ARDS 的肺损伤成为研究的热点。盐酸小檗碱(berberine,BBR),又称黄连素,是从黄连、黄柏、三颗针等植物中提取的生物碱,在临床上常作为广谱抗生素使用,最开始主要用于胃肠道疾病的抗菌治疗[5-7]。进一步研究发现BBR 在治疗糖尿病、心血管疾病、调节血脂、抗肿瘤、免疫调节、精神疾病等方面具有广泛的药理作用[8-11]。本研究探讨BBR 对脂多糖(lipopolysaccharide,LPS)诱导的ARDS 小鼠肺损伤的保护作用及机制,以期为ARDS的治疗提供新的思路。
1 材料与方法
1.1 实验动物及模型制备54 只雄性野生型C57BL/6 小鼠,体质量20~25 g,由武汉大学医学院实验动物中心提供,随机分为对照组(n=18)、LPS 组(n=18)和LPS+BBR(n=18)。对照组气道内滴入50 μL PBS 溶液;LPS 组气道内滴入LPS(2 mg/kg)溶液50 μL;LPS+BBR 组小鼠,先用50 mg/kg 的BBR 灌胃预处理,2 h 后气道内滴入LPS 溶液50 μL。LPS 滴入8 h 后处死所有小鼠,并进行以下指标检测。
1.2 试剂和仪器内毒素(美国Sigma 公司);盐酸小檗碱(BBR,Sigma,PHR1502);小鼠的TNF-α、IL-6、IL-10 的酶联免疫吸附试验(ELISA)试剂盒(美国R&D 公司);BCA 蛋白定量试剂盒(Thermo,23227)。
1.3 指标检测
1.3.1 病理学检测处死小鼠,分离左肺,将其固定于10%中性福尔马林固定液中,制作肺组织石蜡切片并进行伊红-苏木素染色(HE 染色)。
1.3.2 肺组织湿/干重比值处死小鼠后分离双肺,漂洗,无菌滤纸擦干后立即天平上称重,记为肺脏的湿重;然后把双肺组织放在烘箱内烘烤一周后再次称量,记为肺脏的干重,计算肺脏的湿/干重比值。
1.3.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎症因子处死小鼠,游离气管,用缝合线将22G 注射针头和气管结扎固定。0.9%氯化钠溶液0.8 mL 缓慢推入气管内,反复抽吸3 次后回抽液体,静置后1 000 r/min 离心10 min,收集上清,分装后-80 ℃保存。按试剂盒说明书分别测定炎症因子TNF-α、IL-6 和抗炎因子IL-10 水平。
1.3.4 小鼠血浆中炎症因子成功麻醉小鼠后,在心脏搏动最强处穿刺缓慢抽取约0.8~1 mL 血液,静置后3 000 r/min 离心5 min,收集上层血浆,分装,置于-80 ℃冰箱。按试剂盒说明书分别测定炎症因子TNF-α、IL-6 和抗炎因子IL-10 水平。
肺组织中炎症因子等基因mRNA 含量:提取肺组织的总RNA,用紫外检测仪在波长分别为260 nm 和280 nm 时读取每组RNA 的光吸收值,从而计算各炎症因子RNA 的浓度和纯度。
1.3.5 肺组织中相关蛋白的表达水平提取肺组织的总蛋白,按说明书进行蛋白定量(BCA Protein Assay Kit 定量),蛋白变性,上样电泳,转膜,5%脱脂奶粉封闭,一抗孵育过夜,二抗孵育,成像仪上显影成像,运用Qμantity One 软件分析计算蛋白条带的灰度值。
1.4 统计学方法采用SPSS 19.0 软件进行数据分析,计量资料用均数±标准差表示,两组间数据比较用独立样本t检验,多组间数据比较用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 肺部病理学改变HE 染色可看出对照组小鼠肺组织结构完整(图1A),无炎症渗出。而LPS组小鼠肺组织有断裂或破损,伴有微血管内微血栓形成及充血和出血,肺泡腔及肺间质内大量炎性细胞浸润,肺泡间隔明显增厚(图1B)。而LPS+BBR 组小鼠肺组织损伤较LPS 组明显减轻,微血管内仅少量充血和出血,肺泡腔和肺间质仅少量炎性渗出,肺泡间隔也明显变薄(图1C)。进一步分析后发现,小鼠的肺组织损伤评分:LPS 组大于LPS+BBR 组及对照组(P<0.05,图2)。小鼠肺组织湿/干重比值:LPS 组大于LPS+BBR 组及对照组(P<0.05,图3)。
2.2 炎症因子水平的比较炎症因子TNF-α、IL-6水平在支气管-肺泡灌洗液中:LPS 组明显大于LPS+BBR 组及对照组(P<0.05,图4);血浆中:LPS 组明显大于LPS+BBR 组及对照组(P<0.05,图5);而抗炎因子IL-10 水平在支气管-肺泡灌洗液中:LPS 组小于LPS+BBR 组及对照组(P<0.05,图4);血浆中:LPS 组小于LPS+BBR 组及对照组(P<0.05,图5)。实时荧光定量PCR 检测结果显示,LPS 组炎症因子TNF-α、IL-6 的mRNA 含量明显高于LPS+BBR 组及对照组;而抗炎因子IL-10 的mRNA 含量明显低于LPS+BBR 组及对照组(P<0.05,图6)。

图1 3 组小鼠肺组织病理学比较(200×)Fig.1 HE staining results of lung tissue of three groups of mice(200×)
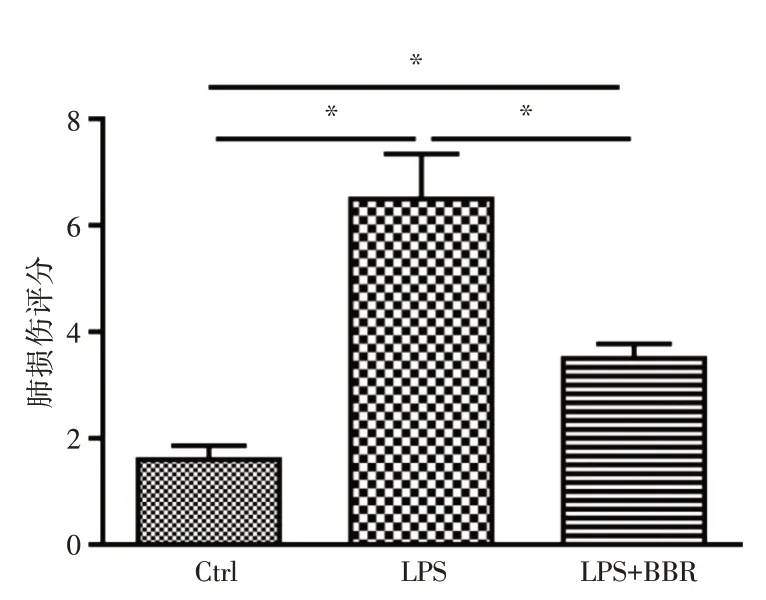
图2 3 组小鼠肺组织损伤评分比较Fig.2 Comparison of lung tissue injury scores in three groups of mice
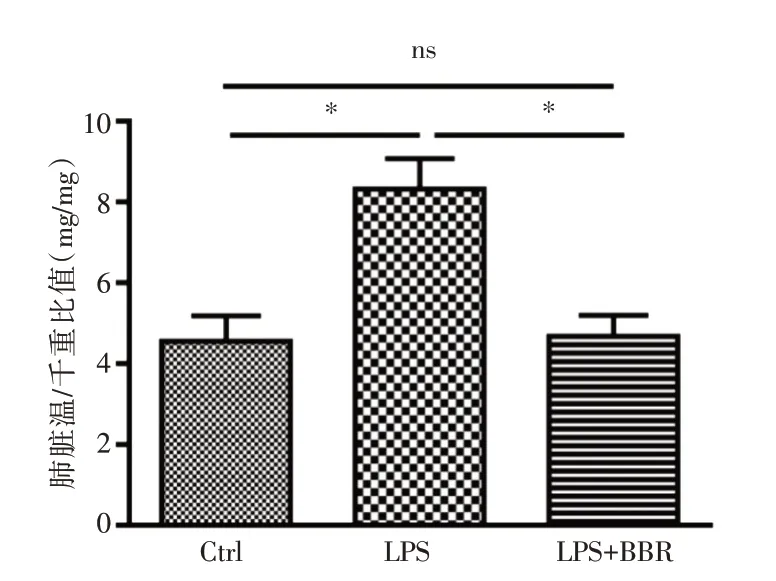
图3 3 组小鼠肺脏湿/干重比值比较Fig.3 Comparison of lung wet/dry weight ratios of the three groups of mice
2.3 对NF-κB 信号通路的异常激活影响LPS 组小鼠肺脏组织中p65 水平较对照组显著升高(P<0.05,图7),而LPS+BBR 组小鼠肺脏组织中p65 水平较LPS 组则显著降低(P<0.05,图7)。
3 讨论

图4 3 组小鼠支气管肺泡灌洗液中各炎症因子水平比较Fig.4 Comparison of the levels of inflammatory factors in bronchoalveolar lavage fluid of three groups of mice.ns There was no statistically significant difference
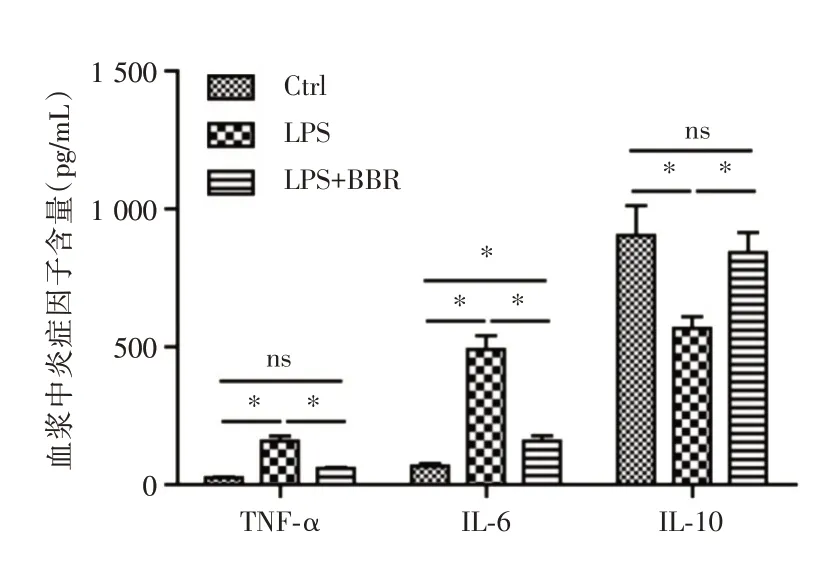
图5 3 组小鼠血浆中各炎症因子水平比较Fig.5 Comparison of the levels of inflammatory factors in plasma of three groups of mice
ARDS 的病理特征是肺毛细血管通透性增高,其基础是多种炎症细胞的浸润,导致肺局部炎症反应失控,肺泡内释放大量细胞因子,最终导致全身炎症反应。临床表现为顽固性的低氧血症,严重甚至导致多器官功能障碍[12-16]。目前普遍认为失控的炎症反应与ARDS 的病理生理密切相关,炎症因子IL-1、IL-6、TNF-α 等的释放激活中性粒细胞分泌超氧化物等活化因子,进一步加重肺泡及血管内皮细胞的损伤[17-19]。本研究成功运用LPS建立ARDS 小鼠模型,LPS 处理的小鼠有明显的肺水肿和炎症浸润,肺组织损伤评分和肺湿/干重比值均明显升高,支气管肺泡灌洗液及血浆中炎症因子水平均较对照组明显升高。
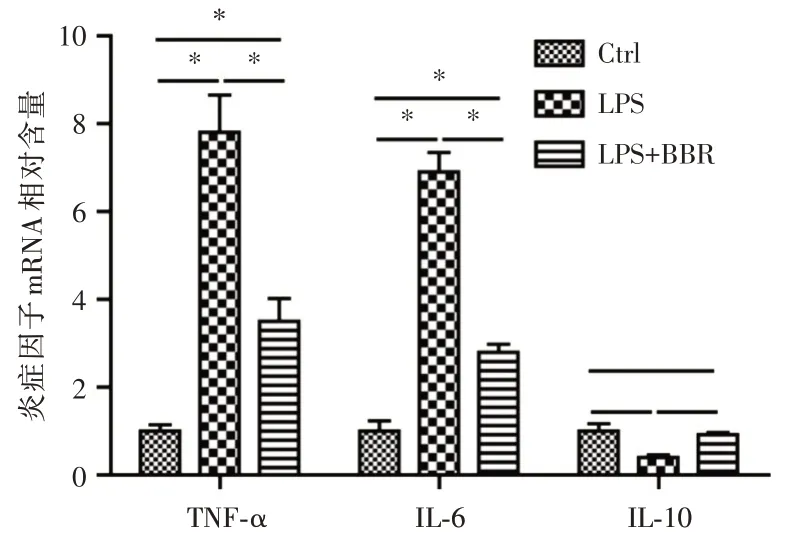
图6 3 组小鼠肺组织中各炎症因子的mRNA 相对含量Fig.6 The relative content of mRNA of inflammatory factors in lung tissue of three groups of mice
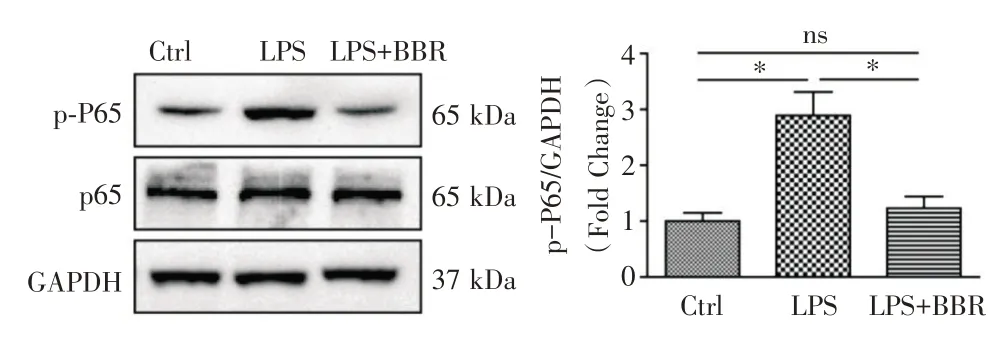
图7 3 组小鼠的肺组织中p-P65、p65 的蛋白表达水平Fig.7 The protein expression levels of p-P65 and p65 in the lung tissues of the three groups of mice
小檗碱是黄连的主要生物碱成分,其影响各种生物功能,如细胞增殖,迁移和存活,具有抗菌活性、抗炎作用、抗肿瘤和免疫调节作用[20-21]。研究发现,BBR 可抑制急性肝衰竭中NF-κB p65 的核转位,从而抑制炎症细胞因子,肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)在mRNA 和蛋白水平的表达。还可以通过在体外和体内减少细胞色素c 释放,Bax/ Bcl-2 比率和胱天蛋白酶-3/-9 切割有效地抑制急性肝衰竭的细胞凋亡[22]。BBR 可以抑制海马中IBA1,IL-1β 和IL-6 的释放,从而减轻老年人术后认知功能障碍(POCD)[23]。还可以通过肿瘤坏死因子(TNF)受体相关因子5(TRAF5)介导的小鼠足细胞中NF-κB 信号传导途径的激活对CRF 发挥保护作用[24]。MO 等[25]及KIM 等[26]研究发现BBR 可能通过激活AMP 活化蛋白激酶(AMPK)、上调SIRT1 减轻机械通气造成的肺水肿、抑制炎性细胞浸润、降低炎症介质的表达和释放。本研究结果也显示,BBR 预处理后脓毒症ARDS 小鼠肺组织炎症浸润明显减轻,炎症因子TNF-α、IL-6 的水平明显降低,抗炎因子IL-10 的表达水平明显升高,从而证实BBR 对脓毒症ARDS的肺组织具有保护作用。既往研究表明NF-κB 与ARDS 炎症反应调控失衡有关,抑制NF-κB 的活性可以减轻ARDS 的肺损伤程度。本研究结果显示BBR 可以抑制NF-κBp-P65 的水平,因此笔者推测BBR 可能通过抑制ARDS 的NF-κB p-P65 发挥肺保护作用。
综上,BBR 的预防性干预可以减轻脓毒症ARDS 小鼠肺组织炎症反应,抑制炎症因子TNF-α、IL-6 的水平,从而改善肺组织炎症损伤,其可能是通过抑制NF-κBp-P65 发挥抗炎作用。

