低温胁迫和赤霉素对花生种子萌发和幼苗生理响应的影响
常博文 钟 鹏 刘 杰 唐中华 高亚冰 于洪久 郭 炜
低温胁迫和赤霉素对花生种子萌发和幼苗生理响应的影响
常博文1,2,**钟 鹏2,**刘 杰2,*唐中华3高亚冰2于洪久2郭 炜2
1黑龙江省农业科学院博士后科研工作站, 黑龙江哈尔滨 150001;2黑龙江省农业科学院农村能源研究所, 黑龙江哈尔滨 150001;3东北林业大学森林植物生态学教育部重点实验室, 黑龙江哈尔滨 150001
低温是影响我国广大花生产区春花生发芽的主要因素之一。本文以不同生态区的30个花生品种为实验材料, 研究了倒春寒天气诱导的低温胁迫对花生出苗的影响, 以出苗率为标准筛选出4个耐低温的花生品种(阜花17、阜花12、冀花16、冀花18)和4个不耐低温的品种(鲁花11、白沙1016、正农黑花生1号、白玉)于温室测定了4℃低温和赤霉素(GA3)处理后种子发芽相关指标和幼苗生理指标。结果表明, 4℃对耐低温花生品种发芽率、发芽指数影响不显著, 但种子活力指数和芽长呈现下降趋势; 4℃处理后, 不耐低温品种幼苗相对膜透性和MDA含量上升幅度更高, 耐低温品种幼苗的可溶性糖和游离脯氨酸含量上升幅度更大。GA3显著促进4℃低温处理后花生种子萌发和种子活力, 抑制了花生幼苗在低温处理后相对膜透性和丙二醛的上升, 提高了可溶性糖、可溶性蛋白、游离脯氨酸含量。研究表明, 赤霉素促进低温胁迫下种子萌发和幼苗生长的最佳浓度是300 μmol L–1。发芽率与相对膜透性和丙二醛含量显著负相关, 与可溶性糖、脯氨酸含量显著正相关。温度影响发芽率的品种间差异较大, 常温下赤霉素对不同耐低温品种的发芽率影响较小。本研究为耐低温花生种质资源创新和新品种培育提供了理论依据, 为研究赤霉素对不同花生品种耐低温性影响的生理机制提供了基础。
花生; 倒春寒; 低温胁迫; 赤霉素; 种子萌发; 幼苗生理响应
近年来, 黑龙江省倒春寒天气成为春季主要气象灾害之一。倒春寒天气产生的低温胁迫对作物种子出芽和幼苗生长有严重影响, 轻则致使出苗缓慢, 推迟作物的物候期, 重则导致种子“粉籽”、“烂种”或幼苗直接被冻死, 但至今对倒春寒天气引起的低温危害作物出苗和生长还未有系统研究[1]。花生(L.)是我国主要的经济作物和油料作物, 也是我国食用蛋白和食用植物油源。黑龙江花生种植面积已达到13.3万公顷, 种植比例不断上升, 但倒春寒天气影响了黑龙江省春播花生出苗[2-3]。花生播种后常遭受低温威胁, 限制了春花生出芽、生长、发育, 甚至产量也受到影响。花生种子萌发最低温度为12℃[4], 封海胜[5]在2℃和6℃下筛选耐低温花生种质; 唐月异等[6]在种子吸胀期采用2℃冷浸的方法筛选耐低温花生种质; Chen等[7]在转录水平上筛选花生响应低温的基因, 但将倒春寒天气与花生种子萌发相结合的研究还未见报道。
赤霉素(gibberellic acid, GA)是一种植物激素, 作用于植物幼嫩组织, 适当浓度下能够促进种子萌发[8]。研究表明, 适量赤霉素可以有效地促进种子萌发。吕桂兰等[9]研究表明, 在10℃和15℃低温条件下GA3对大豆种子萌发有显著的促进作用。GA3可以部分或完全代替低温解除种子的休眠, 提高其发芽率[10]。许多研究表明, GA3参与植物生长发育的全过程, 如种子萌发、茎的伸长、花的诱导和发育、种子和果实的生长[11-13]。在种子萌发过程中, GA3促进淀粉酶和其他水解酶的合成, 并对受损的细胞膜起一定的修复作用[14]。此外, GA3在幼苗抗逆性形成方面也具有重要作用, 这可能和GA3诱导与抗逆性形成相关的基因表达和蛋白质的合成有关[15-16]。本研究将田间试验和温室试验相结合筛选耐低温花生种质, 以及探讨外源赤霉素处理对低温下花生种子萌发和幼苗生理响应的影响。
1 材料与方法
1.1 材料及处理
大田试验在黑龙江省农业科学院国家现代农业示范区(45°50′45.58″N, 126°51′3.81″E)进行。实验材料为2016年引进全国不同生态区的30个花生品种种子。2017年5月3日播种, 每穴1粒, 随机区组设计, 3次重复, 小区5 m×10 m, 行株距50 cm×25 cm。目前黑龙江省还没有统一的倒春寒规定和等级标准, 因此参照文献[17]倒春寒等级气象指标, 制定黑龙江省倒春寒等级指标(表1)。

表1 黑龙江省倒春寒等级指标
ΔT表示最大降温幅度, 指倒春寒从发生到结束这段时间内日平均气温或最低气温24 h最大下降幅度(ΔT24)或48 h最大下降幅度(ΔT48)。δT表示气温距平, 指倒春寒从发生到结束这段时间平均气温的距平值(ºC)。持续时间, 指倒春寒从出现到终止持续的时间(d)。
ΔT represents the maximum cooling rate, which means the maximum decrease in 24 h (ΔT24) or the maximum decrease in 48 h (ΔT48) of the daily average temperature or minimum temperature from the occurrence to the end of the late spring chilling. δT represents temperature departure, which means the anomaly (ºC) of the mean temperature from the occurrence to the end of the late spring chilling. The consecutive time refers to the duration from the appearance to the end of the late spring chilling.
温室试验在东北林业大学森林生态教育部重点实验室进行, 实验材料来自黑龙江省农业科学院农村能源研究所, 供试花生品种为大田试验筛选的4个较耐低温品种以及4个不耐低温品种。花生种子萌发试验使用人工气候箱(ZPW-400, China), 光照6级(day)/光照0级(night), 光照时间为6:00-18:00, 湿度80%, 温度28℃(day)/25℃(night)。
将种子置直径为20 cm的培养皿中温水浸泡吸胀24 h, 将温度调至2℃、4℃、6℃、12℃低温冷浸培养3 d, 28℃复温后在无菌水或加GA3溶液(浓度为100 μmol L–1、200 μmol L–1、300 μmol L–1)中培养5 d, 进行检测。每个实验组每个花生品种50粒种子, 重复3次。
将花生种子温水浸泡吸胀24 h后播种于珍珠岩中, 浇灌1/2 Hoagland营养液培养萌发后, 当幼苗3对真叶完全展开后, 进行4℃低温和GA3处理。低温处理是浇灌1/2 Hoagland营养液将幼苗置4℃人工气候箱中20 min, 复温1 h。GA3处理是提前浇灌分别含有不同浓度GA3(浓度为100 μmol L–1、200 μmol L–1、300 μmol L–1)的1/2 Hoagland营养液12 h后将幼苗置4℃人工气候箱中20 min, 复温1 h。营养钵内口径10 cm、深10 cm, 每个实验组的每个品种12株, 试验重复3次。
1.2 试验方法
1.2.1 大田试验出苗率统计 于2017年6月3日在30个花生品种小区分别随机挑选3条垄, 统计播种穴数和出苗穴数。出苗率=出苗数(出苗穴数)/播种粒数(播种穴数)。
1.2.2 温室发芽试验 以正常温度为对照, 统计8个花生品种在不同处理后种子发芽数、发芽时间、芽长等数据。参考文献[18-19]计算以下参数。芽长(下胚轴+胚根)≥10 mm为发芽。发芽率= 发芽种子数/种子总数; 发芽指数(GI) = ∑Gt/Dt, 其中, Gt指t时的发芽率, Dt指发芽天数; 种子活力指数(VI) = S×GI, 其中, S指芽长(总芽长/种子总数), GI指发芽指数。
1.2.3 幼苗生理生化特性指标测定 参考文献[20]并改进。采集完全展开且叶位相同的叶片, 使用钻孔取样器(直径为1 cm)打取圆片, 将每个处理组样品分成2份, 每份1.0 g, 向烧杯中加入20 mL去离子水。一组使用真空泵抽取20 min, 室温静置30 min; 另一组使用沸水浴加热20 min, 冷却。使用电导仪分别测定电导率R1、R2, 相对膜透性以电解质外渗百分率表示。相对膜透性(%) = R1/R2×100%。
参照文献[21]的方法并改进。称取0.5 g叶片样品, 加入5 mL磷酸缓冲液冰浴研磨成匀浆, 离心后上清液为提取液。取2 mL提取液, 加入0.67%的TBA(硫代巴比妥酸)溶液4 mL, 沸水浴15 min, 冷却后离心取上清液。测定660 nm、532 nm、450 nm波长的吸光度。MDA含量C (mmol g–1FW)= [6.45´(A532-A600)-0.56´A450]´Vt/FW´Vs, MDA (μmol g–1) = C´V/W, Vt为提取液总体积(mL); Vs为提取液试验体积(mL); FW为样品重(g)。
取新鲜叶片0.3 g, 加入10 mL ddH2O沸水浴1 h, 将提取液定容至25 mL。吸取1 mL提取液, 加入1 mL ddH2O、0.5 mL蒽酮乙酸乙酯和5 mL浓硫酸, 充分振荡, 沸水浴1 min冷却至室温, 630 nm波长下测吸光度。以不同浓度纯蔗糖制作标准曲线, 计算可溶性糖含量。
称取0.5 g叶片冻干粉末, 加入磷酸缓冲液研磨成匀浆后, 离心10 min, 取上清液为提取液。吸取1.0 mL提取液, 加入5 mL考马斯亮蓝试剂, 摇匀, 放置2 min后在595 nm波长下测量吸光度。将不同浓度的BSA (牛血清蛋白, Sigma, USA)溶液显色并测定吸光度, 制作标准曲线, 以外标法通过标准曲线计算可溶性蛋白含量。
称取0.5 g叶片冻干粉末, 加入3% (w/v)磺基水杨酸溶液5 mL, 沸水浴中提取15 min。吸取2 mL提取液分别加入冰醋酸和2.5% (w/v)酸性茚三酮溶液各2 mL。摇匀后, 沸水浴中加热显色30 min, 取出冷却至室温。加入5 mL甲苯充分摇匀, 避光静置4 h, 完全分层后用吸管吸取甲苯层, 使用紫外可见光分光光度计在520 nm下检测吸光度。将不同浓度和脯氨酸标准液也以同样方法显色并测定吸光度, 制作标准曲线, 以外标法通过标准曲线计算游离脯氨酸含量。
1.2.4 统计分析 使用SPSS 17.0软件进行单因素方差分析(One-way-ANOVA)和相关性分析检验各指标之间的相关性, Microsoft Excel软件作图。用Duncan’s检验(=0.05)进行多重比较样品之间差异显著性。
2 结果与分析
2.1 春季播种期气温变化趋势和花生出苗率
由图1可知, 5月3日至6月3日1个月内发生2次倒春寒。5月1日至3日平均气温分别为19.5℃、22.5℃、23.5℃, 适合花生萌发, 但5月4日温度剧烈下降, 平均温度为15℃, ΔT24 > 8℃; 5月5日平均温度为12.5℃, 10.0 < ΔT48≤12.0; 5月6日平均温度6.5℃, 10.0 < ΔT48≤12.0, δT <-5.0, 持续3 d, 符合倒春寒天气的标准, 属于中度偏轻。第二次倒春寒在5月19-22日, 温度下降3.0 < ΔT24 < 8.0或5.0 < ΔT48≤8.0,-2.0≤δT <-1.0, 持续4 d, 程度为轻度。
统计花生播种1个月后的出苗率, 由表2可知, 出苗率较高的品种为阜花17 (FH17)、阜花12 (FH12)、冀花16 (JH16)、冀花18 (JH18), 出苗率分别为97.22%、95.36%、95.27%和94.56%; 而出苗率较低的品种分别为白玉花生(BHS)、正农黑花1号(HHS)、白沙1016 (BS1016)、七彩花生(QCHS)、鲁花11(LH11), 出苗率分别为45.51%、49.79%、50.28%、58.63%和59.63%, 选取FH17、FH12、JH16、JH18为耐低温实验组品种, BHS、HHS、BS1016和LH11为不耐低温实验组品种进行温室试验。
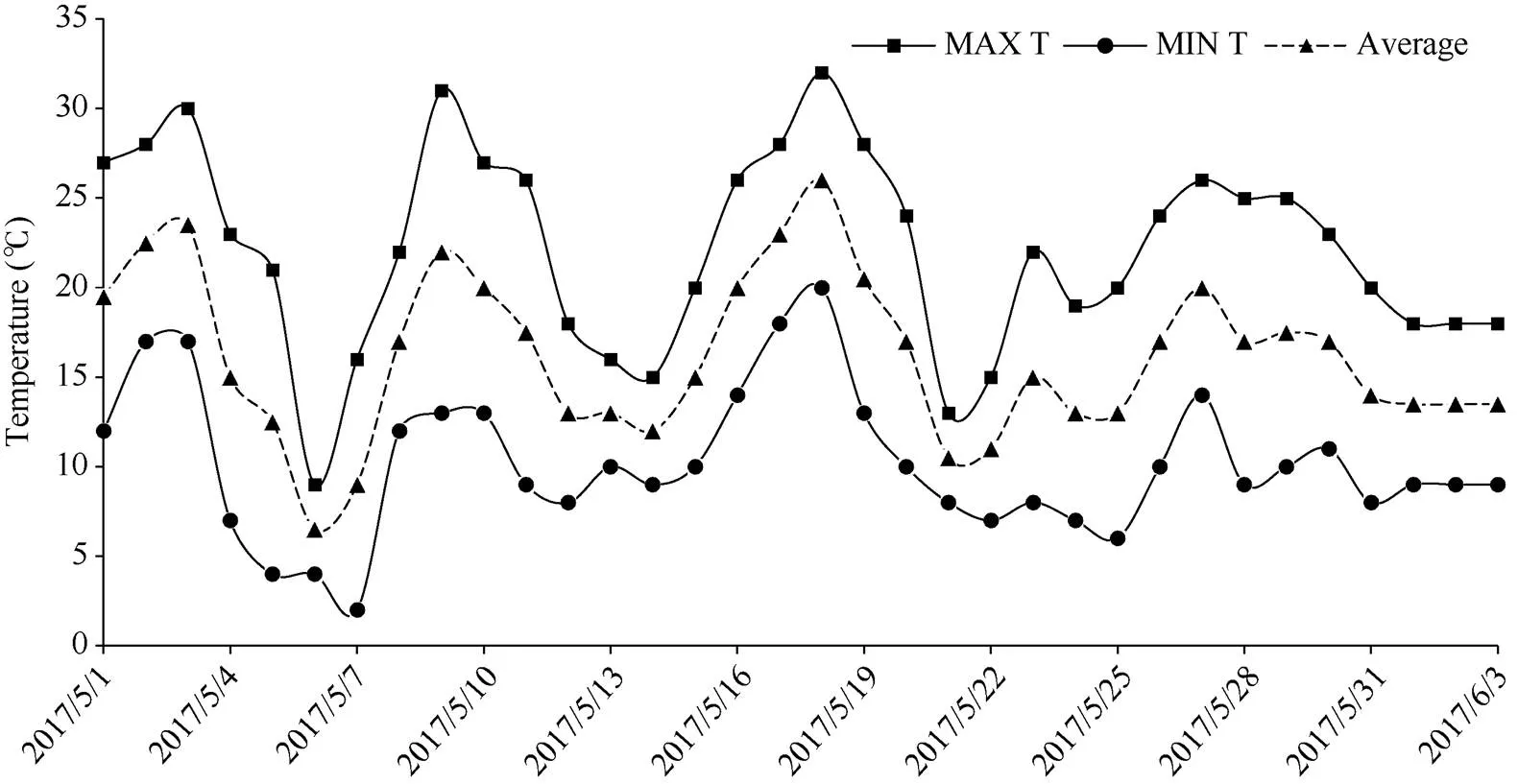
图1 2017年5月至6月气温变化
MAX T: 日最高气温; MIN T: 日最低气温; Average: 日平均气温。
MAX T: daily maximum of air temperature; MIN T: daily minimum of air temperature; Average: average value of air temperature.
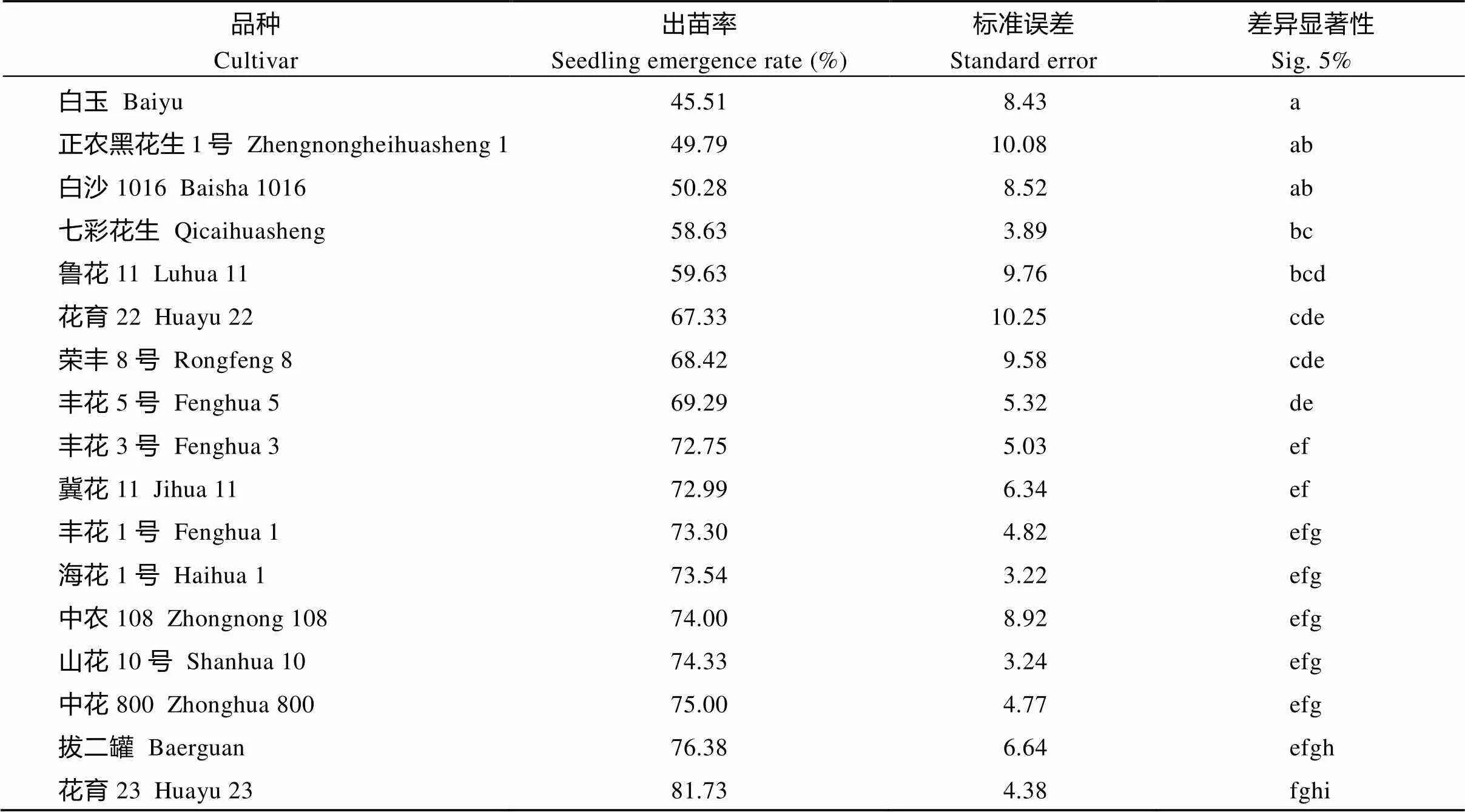
表2 播种1个月后各花生品种出苗率
(续表2)
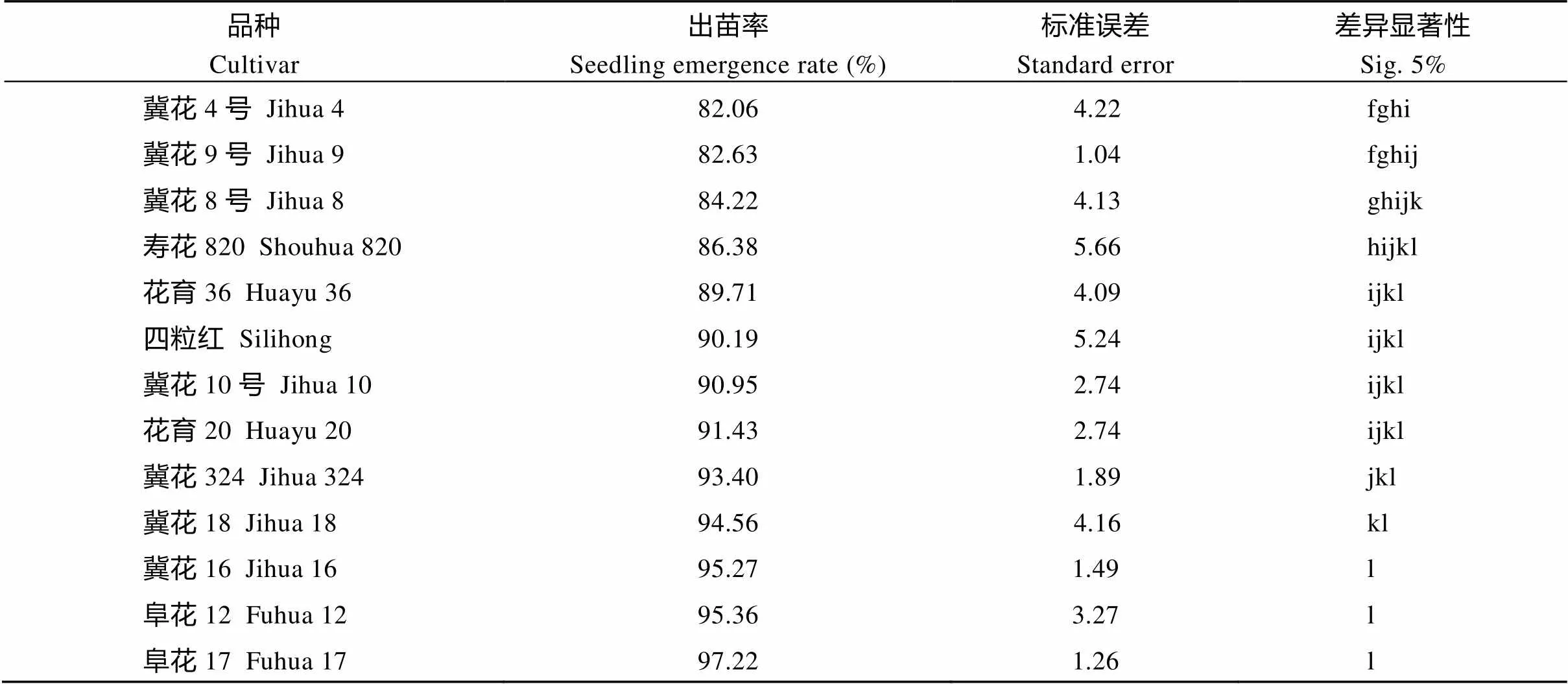
品种Cultivar出苗率Seedling emergence rate (%)标准误差Standard error差异显著性Sig. 5% 冀花4号Jihua 482.064.22fghi 冀花9号Jihua 982.631.04fghij 冀花8号Jihua 884.224.13ghijk 寿花820Shouhua 82086.385.66hijkl 花育36Huayu 3689.714.09ijkl 四粒红Silihong90.195.24ijkl 冀花10号Jihua 1090.952.74ijkl 花育20Huayu 2091.432.74ijkl 冀花324Jihua 32493.401.89jkl 冀花18Jihua 1894.564.16kl 冀花16Jihua 1695.271.49l 阜花12Fuhua 1295.363.27l 阜花17Fuhua 1797.221.26l
2.2 花生耐低温鉴定温度选择
选取2℃、4℃、6℃、12℃进行发芽对比试验, 旨在筛选合适的低温处理温度。由图2可知, 2℃处理时所有品种的发芽率显著下降, 耐低温品种发芽率都在60%以下; 4℃处理时不同耐低温性的品种之间差异明显, 相同耐低温性的品种发芽率差异较小; 12℃处理下所有花生品种发芽率差异不显著。综上, 以下试验都采用4℃作为试验处理温度。
2.3 低温胁迫和GA3对花生种子发芽率的影响
由表3可知, 常温条件下(对照组)耐低温和不耐低温的花生品种发芽率都达到95%以上, 品种间无明显差异。4℃处理后, 所有品种发芽率都有所下降, 耐低温品种发芽率比不耐低温品种下降幅度小, BHS发芽率下降幅度最大, 降低了53.29%, FH17发芽率下降了11.10%, 降低幅度最小。GA3处理后, 所有品种发芽率有显著提高, 并随GA3浓度升高而增加, 300 μmol L–1GA3处理促进发芽率升高幅度最大, 不耐低温品种发芽率增加幅度较大, 都提高了25%以上。200~300 μmol L–1GA3处理后, 耐低温品种发芽率达到了90%以上。
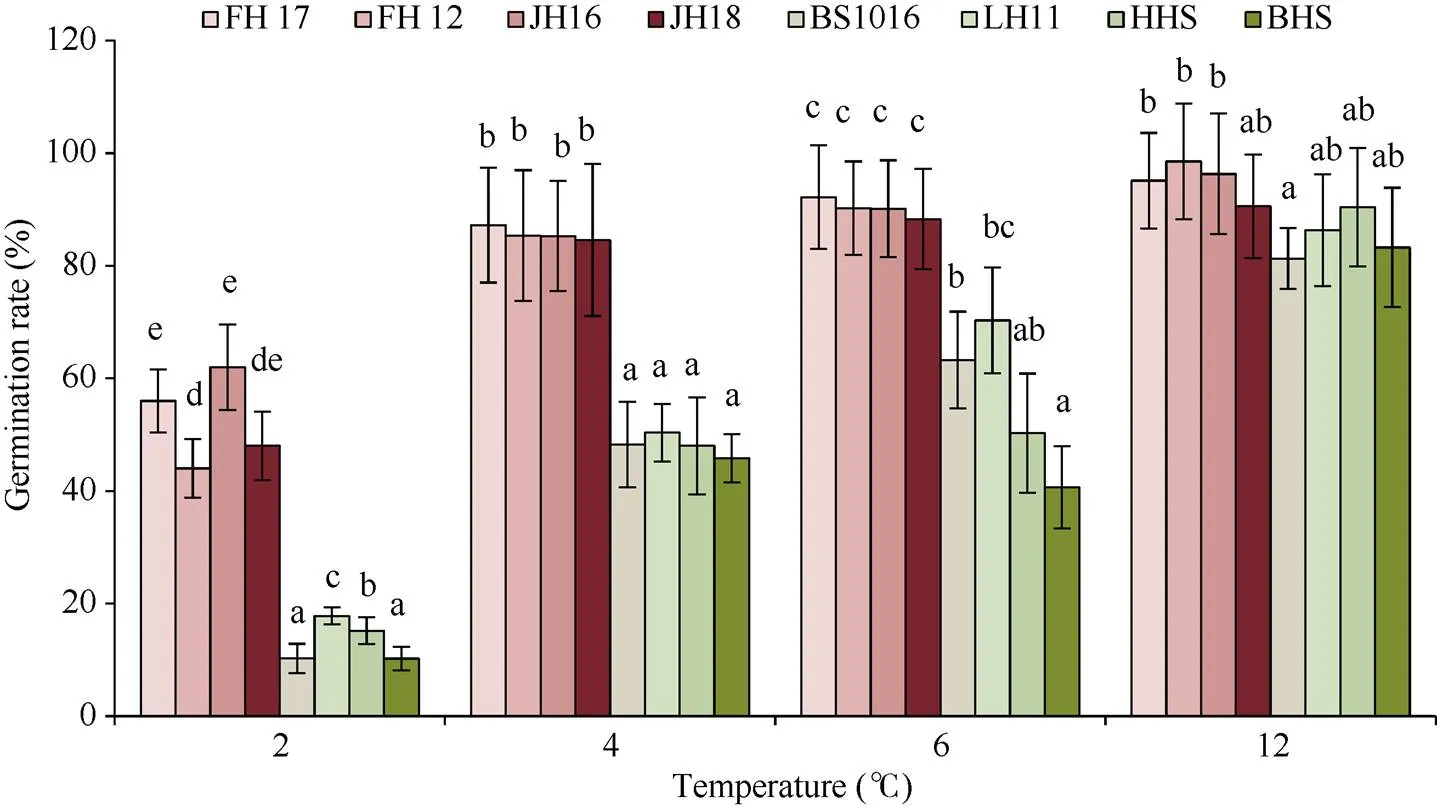
图2 不同温度对花生种子发芽率的影响
FH17: 阜花17; FH12: 阜花12; JH16: 冀花16; JH18: 冀花18; BS1016: 白沙1016; LH11: 鲁花11; HHS: 正农黑花1号; BHS: 白玉花生。图柱上不同字母表示处理之间的0.05水平差异显著。
FH17: Fuhua 17; FH12: Fuhua 12; JH16: Jihua 16; JH18: Jihua 18; BS1016: Baisha 1016; LH11: Luhua 11; HHS: Zhengnongheihua 1; BHS: Baiyuhuasheng. Bars superscripted by different letters are significantly different at the 0.05 probability level among treatments.
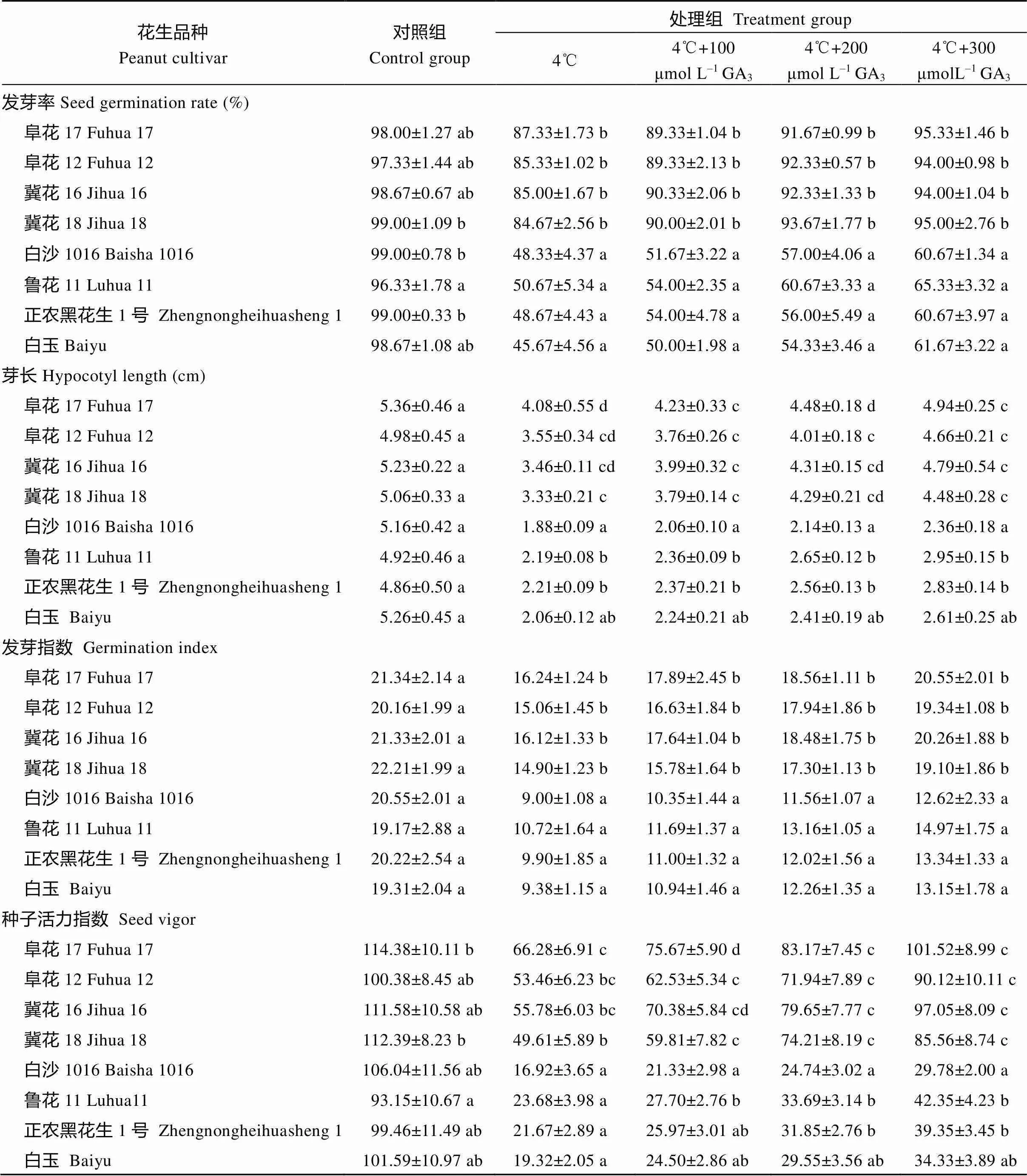
表3 低温胁迫和GA3对花生种子发芽率、发芽指数、芽长和种子活力的影响
同列标以不同字母的值为处理间在0.05水平差异显著。
Values wit hin a column followed by different letters are significantly different at the 0.05 probability level.
2.4 低温胁迫和GA3对花生种子发芽指数、芽长和种子活力的影响
由表3可知, 低温处理后不耐低温品种的发芽指数、芽长、种子活力指数显著下降, 耐低温品种也有所下降, 但下降幅度比不耐低温品种幅度明显减小。施加GA3促进了各个品种发芽指数、芽长和种子活力指数, 随着GA3浓度升高, 促进作用也逐渐加强。300 μmol L–1GA3处理对不耐低温品种芽长、发芽指数和种子活力指数促进作用稍微大于对耐低温品种。LH11芽长上升幅度最大, 增加了34.70%; BS1016和BHS发芽指数上升了40.21%和40.28%; 种子活力指数HHS上升了81.58%。JH16在300 μmol L–1GA3处理后种子活力指数升高幅度最大, 上升了73.99%。
2.5 低温胁迫和GA3对花生幼苗相对膜透性和丙二醛(MDA)含量的影响
4℃低温处理促进所有花生品种相对膜透性都升高, GA3处理后相对膜透性降低(表4)。4℃低温下, 耐低温品种相对膜透性上升幅度远远小于不耐低温品种, BHS和BS1016上升幅度为对照的0.93倍和0.90倍, FH17上升幅度最小, 上升了44.04%。相对膜透性随着GA3浓度的增大而减小, 说明GA3对低温诱导的相对膜透性升高有抑制作用, 300 μmol L–1GA3的抑制作用最大, 其中FH12的相对膜透性比4℃处理时下降了25.06%。
丙二醛的变化趋势与相对膜透性相似, 4℃处理后所有花生品种丙二醛含量显著上升, GA3处理抑制丙二醛(表4)。4℃处理后, 不耐低温品种丙二醛含量上升幅度大于耐低温品种, 其中BS1016和BHS上升幅度较大, 分别是对照的1.95倍和1.82倍; FH12和FH17上升幅度较小, 增加了30.16%和34.08%。加入GA3抑制了4℃低温诱导的丙二醛含量升高, 随着GA3含量升高, 所有品种丙二醛含量都有所下降, 加入300 μmol L–1GA3后丙二醛含量下降幅度最大, 特别是HHS降低了39.51%。
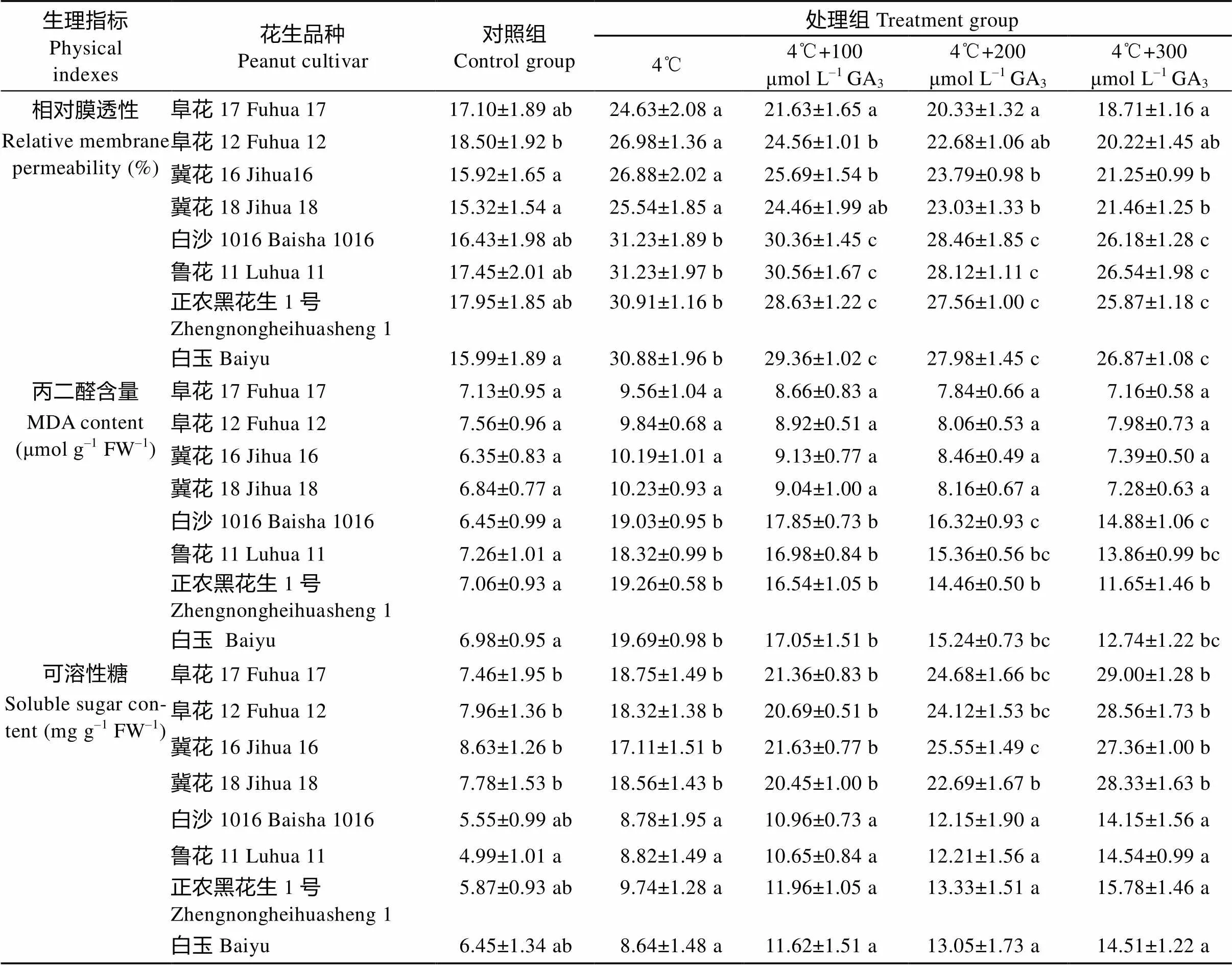
表4 低温胁迫和GA3对花生幼苗相对膜透性、丙二醛、可溶性糖、可溶性蛋白和游离脯氨酸含量的影响
(续表4)
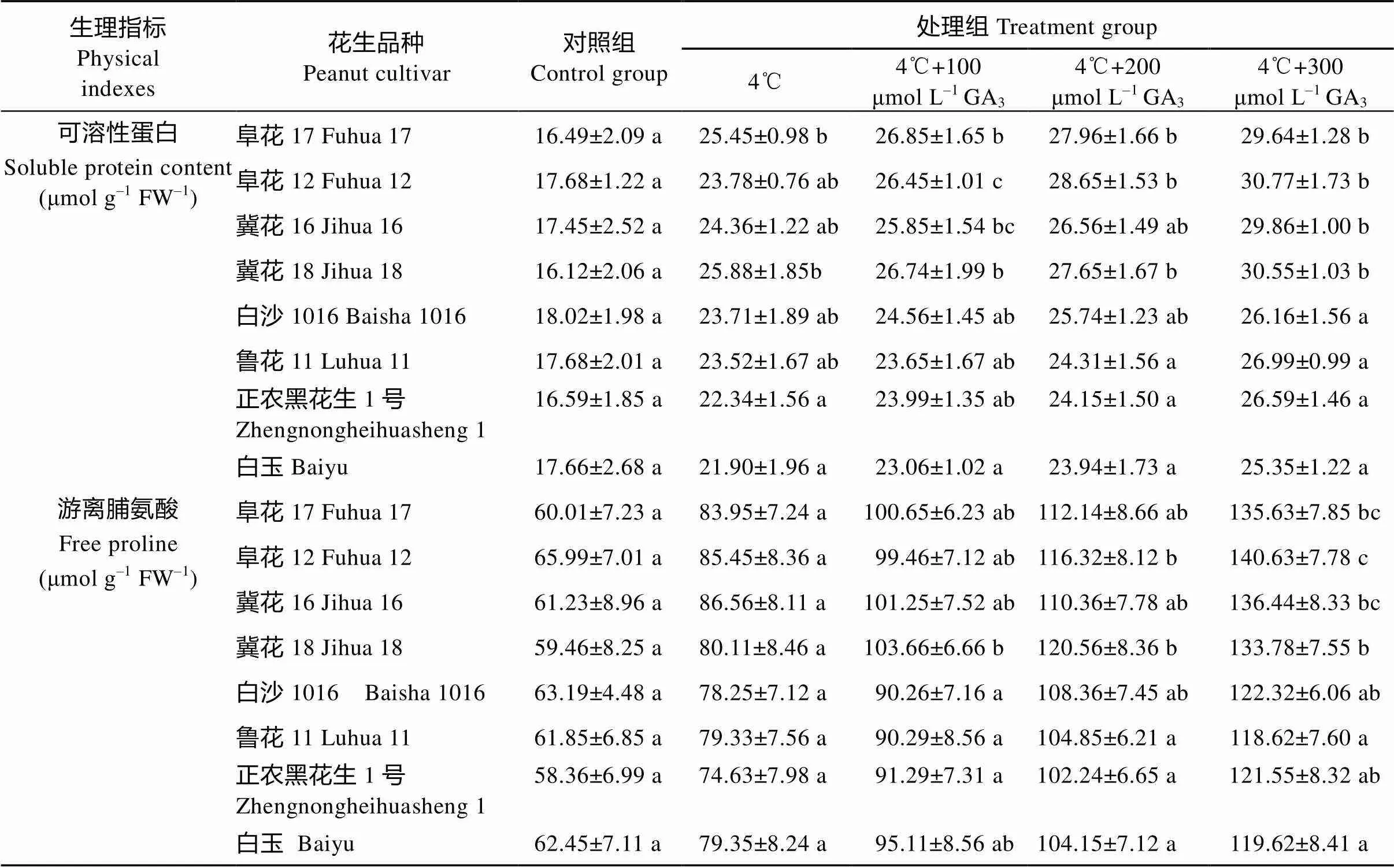
生理指标Physicalindexes花生品种Peanut cultivar对照组Control group处理组Treatment group 4℃4℃+100μmol L–1 GA34℃+200μmol L–1 GA34℃+300μmol L–1 GA3 可溶性蛋白Soluble protein content (μmol g–1 FW–1)阜花17 Fuhua 1716.49±2.09 a25.45±0.98 b26.85±1.65 b27.96±1.66 b29.64±1.28 b 阜花12 Fuhua 1217.68±1.22 a23.78±0.76 ab26.45±1.01 c28.65±1.53 b30.77±1.73 b 冀花16 Jihua 1617.45±2.52 a24.36±1.22 ab25.85±1.54 bc26.56±1.49 ab29.86±1.00 b 冀花18 Jihua 1816.12±2.06 a25.88±1.85b26.74±1.99 b27.65±1.67 b30.55±1.03 b 白沙1016 Baisha 101618.02±1.98 a23.71±1.89 ab24.56±1.45 ab25.74±1.23 ab26.16±1.56 a 鲁花11 Luhua 1117.68±2.01 a23.52±1.67 ab23.65±1.67 ab24.31±1.56 a26.99±0.99 a 正农黑花生1号Zhengnongheihuasheng 116.59±1.85 a22.34±1.56 a23.99±1.35 ab24.15±1.50 a26.59±1.46 a 白玉Baiyu17.66±2.68 a21.90±1.96 a23.06±1.02 a23.94±1.73 a25.35±1.22 a 游离脯氨酸Free proline(μmol g–1 FW–1)阜花17 Fuhua 1760.01±7.23 a83.95±7.24 a100.65±6.23 ab112.14±8.66 ab135.63±7.85 bc 阜花12 Fuhua 1265.99±7.01 a85.45±8.36 a99.46±7.12 ab116.32±8.12 b140.63±7.78 c 冀花16 Jihua 1661.23±8.96 a86.56±8.11 a101.25±7.52 ab110.36±7.78 ab136.44±8.33 bc 冀花18 Jihua 1859.46±8.25 a80.11±8.46 a103.66±6.66 b120.56±8.36 b133.78±7.55 b 白沙1016 Baisha 101663.19±4.48 a78.25±7.12 a90.26±7.16 a108.36±7.45 ab122.32±6.06 ab 鲁花11 Luhua 1161.85±6.85 a79.33±7.56 a90.29±8.56 a104.85±6.21 a118.62±7.60 a 正农黑花生1号Zhengnongheihuasheng 158.36±6.99 a74.63±7.98 a91.29±7.31 a102.24±6.65 a121.55±8.32 ab 白玉Baiyu62.45±7.11 a79.35±8.24 a95.11±8.56 ab104.15±7.12 a119.62±8.41 a
同列标以不同字母的值为处理间在0.05水平差异显著。
Values within a column followed by different letters are significantly different at the 0.05 probability level.
2.6 低温胁迫和GA3对花生幼苗可溶性糖、可溶性蛋白和游离脯氨酸含量的影响
由表4可知, 对照组中耐低温品种可溶性糖含量高于不耐低温品种。4℃处理后花生可溶性糖含量上升, 耐低温性强的品种可溶性糖含量显著上升, FH17和JH18上升较大, 增加了1.51倍和1.39倍; 不耐低温品种上升幅度较小, 其中BHS上升最小, 升高了33.95%。加入GA3后促进各品种可溶性糖含量升高, 并且随着GA3浓度的升高而上升。100~300 μmol L–1GA3处理不耐低温品种LH11、BHS和HHS上升幅度超过耐低温品种, 特别是BHS和LH11在300 μmol L–1GA3处理后上升幅度较大, 升高了67.94%和64.85%。
4℃处理后各品种可溶性蛋白含量变化趋势与可溶性糖含量相似。常温条件下各品种可溶性蛋白含量差异不显著。4℃条件下各个品种可溶性蛋白显著升高, 耐低温品种可溶性蛋白升高幅度与不耐低温品种升高幅度差异不显著, JH18和FH17上升幅度达到了60.55%和54.34%, HHS上升幅度最小, 上升了6.83%。加入GA3后所有品种可溶性蛋白含量都有上升趋势。不耐低温品种在4℃处理后加入100 μmol L–1GA3, 可溶性蛋白含量上升显著。加入300 μmol L–1GA3所有品种可溶性蛋白含量上升幅度最大, 其中FH12可溶性蛋白含量最高, 上升了29.39% (表4)。
低温导致所有花生品种游离脯氨酸含量上升, 其中上升较多的是JH18和FH17, 增加了41.37%和39.89%。各花生品种在4℃处理后加入GA3, 随着处理浓度升高游离脯氨酸含量上升。GA3浓度为300 μmol L–1时游离脯氨酸含量最高, 与低温处理相比JH18上升幅度最大, 上升了67.00%。耐低温品种的游离脯氨酸含量显著高于不耐低温品种(表4)。
2.7 低温胁迫下种子萌发相关指标与幼苗生理生化指标相关性分析
由表5可知, 种子萌发相关指标发芽率、发芽指数、种子活力和芽长之间存在极显著正相关(<0.01)。种子萌发相关指标与相对膜透性、丙二醛存在极显著负相关(<0.01), 与可溶性糖呈现极显著正相关(<0.01)。可溶性蛋白与发芽率和芽长为显著正相关(<0.05), 但与发芽指数和种子活力相关性不显著。脯氨酸含量与发芽率和发芽指数存在极显著正相关(<0.01), 与种子活力和芽长呈现显著正相关(<0.05)。
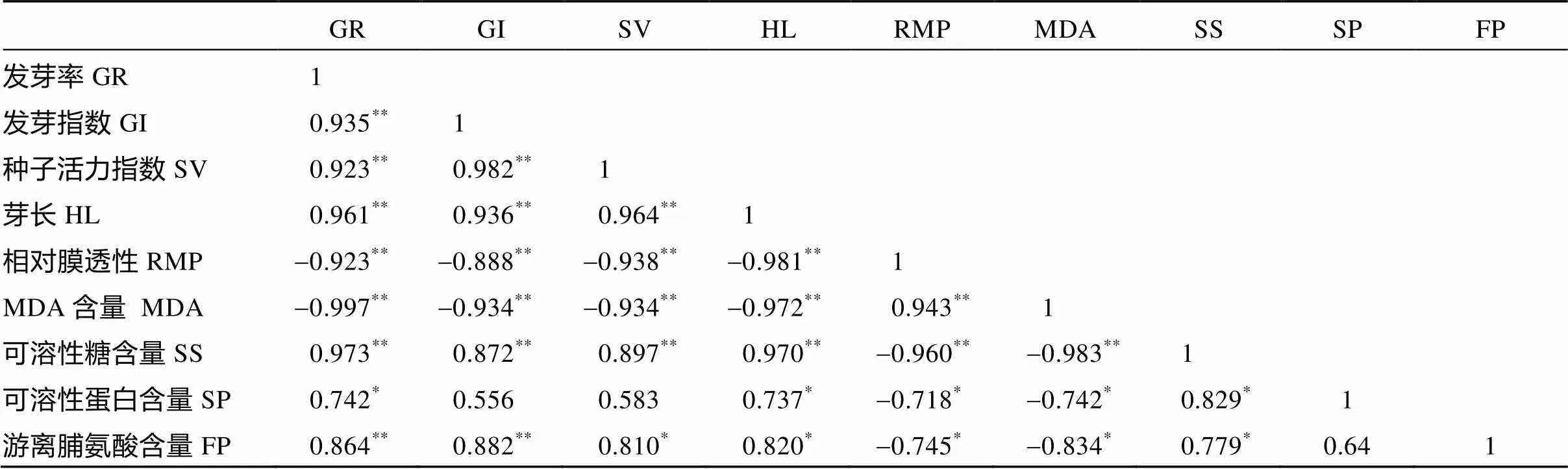
表5 种子萌发相关指标与幼苗生理生化指标的相关系数
**表示< 0.01 (双尾);*表示< 0.05 (双尾)。
**: significant at the 0.01 probability level (2-tailed);*: significant at the 0.05 probability level (2-tailed). GR: germination rate; GI: germination index; SV: seed vigor; HL: hypocotyl length; RMP: relative membrane permeability; MDA: MDA content; SS: soluble sugar content; SP: soluble protein content; FP: free proline content.
本研究以发芽率为参考指标, 将不同品种(A)、温度(B)和赤霉素浓度(C)作为效应因子, 分析其效应相互影响的显著性对发芽率的影响。首先, 各水平结合下的数据正态分布检验, Shapiro-Wilk检验结果表明除了耐低温品种在常温下使用300 μmol L–1GA3处理后发芽率(=0.024)不符合, 其余各组数据均符合正态分布(>0.05)(表6)。由方差检验分析结果(表7)可知A、B、C主效应都已达到显著, A与B的交互效应达到显著(<0.01), 但A×C、A×B×C之间的交互效应不显著(>0.01)。对效应因子B和C在A1和A2两种水平上进行简单效应检验(表8)表明, B在A1水平上简单效应不显著(>0.05), B在A2水平上简单效应极显著(<0.01), 效应因子C在A1和A2水平上都不显著(>0.05)。
3 讨论
3.1 低温对花生种子萌发和生长的影响
近年来, 我国全国范围内倒春寒发生频率逐渐上升, 但各地区对倒春寒研究进度不尽相同, 以西南(滇桂黔)发表研究论文最多, 东北地区发表论文最少[1]。温度对花生种植的影响很大, 针对黑龙江地区倒春寒研究相对较少的问题, 开展了倒春寒对花生出苗影响的大田试验和低温胁迫对花生种子萌发影响的相关研究。研究表明, 春季温度在12℃以上种植不覆膜花生最为适宜。低温常导致花生发芽延缓、生长缓慢、干物质积累减少, 甚至种子丧失发芽能力等后果[22], 我国北方花生产区出现倒春寒天气时, 易导致大面积烂种。王晶珊等[23]研究结果表明, 花生在出苗阶段, 种子吸胀萌动和初始发育阶段对低温最为敏感。本研究大田试验时期花生播种后出现了2次倒春寒天气。其后, 各花生品种出苗率差异显著, 阜花12、阜花17、冀花16、冀花18、花育20、四粒红等品种出苗率可达到90%以上, 说明其耐低温能力较强, 低温对其种子萌发出苗影响不大, 但鲁花11、白沙1016、七彩花生、白花生、黑花生等品种发芽率在60%以下, 说明这些品种相对耐低温性较弱, 倒春寒对其出苗影响较大。温室试验中发芽率等萌发相关指数与大田试验结果一致。值得关注的是白花生、黑花生和七彩花生这类“彩色花生”品种耐低温性较差。

表6 效应因子正态分布检验
效应因子A代表不同耐低温性品种; 效应因子B代表不同温度处理; 效应因子C代表不同浓度赤霉素处理。
A represents varieties with different levels of low-temperature resistance; B represents different temperature treatments; C represents different concentrations of GA3.
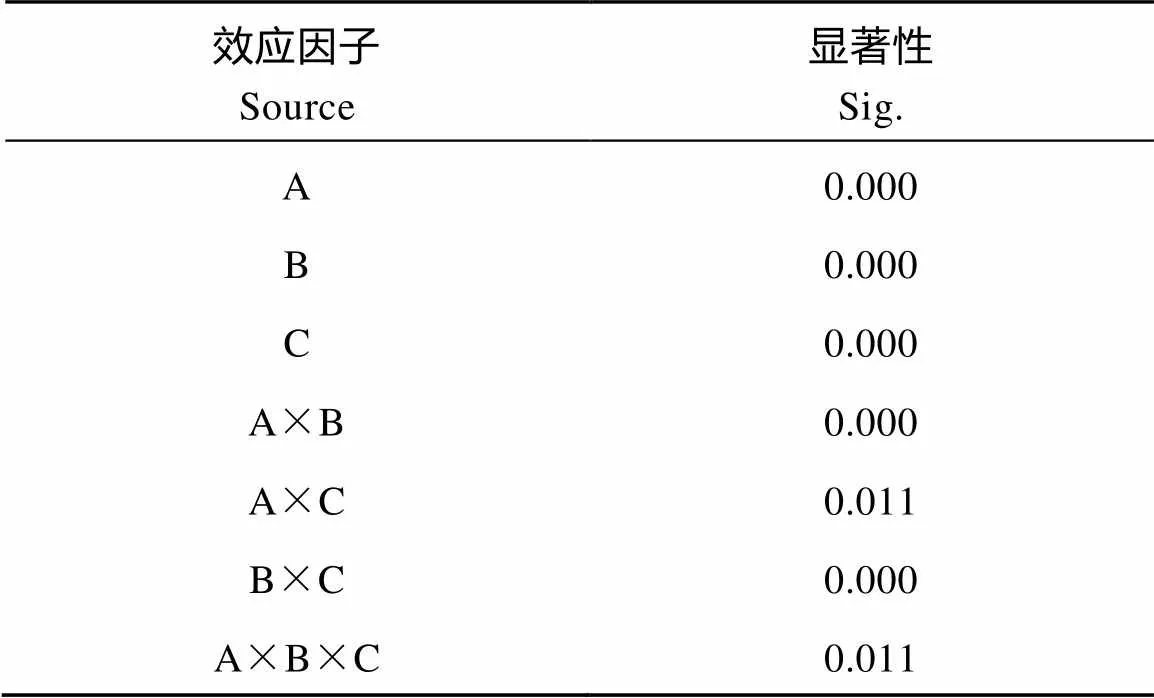
表7 不同效应因子交互效应方差分析结果
缩写同表6。
Abbreviations are the same as those described in Table 6.
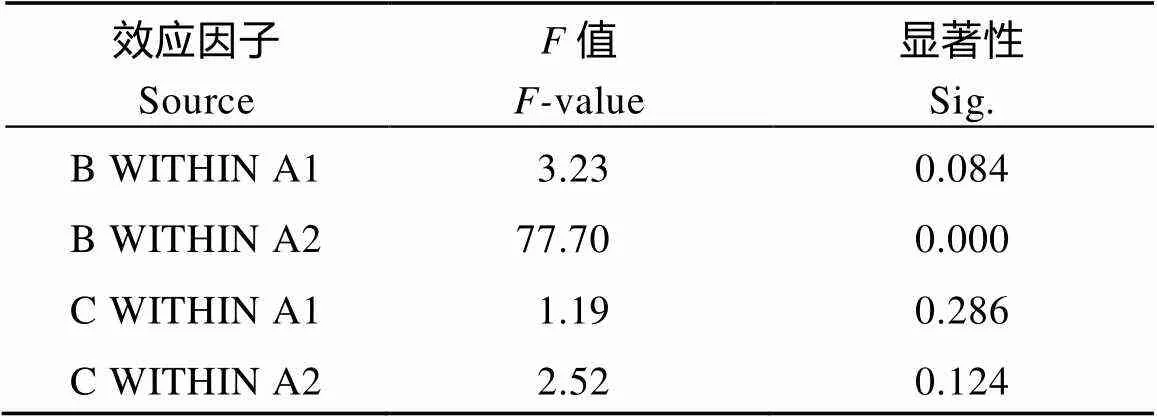
表8 效应因子交互作用简单效应检验
B WITHIN A1/A2表示效应因子B在A1或A2水平上简单效应结果; C WITHIN A1/A2表示效应因子C在A1或A2水平上简单效应结果。缩写同表6。
B WITHIN A1/A2 represents simple effect of effect factor B on A1 or A2 level; C WITHIN A1/A2 represents simple effect of effect factor C on A1 or A2 level. Abbreviations are the same as those described in Table 6.
丙二醛(MDA)是植物在遭受逆境胁迫时细胞膜脂过氧化作用生成的最终产物, 所以MDA浓度一定程度上反映了细胞膜受伤害的程度。温室试验结果表明, 较耐低温品种(阜花12、阜花17、冀花16、冀花18)在低温处理后MDA含量上升幅度低于不耐低温品种(鲁花11、白沙1016、白花生和黑花生), 说明耐低温性强的花生品种细胞膜受低温伤害较小。细胞膜相对透性的变化能反映植物低温伤害程度, 相对膜透性越大说明低温伤害越大[24]。正常生长条件下各品种相对膜透性无显著差异, 但低温处理后不耐低温品种叶片的电导率上升明显, 说明其相对膜透性增大。通过MDA和相对膜透性的结果表明不耐低温品种在低温处理后受伤害更严重。植物体内可溶性糖、可溶性蛋白有较强亲水性, 明显增强细胞持水力, 减少低温导致原生质结冰致死的可能, 从而提高植物耐低温能力[25]。本研究中耐低温品种在低温处理后可溶性糖和可溶性蛋白量上升显著, 正常条件下不耐低温品种的可溶性糖含量较低。植物细胞内游离脯氨酸也是一类重要的渗透调节物[26], 作用与可溶性糖等相似, 增加细胞内溶质量, 防止细胞过度失水造成渗透胁迫, 降低冰点, 减轻低温对细胞的损害[27]。以前研究中脯氨酸含量与抗渗透胁迫之间呈现显著正相关, 脯氨酸含量也作为植物抗逆性评价的重要指标之一[28-30]。本研究结果表明低温处理后较耐低温品种脯氨酸含量较高, 升高幅度最大, 与前人研究结果一致。
3.2 赤霉素对花生种子萌发和生长的影响
赤霉素(GA)是一类植物激素, 在植物生长的整个生命周期中都发挥重要作用, 在植物种子萌发、幼苗发育过程中茎和下胚轴伸长和叶子扩张[31]等方面具有必不可少的作用。许多研究表明, 赤霉素有促进种子萌发的作用, 并且对打破种子休眠、提高发芽率、缩短发芽时间有显著效果[32-34], 同时赤霉素还可以缓解逆境胁迫对种子萌发和幼苗生长的抑制作用[35]。本研究中GA3显著缓解低温对花生种子萌发的抑制, 特别是300 μmol L–1GA3对花生种子萌发的促进作用最大。代勋等[36]报道, 赤霉素能够抑制低温和干旱导致的电解质渗透率增加和MDA积累。刘永庆等[14]证明赤霉素能破除种子休眠, 促进淀粉酶和水解酶合成, 修复受损的细胞膜。本研究中, GA3处理后各花生品种MDA含量、相对膜透性都显著下降, 说明GA3对低温造成的MDA含量升高和相对膜透性上升具有抑制作用, GA3缓解低温对花生幼苗伤害, 与前人研究结果一致。另外, GA3提高花生幼苗可溶性糖、可溶性蛋白和游离脯氨酸含量(表4), 也从侧面说明花生幼苗抗寒性有所增加。研究表明[37-39]植物幼苗时期施加赤霉素不仅可以促进幼苗叶片可溶性糖含量, 也能促进植物结实量和果实品质, 赤霉素对花生果实品质的影响需要进一步研究。
3.3 低温和赤霉素对不同花生品种发芽率的简单效应分析
作物的耐低温性是作物在遭受低温胁迫时能够抵御胁迫, 维持生命延续的一种能力, 同一种作物不同品种之间也会存在较大差异。通过对品种、温度、赤霉素3个效应因子进行简单效应分析可知低温对不同品种影响不同, 低温对较耐低温品种影响不显著, 但对不耐低温品种影响非常显著; 另外简单效应检验表明, 赤霉素在品种间差异不显著, 这可能是由于赤霉素对种子萌发的促进作用具有普适性。本研究通过大田试验统计不同花生品种在倒春寒后出苗情况结合温室试验检测低温胁迫对花生发芽率、种子活力、发芽指数和幼苗低温下的生理生化指标综合分析, 筛选了耐低温花生品种, 今后可进一步验证在黑龙江地区种植的可行性并进行推广。另外, 在花生播种前使用一定浓度赤霉素处理种子, 能够促进花生发芽和提高幼苗耐低温能力。
4 结论
筛选出耐低温的品种(阜花12、阜花17、冀花16、冀花18)和不耐低温的品种(鲁花11、白沙1016、黑花生、白花生)。前者在遭遇低温胁迫后种子发芽率、发芽指数、种子活力和芽长高于后者; MDA含量、相对膜透性低于后者, 可溶性糖、脯氨酸含量显著高于后者。赤霉素对低温导致的种子萌发降低和幼苗生长阻碍有一定缓解作用, 并且300 μmol L–1赤霉素的作用效果最大。
[1] 王梓, 徐军亮, 魏红旭. 中国“倒春寒”天气的发生及对树木春季生长影响. 北方园艺, 2015, (16): 195–201. Wang Z, Xu J L, Wei H X. Spring frost following warn spell and its effect on the growth of the tree in spring., 2015, (16): 195–201 (in Chinese with English abstract).
[2] Bedi S, Basra A S. Chilling injury in germination seeds: basic mechanisms and agricultural implications., 1993, 4: 219–229.
[3] 韩国军, 张春光, 马丰山, 赵兴楠. JSR低温胁迫对植物生理应答分子机制的进展. 长春师范学院学报(自然科学版), 2008, 27(6): 71–74.Han G J, Zhang C G, Ma F S, Zhao X N. Advance in the mechanism of physical molecular responses of plants to low temperature stress.(Nat Sci Edn), 2008, 27(6): 71–74 (in Chinese with English abstract).
[4] 颜启传. 种子学. 北京: 中国农业出版社, 2001. 97–102. Yan Q C. Seed Science. Beijing: China Agriculture Press, 2001. pp 97–102 (in Chinese).
[5] 封海胜. 花生种子吸胀间耐低温性鉴定. 中国油料, 1991, (1): 69–72. Feng H S. Identification of low temperature resistance of peanut in seed imbibition stage., 1991, (1): 69–72 (in Chinese).
[6] 唐月异, 王传堂, 高华援, 凤桐, 张树伟, 王秀贞, 张建成, 禹山林. 花生种子吸胀期间耐低温性及其与品质性状的相关研究. 核农学报, 2011, 25: 436–442. Tang Y Y, Wang C T, Gao H Y, Feng T, Zhang S W, Wang X Z, Zhang J C, Yu S L. Low temperature tolerance during seed imbibition and its relationship to main quality traits in peanut., 2011, 25: 436–442 (in Chinese with English abstract).
[7] Chen N, Yang Q L, Hu D Q, Pan L J, Chi X Y, Chen M N, Yang Z, Wang T, Wang M, He Y N, Yu S L. Gene expression profiling and identification of resistance genes to low temperature in leaves of peanut (L.)., 2014, 169: 214–225.
[8] Gashi B, Abdullai K, Mata V, Kongjika E. Effect of gibberellic acid and potassium nitrate on seed germination of the resurrection plantsand., 2012, 11: 4537–4542.
[9] 吕桂兰, 王庆祥. 在低温条件下赤霉素和激动素对大豆种子萌发的影响. 辽宁农业科学, 1999, (4): 9–11. Lyu G L, Wang Q X. Effect of gibberellin and kinetin on seed germination of soybean under low temperature., 1999, (4): 9–11 (in Chinese).
[10] 张华微, 栾雨时, 张匀. 促进越橘种子发芽的研究. 北方园艺, 2006, (5): 41–42. Zhang H W, Luan Y S, Zhang Y. Study on the improvement of blueberry seed germination., 2006, (5): 41–42 (in Chinese with English abstract).
[11] Hedden P, Phillips A L. Manipulation of hormone biosynthetic genes in transgenic plants., 2000, 11: 130–137.
[12] Brooking I R, Cohen D. Gibberellin–induced flowering in small tubers of Zantedeschia, ‘Black Magic’., 2002, 95: 63–73.
[13] Joly C, Maftah A, Riou-Khamlichi C. Alteration of gibberellin response in transgenic tobacco plants which express a human Lewis fucosyltransferase., 2004, 42: 629–637.
[14] 刘永庆, Bino R J, Karssen C M. 赤霉素与脱落酸对番茄种子萌发中细胞周期的调控. 植物学报, 1995, 37: 274–282. Liu Y Q, Bino R J, Karssen C M. GA and ABA regulation on the cell cycle in germination of tomato seeds., 1995, 37: 274–282 (in Chinese with English abstract).
[15] 吕彪, 许耀照, 王治江, 范艳玲, 郁映君. 聚乙二醇胁迫下赤霉素浸种对番茄种子萌发和幼苗生长的影响. 干旱地区农业研究, 2009, 27(4): 136–139. Lyu B, Xu Y Z, Wang Z J, Fan Y L, Yu Y J. Effect of polyethylene glycol stress on seedling growth and seed germination of tomato with gibberellin soaking., 2009, 27(4): 136–139 (in Chinese with English abstract).
[16] 温福平, 张檀, 张朝晖, 潘映红. 赤霉素对盐胁迫抑制水稻种子萌发的缓解作用的蛋白质组分析. 作物学报, 2009, 35: 483–489. Wen F P, Zhang T, Zhang Z H, Pan Y H. Proteome analysis of relieving effect of gibberellin on the inhibition of rice seed germination by salt stress., 2009, 35: 483–489 (in Chinese with English abstract).
[17] 于海英, 柴守权, 周玉江, 赵俊. 倒春寒与杨树烂皮病发病的关系. 浙江农林大学学报, 2011, 28: 927–930. Yu H Y, Chai S Q, Zhou Y J, Zhao J. Relationship betweenand abnormal coldness in spring., 2011, 28: 927–930 (in Chinese with English abstract).
[18] 李春娟, 闫彩霞, 张廷婷, 马超, 单世华. 温度对不同花生品种种子活力的影响. 花生学报, 2012, 41(1): 21–25. Li C J, Yan C X, Zhang Y T, Ma C, Shan S H. Effect of temperature on vigor of peanut seed and quality components., 2012, 41(1): 21–25 (in Chinese with English abstract).
[19] 黄金堂, 陈海玲, 李清华, 李淑萍, 谢志琼. 春花生与秋花生种子活力比较研究. 花生学报, 2007, 36(3): 30–33. Huang J T, Chen H L, Li Q H, Li S P, Xie Z Q. The comparative study of seed vigor between spring planted and autumn planted peanuts., 2007, 36(3): 30–33 (in Chinese with English abstract).
[20] 李锦树, 王洪春, 王文英, 朱亚芳. 干旱对玉米叶片细胞透性及膜脂的影响. 植物生理学报, 1983, 9(3): 9–15. Li J S, Wang H C, Wang W Y, Zhu Y F. Effect of drought on the permeability and membrane lipid composition from maize leaves., 1983, 9(3): 9–15 (in Chinese with English abstract).
[21] Guo X R, Chang B W, Zu Y G, Tang Z H. The impacts of increased nitrate supply ongrowth and alkaloid accumulations under ultraviolet–B stress., 2014, 9: 640–646.
[22] 史普想, 王铭伦, 于洪波, 潘德成, 吴占鹏, 王慧新. 不同成熟度花生种子萌动期低温对苗期生长发育的影响. 作物杂志, 2009, (1): 78–81.Shi P X, Wang M L, Yu H B, Pan D C, Wu Z P, Wang H X. Effects of low temperature at germination stage on seedlings of peanuts with different maturation degree., 2009, (1): 78–81 (in Chinese with English abstract).
[23] 王晶珊, 封海胜, 栾文琪. 低温对花生出苗的影响及耐低温种质的筛选. 中国油料, 1985, (3): 28–32. Wang J S, Feng H S, Luan W Q. Effect of low temperature on seed emergence and screening low temperature resistance germplasm., 1985, (3): 28–32 (in Chinese).
[24] 巨伟, 杨彩凤, 张树华, 田纪春, 海燕, 杨学举. 冬小麦低温处理叶片细胞膜透性的QTL定位. 作物学报, 2012, 38: 1247–1252. Ju W, Yang C F, Zhang S H, Tian J C, Hai Y, Yang X J. Mapping QTL for cell membrane permeability of leaf treated by low temperature in winter wheat., 2012, 38: 1247–1252 (in Chinese with English abstract).
[25] 朱政, 蒋家月, 江昌俊, 李雯. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响. 安徽农业大学学报, 2011, 38: 24–26. Zhu Z, Jiang J Y, Jiang C J, Li W. Effects of low temperature stress on SOD activity, soluble protein content and soluble sugar content inleaves., 2011, 38: 24–26 (in Chinese with English abstract).
[26] 沙汉景, 胡文成, 贾琰, 王新鹏, 田雪飞, 于美芳, 赵宏伟. 外源水杨酸、脯氨酸和γ–氨基丁酸对盐胁迫下水稻产量的影响. 作物学报, 2017, 43: 1677–1688. Sha H J, Hu W C, Jia Y, Wang X P, Tian X F, Yu M F, Zhao H W. Effect of exogenous salicylic acid, proline, and γ–aminobutyric acid on yield of rice under salt stress., 2017, 43: 1677–1688 (in Chinese with English abstract).
[27] 宁露云, 包满珠, 张蔚. 低温胁迫对矮牵牛H株系花青素、游离脯氨酸及可溶性糖含量的影响. 湖北农业科学, 2016, 55: 1500–1503. Ning L Y, Bao M Z, Zhang W. Effect of low temperature stress on the contents of anthocyanin, free proline and soluble sugar of., 2016, 55: 1500–1503 (in Chinese with English abstract).
[28] 汤章城. 逆境条件下植物脯氨酸的累积及其可能的意义. 植物生理学通讯, 1984, (1): 17–23. Tang Z C. Accumulation of proline in plant under stress and its possible significance., 1984, (1): 17–23 (in Chinese).
[29] 刘娥娥, 宗会, 郭振飞, 黎用朝. 干旱、盐和低温胁迫对水稻幼苗脯氨酸含量的影响. 热带亚热带植物学报, 2000, 8: 235–238. Liu E E, Zong H, Guo Z F, Li Y C. Effect of drought, salt and chilling stresses on proline accumulation in shoot of rice seedlings., 2000, 8: 235–238 (in Chinese with English abstract).
[30] 王若梦, 董宽虎, 李钰莹, 李晨, 杨静芳. 外源植物激素对NaCl胁迫下苦马豆苗期脯氨酸代谢的影响. 草业学报, 2014, 23(2): 189–195. Wang R M, Dong K H, Li Y Y, Li C, Yang J F. Effects of applying exogenous plant hormone on praline metabolism ofseedlings under NaCl stress., 2014, 23(2): 189–195 (in Chinese with English abstract).
[31] Ward J M, Smith A M, Shah P K, Galanti S E, Yi H, Demianski A J, van der Graaff E, Keller B, Neff M M. A new role for theAP2 transcription factor, LEAFY PETIOLE, in gibberellin–induced germination is revealed by the misexpression of a homologous gene,., 2006, 18: 29–39.
[32] 申瑞雪, 潜伟平, 刘江华, 刘仁林. 不同温度下赤霉素处理对乌饭树与短尾越橘种子发芽的影响. 经济林研究, 2012, 30(4): 13–18. Shen R X, Qian W P, Liu J H, Liu R L. Effects of GA3treatments on seed germination inandat different temperatures., 2012, 30(4): 13–18 (in Chinese with English abstract).
[33] 孟春芬, 严俊, 曾涛, 江施言, 黄天志, 程剑平. 赤霉素对秋葵种子发芽的影响. 种子, 2012, 31(11): 100–102. Meng C F, Yan J, Zeng T, Jiang S Y, Huang T Z, Cheng J P. The effect of gibberellin on germination of Okra seeds., 2012, 31(11): 100–102 (in Chinese with English abstract).
[34] 叶景学, 孙桂波, 纪海彬. 温度和赤霉素对圆叶牵牛种子萌发的影响. 北方园艺, 2012, (17): 88–89. Ye J X, Sun G B, Ji H B. Effect of temperature and gibberellin on the germination of(Linn.) Voigt seeds., 2012, (17): 88–89 (in Chinese with English abstract).
[35] 张永芳, 卫秋慧, 王润梅, 张巽. 外源赤霉素对盐胁迫下谷子种子萌发的影响. 作物杂志, 2012, (6): 139–141. Zhang Y F, Wei Q H, Wang R M, Zhang X. Effect of gibberellin on seed germination of millet () under salt stress., 2012, (6): 139–141 (in Chinese).
[36] 代勋, 李忠光, 龚明. 赤霉素、钙和甜菜碱对小桐子种子萌发及幼苗抗低温和干旱的影响. 植物科学学报, 2012, 30: 204–212. Dai X, Li Z G, Gong M. Effect of gibberellin, calcium, and betaine on seed germination and resistance ofL. seedlings to low temperature and drought stress., 2012, 30: 204–212 (in Chinese with English abstract).
[37] 刘会宁, 肖锋利. 赤霉素对早紫葡萄无核及果实品质的效应. 长江大学学报(自然科学版), 2006, 3(4): 139–141. Liu H N, Xiao F L. Effect of gibberellin on seedlessness and fruit major quality of ‘Zaozi’ grape.(Nat Sci Edn), 2006, 3(4): 139–141 (in Chinese).
[38] 杜晓彧, 常海飞, 冯晓东. 不同浓度赤霉素对金丝小枣叶片生长和果实品质的影响. 延安大学学报(自然科学版), 2014, 33(1): 50–53. Du X Y, Chang H F, Feng X D. Effect of leaf growth and fruit quality ofcv. Jinsixiaozao at different concentration of GA.an Univ (Nat Sci Edn), 2014, 33(1): 50–53 (in Chinese with English abstract).
[39] 朱敏, 邓穗生, 麦贤家, 贺军虎, 陈华蕊, 陈业渊. GA3和CPPU对海南贵妃杧产量和果实品质的影响. 热带作物学报, 2014, 35: 1784–1790.Zhu M, Deng S S, Mai X J, He J H, Chen H R, Chen Y Y. Effect of two plant growth regulators on yield and fruit quality of Hainan Guifei mango (L.)., 2014, 35: 1784–1790 (in Chinese with English abstract).
Effect of low-temperature stress and gibberellin on seed germination and seedling physiological responses in peanut
CHANG Bo-Wen1,2,**, ZHONG Peng2,**, LIU Jie2,*, TANG Zhong-Hua3, GAO Ya-Bing2, YU Hong-Jiu2, and GUO Wei2
1Postdoctoral Research Station, Heilongjiang Academy of Agricultural Sciences, Harbin 150001, Heilongjiang, China;2Rural Energy Institute, Heilongjiang Academy of Agricultural Science, Harbin 150001, Heilongjiang, China;3Key Laboratory of Forest Plant Ecology Ministry of Education, Northeast Forestry University, Harbin 150001, Heilongjiang, China
From 30 peanut cultivars, we screened four cultivars with strong low-temperature-resistance (Fuhua 17, Fuhua 12, Jihua 16, Jihua 18) and four cultivars with weak low-temperature-resistance (Luhua 11, Baisha 1016, Zhengnongheihuasheng 1, Baiyu), and measured related indicators of seed germination and physiological indexes of seedlings under low temperature (4ºC) and GA3treatments. There was no significant difference in rate of emergence and germination index of strong low-temperature- resistant cultivars with or without 4ºC treatments, but decrease in hypocotyl length and seed vigor under low temperature. The relative membrane permeability and MDA content of four cultivars with weak low-temperature-resistance had higher ascensional range. The contents of soluble sugar, soluble protein and free proline of cultivars with strong low-temperature resistance had smaller reduction. GA3facilitated the rate of emergence and seed vigor of all peanut seeds, as well as promoted the contents of soluble sugar, soluble protein and free proline of seedlings, but suppressed the uptrend of relative membrane permeability and MDA content of peanut seedlings under low temperature. The best concentration of GA3promoting seed germination and seedling growth of peanut with low temperature treatment is 300 μmol L–1. The rate of emergence had significantly negative correlation with relative membrane permeability and MDA, and obviously positive correlation with the contents of soluble sugar or free proline. The temperature had greater influence on germination rate, but the effect of gibberellin on difference of germination rate between different varieties was smaller. This study provided a theoretical basis for germplasm resources innovation and breeding new peanut cultivars with strong low-temperature resistance, as well as for studying the physiological mechanism of gibberellin on chilling tolerance of different peanut varieties.
peanut; late spring chilling; low-temperature stress; gibberellin; seed germination; seedling physiological responses
2018-03-22;
2018-08-20;
2018-09-28.
10.3724/SP.J.1006.2019.84043
通信作者(Corresponding author): 刘杰, E-mail: liujie1677@126.com
**同等贡献(Contributed equally to this work)
E-mail: changbowen2005@163.com, Tel: 0451-86683588
本研究由黑龙江省农业科学院课题(2017BZ01), 哈尔滨市科技创新人才研究专项(2017RAQYJ135)和黑龙江省育繁推一体化项目资助。
This study was supported by the Program of Heilongjiang Academy of Agricultural Sciences (2017BZ01), Harbin Special Fund for Research of Innovative Talents of Science and Technology (2017RAQYJ135), and Heilongjiang Integration Program of “Breeding, Reproduction and Pushing”.
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180925.0930.002.html

