盐碱胁迫对海岛棉种子萌发及幼苗根系生长的影响
严青青 张巨松 李星星 王燕提
盐碱胁迫对海岛棉种子萌发及幼苗根系生长的影响
严青青 张巨松*李星星 王燕提
新疆农业大学农学院/ 教育部棉花工程研究中心, 新疆乌鲁木齐 830052
为明确海岛棉种子萌发及幼苗根系对盐胁迫的响应, 并筛选出耐盐能力较高的海岛棉品种。以新疆阿克苏地区主推海岛棉品种新海31号、新海35号、新海43号和新海48号为试材, 采用NaCl、Na2SO4以及NaCl、NaHCO3以物质的量1∶1混合分别模拟中性盐混合盐(中性盐)和碱性盐混合盐(碱性盐)两种盐类型, 胁迫处理总盐浓度(Na+)为0、120、180、240、300、360 mmol L–1, 研究了盐胁迫下海岛棉种子萌发和幼苗根系生长参数。结果表明, 在两种盐类型下, 随着盐浓度的增加, 海岛棉种子的萌发参数、生物量、根冠比、盐敏感指数、盐耐受指数、根系长度、根系表面积及根系体积均呈下降趋势; 高盐浓度下, 海岛棉株高、根系生物量及茎叶生物量与盐浓度呈显著负相关, 说明高盐环境抑制了棉种发芽及幼苗的正常生长。120 mmol L–1浓度下, 中性盐处理的新海48号的根系总长度比对照无显著增加, 其余品种均有显著增加, 各品种根系总体积与总表面积均无显著差异, 低盐促进了各品种细根(≤0.5 mm)的伸长及生长, 新海43号的中根(0.5<≤2.0 mm)长度比CK增加显著, 导致此品种根系的总体积与总表面积有显著增加; 碱性盐处理的根系总长度、表面积及体积除新海31号与对照差异不显著外, 其余品种均有显著降低。180~240 mmol L–1浓度下, 中性盐处理的根系总长度、表面积及体积与对照相比除新海43号有显著下降外, 各品种均差异不显著; 碱性盐处理的各品种均是下降显著, 其中新海35号的根系总长度下降幅度比其余品种缓慢。300~360 mmol L–1浓度下, 两种盐处理的各品种的根系总长度、体积与表面积均急剧下降。碱性盐胁迫比中性盐胁迫下降的趋势更为显著。本试验条件下, 海岛棉幼苗正常生长所能承受的盐浓度为240 mmol L–1, 但碱性盐对于海岛棉幼苗的伤害远大于中性盐, 供试品种耐盐碱程度为新海35号>新海43号>新海31号>新海48号。
中性盐; 碱性盐; 海岛棉; 种子萌发; 幼苗生长; 根系形态
新疆盐碱地多为复合型盐碱地, 盐碱成分主要有NaCl、Na2SO4、NaHCO3和Na2CO3, 盐化与碱化作用往往相伴发生, 同时由于不合理灌溉、过度使用化肥等原因使耕地次生盐碱化严重[1]。海岛棉(L.)是棉花的一个栽培种, 其品质优于陆地棉, 纤维长、细度高、强度大, 是我国重要的纺织品原料, 也是世界上最优良的棉纤维。新疆除了是我国重要的商品棉生产基地, 也是唯一的海岛棉产区, 海岛棉是一种较耐盐碱的作物, 对高盐环境敏感, 低盐能促进海岛棉种子萌发以及幼苗生长[2]。因此, 合理开发与利用新疆盐碱地区种植海岛棉对于我国优质纺织业的发展具有重要意义。
种子萌发期是植物生活史中对盐胁迫十分敏感的时期之一, 虽然根系是第一个暴露在盐胁迫下的器官, 但芽对盐胁迫比根系更敏感, 植物能否在盐环境中生存首先取决于它能否发芽[3], 其次是出苗后能否抵抗盐环境。大豆在90 mmol L–1浓度以下时中性盐处理会对其种子萌发、植株生物量起促进作用, 超过这个盐浓度则下降, 碱性盐则是直接抑制大豆种子的萌发[4-5]。不同作物的种子对盐的耐受性不一样, 甚至同一作物不同颜色种子耐受性(遗传特性)也不一样[6-7]。根系是最早感受逆境胁迫信号的器官, 土壤中盐碱对植物的危害最直接的受害部位是植物的根系, 植物根系存在着复杂的分支结构, 而不同茎级根系形态对养分积累、运移有不同的作用[8], 它在逆境下的分布特征和表现是植物有效吸收和利用土壤养分最直接的适应特征, 更大的根系土壤体积的形成可以提高作物本身的耐盐性[9], 因此, 根的生长发育状况和活力对植物的耐盐能力至关重要。海岛棉本身作为较耐盐的一种作物, 其耐盐的程度还尚未被系统地挖掘, 尤其对碱性盐的耐受性。目前, 国内外对植物盐碱胁迫做了大量的研究, 多集中在盐碱对植物地上部分的分布、生理特征的影响等方面[10-12], 对海岛棉的研究也多集中在中性盐胁迫上[13], 尤其是对混合盐碱胁迫未系统的进行研究。本研究从生产实际出发, 人工模拟盐碱胁迫环境, 研究海岛棉不同基因型种子萌发和根系生长特性, 明确盐碱胁迫对海岛棉种子萌发和根系生长影响的过程, 为新疆地区海岛棉幼苗耐盐碱栽培提供理论依据。
1 材料与方法
1.1 试验设计
试验于2017年4月至8月在新疆农业大学教育部棉花工程研究中心棉花生理室进行。供试棉花品种为海岛棉(学名)品种新海31号(XH31)、新海35号(XH35)、新海43号(XH43)和新海48号(XH48), 由新疆农业科学院经济作物研究所提供。采用NaCl、Na2SO4以及NaCl、NaHCO3以物质的量比1∶1混合分别模拟中性盐和碱性盐两种盐类型, 设胁迫处理总盐浓度为0、120、180、240、300、360 mmol L–1。
精选饱满、大小一致的种子, 采用HgCl2(0.1%)浸泡消毒10 min, 自来水冲净, 蒸馏水冲洗5次, 最后用蒸馏水浸种24 h; 使用鼓风干燥箱在120℃下对沙子进行高温灭菌24 h。使用规格为13 cm×19 cm×12 cm的发芽盒, 每个发芽盒平铺600 g的沙子, 每100 g沙子加对应浓度的盐水17 mL, 对照加17 mL蒸馏水。选择浸种后露白一致的种子平整放入发芽盒中, 每盒50粒种子, 均匀播于湿沙上, 加盖5 mm湿沙, 每个处理播3盒, 重复3次。盖上发芽盒盖子, 防止水分蒸发。置光照培养室内, 白天温度(25±2)℃, 光强400 µmol m–1s–1, 12 h; 夜间温度(22±2)℃, 12 h, 相对湿度70%~75%。
1.2 测定项目与方法
1.2.1 种子萌发参数 播种后, 每天20:00— 22:00统计种子发芽数。播种后第4天统计种子发芽数, 发芽种子数/供试种子数×100%即为发芽势。播种后第10天统计种子发芽数, 发芽标准为芽长达种子长度的1/2。发芽种子数/供试种子数×100%即为发芽率。发芽指数(GI) = ∑(Gt/Dt), 式中, Gt为在不同时间的发芽数, Dt为发芽天数。
1.2.2 棉株生长及根系形态 播种后第10天, 将棉株和根系用自来水冲洗干净, 用直尺测量基质表面至生长点的长度, 即为株高。用Scan Wizard EZ扫描仪扫描, 用万深LA-S根系分析系统分析根长、表面积、体积以及不同径级根长形态学参数。根系形态分析完成以后, 将棉株分成根、茎叶两部分, 于105℃干燥箱中杀青20 min, 80℃烘干至恒重, 分别称量根系和茎叶生物量。重复3次, 每10株幼苗期的平均值表示1次重复。
1.2.3 盐敏感指数(SSI)和盐耐受指数(STI) SSI = [(DWNaCl–DWcontrol)/DWcontrol]×100, STI = (DWNaCl/ DWcontrol)×100, 式中DWNaCl表示盐处理下根干重, DWcontrol表示对照根干重[14]。
1.3 数据处理
采用SPSS19.0计算软件分析数据, 采用新复极差法进行差异显著性检验(<0.05), 采用Microsoft Excel 2010软件整理数据和绘制图表。
2 结果与分析
2.1 盐碱胁迫对不同海岛棉种子萌发的影响
由图1、图2、图3可知, 在中性盐和碱性盐胁迫下, 随着盐浓度的增加, 海岛棉品种萌发参数均呈下降趋势, 当浓度为300 mmol L–1及更大时, 海岛棉品种的发芽率、发芽势及发芽指数极低, 甚至种子死亡。以发芽率为例, 与对照相比, 中性盐120、180、240 mmol L–1浓度下, XH31降低了10.0%、24.0%、45.3%, XH35降低了4.6%、10.6%、26.8%, XH43降低了7.0%、17.0%、39.0%, XH48降低了11.0%、27.0%、51.4%。碱性盐下, XH31降低了19.6%、47.3%、70.0%, XH35降低了8.6%、21.3%、46.0%, XH43降低了11.0%、28.4%、41.4%, XH48降低了20.0%、48.7%、80.7%。综上, 各品种的发芽率均随着盐浓度的增大而降低, 高盐浓度降低土壤水分渗透压, 阻碍了种子吸收水分, 导致种子内部失水。XH48的发芽率、发芽势、发芽指数为0~240 mmol L–1时, 在中性盐和碱性盐胁迫下降低幅度最大, 说明XH48品种受盐碱的影响最大, 即对盐更敏感; XH35下降幅度小, 说明受盐碱影响小, 即较耐盐; 碱性盐对海岛棉种子萌发的影响大于中性盐。
2.2 盐碱胁迫对海岛棉植株生长和干物质积累的影响
由图4、图5和表1可以看出, 中性盐与碱性盐胁迫下, 盐浓度与株高、根干重有显著的负相关, 盐浓度与茎叶干重不存在显著的线性相关。以株高和根干重为例, 中性盐下XH31、XH35、XH43和XH48株高的斜率分别为0.030、0.035、0.030、0.024, 根干重斜率分别为0.024、0.026、0.025、0.024, 碱性盐株高斜率分别为0.036、0.042、0.031、0.035, 根干重斜率分别为0.034、0.040、0.035、0.031; 斜率越大下降的越快, XH35虽然斜率大但其株高、根干重积累量一直保持最高水平, XH48斜率下降最缓,但其株高、根干重积累量一直保持最低水平; 株高、根干重的斜率碱性盐大于中性盐, 即碱性盐比中性盐对海岛棉的生长发育影响更大; XH48受盐碱的影响最大, 即对盐更敏感, XH35受盐碱的影响最小, 即较耐盐。图5中根冠比随着盐碱胁迫浓度的增大呈下降趋势, 由图4回归分析可知, 茎叶干重波动范围较小, 根干重的下降导致根冠比的下降, 表明盐碱胁迫浓度的增加降低了根系生物量。不同品种间表现为XH48对盐碱胁迫浓度更为敏感, XH35表现较强的耐盐碱性。
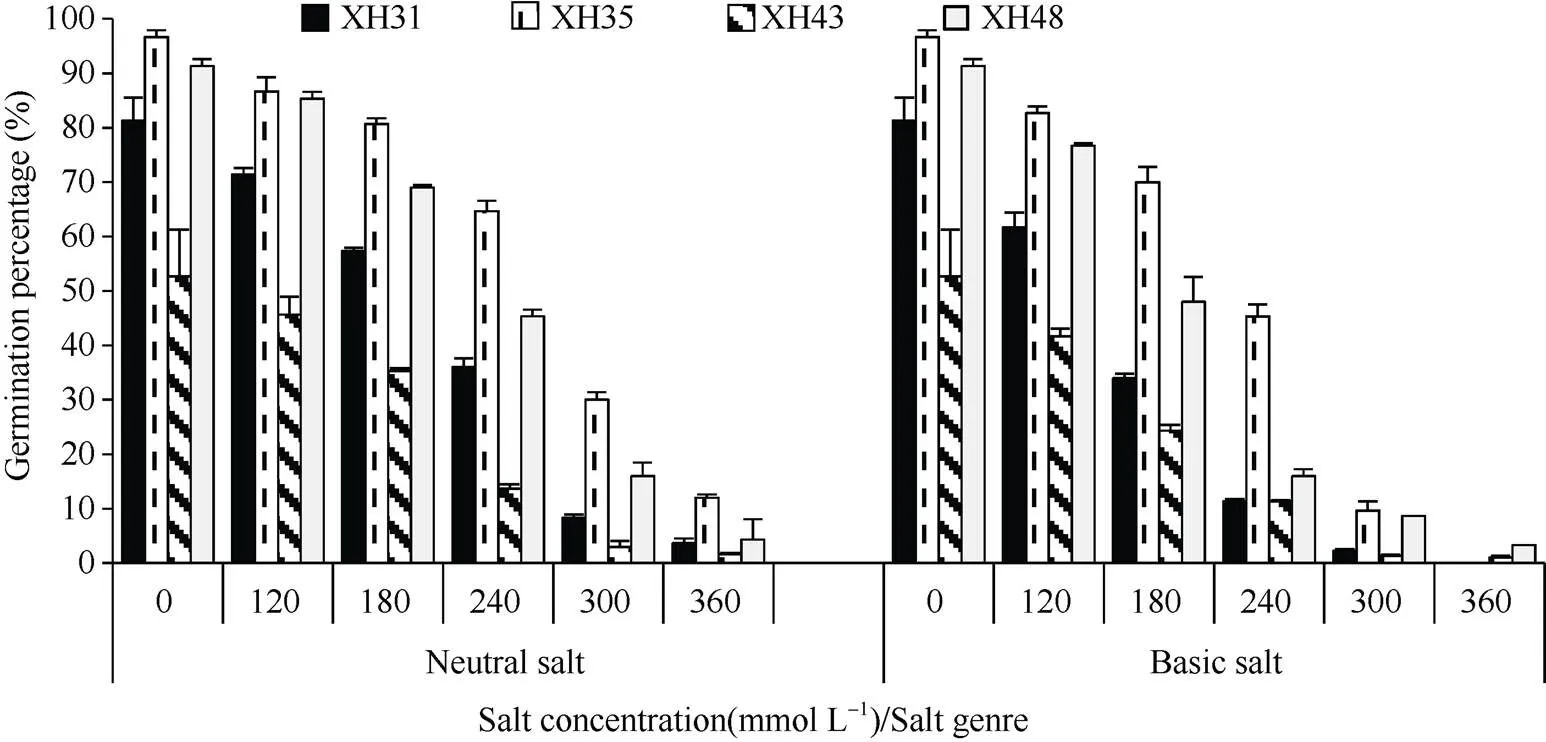
图1 盐碱胁迫对海岛棉种子发芽率的影响
XH31: 新海31号; XH35: 新海35号; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

图2 盐碱胁迫对海岛棉种子发芽势的影响
XH31: 新海31号; XH35: 新海35号; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

图3 盐碱胁迫对海岛棉种子发芽指数的影响
XH31: 新海31号; XH35: 新海35号 ; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

(图4)
XH31: 新海31号; XH35: 新海35号; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

图5 盐碱胁迫对海岛棉幼苗根冠比的影响
XH31: 新海31号; XH35: 新海35号 ; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

表1 盐碱浓度(x, mmol L–1)与海岛棉株高、根干重及茎叶干重的特征分析
(续表1)

性状Trait (y)盐类型Salt genre品种Variety回归方程Regression equationR2 碱性盐Basic saltXH31y = –0.034x+13.00.91** XH35y = –0.040x+17.10.89** XH43y = –0.035x+13.80.89** XH48y = –0.031x+11.00.95** 茎、叶干重Stem and leaf dry weight (mg)中性盐Neutral saltXH31y = –0.026x+67.00.24** XH35y = –0.022x+64.20.33** XH43y = –0.015x+63.10.09 XH48y = –0.035x+63.80.37** 碱性盐Basic saltXH31y = –0.110x+76.80.23* XH35y = –0.019x+59.90.06 XH43y = –0.003x+62.50.01 XH48y = –0.119x+78.10.29**
**<0.01,*<0.05. XH31: 新海31号; XH35: 新海35号 ; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.
2.3 盐碱胁迫对海岛棉盐敏感指数和盐耐受指数的影响
由图6和图7可知, 随着盐浓度的增大, 耐盐指数和盐敏感指数均呈下降趋势, 碱性盐下降趋势更为显著。在盐浓度为120 mmol L–1时, XH43海岛棉的耐盐指数和盐敏感指数呈现一个上升的趋势, 表明此浓度促进了XH43根系生物量的积累, 这与根系形态结构指标一致。当浓度大于120 mmol L–1时, 各品种的盐敏感和耐盐指数明显下降, 说明高浓度盐下, 各品种的敏感性增加, 耐盐性相应降低; 这时XH35的耐盐性比其他3个品种高, 耐盐性最低的是XH48。

图6 盐碱胁迫对海岛棉根系盐敏感指数的影响
XH31: 新海31号; XH35: 新海35号; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.

图7 盐碱胁迫对海岛棉根系盐耐受指数的影响
XH31: 新海31号; XH35: 新海35号; XH43: 新海43号; XH48: 新海48号。
XH31: Xinhai 31; XH35: Xinhai 35; XH43: Xinhai 43; XH48: Xinhai 48.
2.4 盐碱胁迫对不同海岛棉根系形态的影响
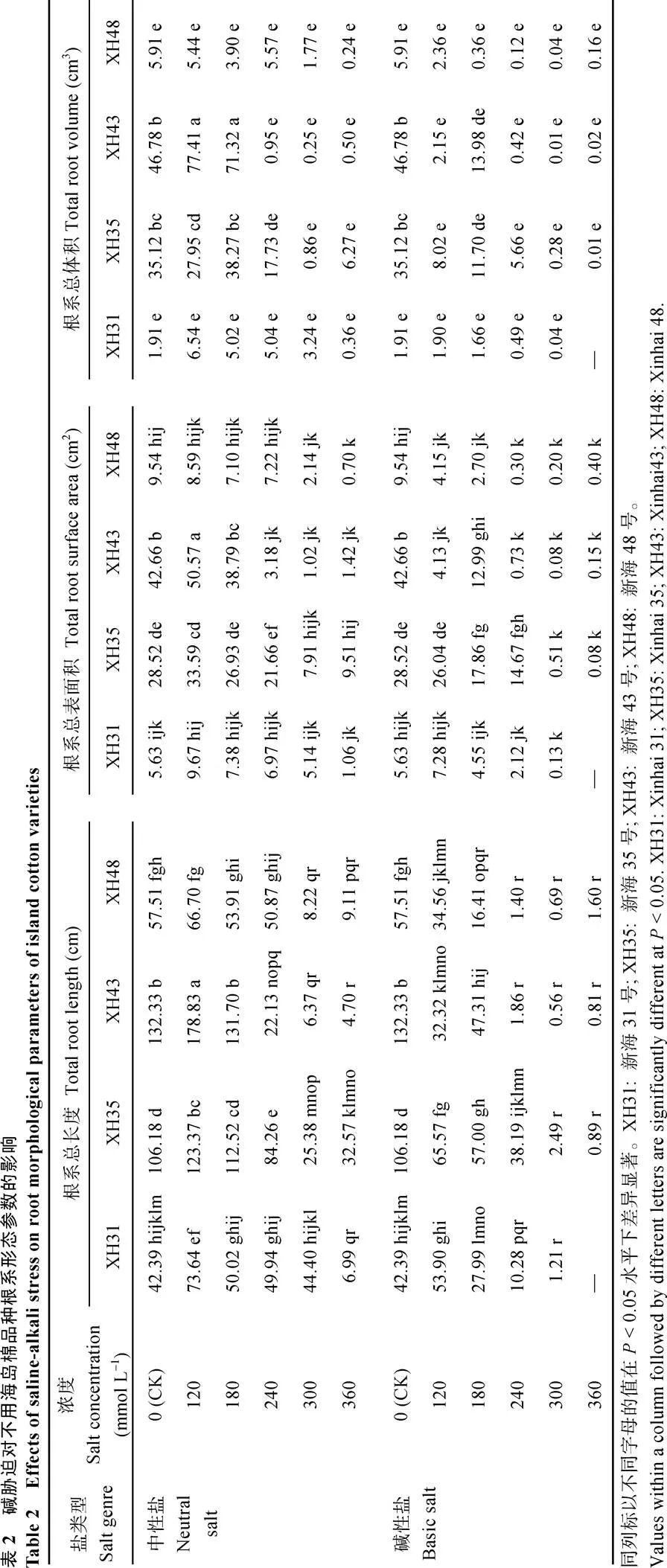
由表2可以看出, 各品种在盐碱环境下随着盐浓度的增大根系总长度(L)、根系总表面积(SA)、根系总体积(V)均呈显著下降趋势, 从表3可看出, 随着盐浓度的增大各级根系的根长均显著下降, 尤其是高盐浓度下, 这是导致总根长等下降的原因。与对照相比, XH31、XH35、XH43在120 mmol L–1中性盐浓度下根系L、SA、V均有显著水平的提高, XH48增加不显著, 在180 mmol L–1盐浓度下各品种影响不显著。这说明120 mmol L–1的盐浓度促进了各品种根系的伸长, 同时促进了细根(≤ 0.5 mm)的伸长, XH31、XH35及XH48在120 mmol L–1下的细根长度显著增加, 但是相应地减少了中根(0.5 <≤ 2.0 mm)和粗根(> 2.0 mm)的比例, 致使各品种的根系总表面积及根系总体积的减少, 这可能也是导致根干重下降的原因, 同时细根的伸长也说明低浓度的盐对于幼苗根系生长有促进作用。同一盐浓度下XH43的L、SA、V最高, 但是种子发芽率却最低, 说明XH43的萌发期抵御盐环境的能力较弱。碱性盐下, 与对照相比各品种L、SA、V显著下降, 只有XH31的L、SA无显著增加。120 mmol L–1下只有中性盐促进作物根系生长。各品种在相同浓度下, 碱性盐的L、SA、V均小于中性盐的, 与发芽、生物量一致, 碱性盐对海岛棉种子、幼苗期的影响远大于中性盐。盐浓度为240~360 mmol L–1时, 除XH31的根系长度在中性盐240 mmol L–1时与对照无显著差异外, 其余各品种的根系长度、根表面积及根体积均急剧下降, 尤其是碱性盐胁迫下, 根系生长受到严重的阻碍, 说明240 mmol L–1已经是海岛棉幼苗期根系正常生长所能承受的最大盐浓度。
3 讨论
3.1 盐胁迫对不同海岛棉种子萌发的影响
种子萌发是作物生命的开始, 是作物生长的第一个阶段, 种子内部的激素控制着种子的萌发, 例如乙烯和赤霉素破坏种皮打破种子休眠促进种子萌发, 而盐胁迫会破坏种子内部激素的合成及渗透势, 导致种子不能正常萌发[15-18]。本研究表明, 海岛棉种子发芽率、发芽势、发芽指数在高浓度盐胁迫下均随两种盐胁迫浓度的升高呈降低的趋势, 高盐环境下细胞失水, 细胞壁遭到破坏, 且不能从外界吸收足够的水分来合成萌发所需的各种酶和结构蛋白,难以完成细胞分裂分化、胚的生长; 碱性盐胁迫下的降低趋势更为明显, 与前人研究结果相一致[2,5,19]。碱性盐胁迫不仅造成渗透胁迫、离子毒害, 在此基础上还涉及高pH值胁迫, 以及对土壤的影响, 如对土壤理化性状、矿质元素以及微生物的严重损害等, 致使根、芽生长速率显著降低[20]。XH35的发芽率、发芽势、发芽指数始终最大, 盐胁迫下保持相对较高的种子活力。由各品种下降幅度看, 各品种萌发时受到的抑制程度不同, 说明种子本身抵御盐胁迫环境的能力有强有弱, XH48发芽率、发芽势、发芽指数下降幅度大, 较敏感; XH35下降幅度较缓, 较耐盐。
3.2 盐胁迫对不同海岛棉幼苗生长及根系生物量的影响
作物幼苗期阶段的真叶未完全伸展, 叶面积比较小, 捕获光的能力弱, 导致光合能力小, 根系是植物幼苗期主要的营养物质吸收、传送的器官, 根系的粗细、长度、面积均能影响根系为幼苗期传送营养物质, 与地上部相比, 生产相同单位干物质量需要的能量是地上部的两倍, 表明根系生长更能消耗作物本身的能量。中性盐下各品种的根干重回归线的斜率无明显差异, 有可能是中性盐对各品种造成的伤害单一, 除了离子毒害就是渗透胁迫[21], 各品种对盐的适应性可能一样, 但是耐受性不一样, 所以值不一样, 斜率却一样。高盐浓度下, 海岛棉幼苗期的株高、根冠比随着两种盐胁迫的浓度增大而降低, 这与于天一等[22]的研究结果一致, 却与张华新等[23]的研究结果相反, 本试验根冠比的降低可能是因为根系干重下降的程度比茎叶下降程度大。根系比茎叶对盐更敏感[24], 海岛棉减少了生物量在根系的分配, 从而减少了对盐分的吸收, 同时降低了与茎叶对光合能量的竞争, 更有利于茎叶生长, 但是幼苗期的茎叶主要靠根系输送土壤里的营养维持生长, 茎叶生物量的缓慢下降, 一方面可能是茎叶受到了盐害, 另一方面可能是营养物质的匮乏。但高盐浓度下海岛棉其他生育时期对植株生物量如何分配, 还需在大田进一步验证。
3.3 盐胁迫对不同海岛棉品种幼苗根系形态的影响
根系是作物与土壤的媒介, 土壤中的营养物质与水分全靠根系输送到植株, 细根的功能主要是吸收营养, 粗根的功能主要是运输养分并让植株稳定在土壤中。低浓度的盐对各品种的幼苗期细根伸长有促进作用, 这有可能是通过减小根系直径, 增加根系长度的方式更大范围和更大面积地吸收水分和养分供其生长。但是, 高盐浓度下, 4个海岛棉品种根的总长度、总面积和总体积下降显著, 说明根的生长受到明显的抑制, 这与黄瓜的研究报道基本一致[25]。碱性盐胁迫下, 根系的总长度、总表面积及总体积下降比中性盐胁迫下快, 这与种子萌发指数一致, 本研究发现碱性盐胁迫下的根部有腐烂变黑的现象, 这与张晓磊等[26]的研究结果一致。高盐胁迫破坏了土壤的微生物及植物根系内部电导率、Na+/K+、抗氧化酶活性、线粒体功能等[27–29], 造成根系内部系统的功能紊乱及根系外部形态的变化。本试验还需在不同盐浓度及盐类型下对海岛棉幼苗根系的生理生化特性的变化做进一步详细的研究。
4 结论
在两种盐胁迫下, 4个海岛棉品种种子萌发及根系生长均受到抑制, 但是新海35号表现最好, 萌发指数与耐盐受指数均比其他品种高, 其次是新海31号和新海43号, 最后是新海48号。各品种正常生长所能承受的最大盐浓度为240 mmol L–1, 超过此浓度, 各品种的存活率极低甚至死亡。新海43号虽然根系比较发达, 但是株高及发芽率等较低, 即种子萌发对盐敏感。本试验条件下, 海岛棉幼苗的根系比茎叶对盐碱更敏感。4个品种中, 新海35始终保持着较长的根系, 有足够的营养, 这也是新海35号株高保持较高水平的原因, 较耐盐, 而新海48号较敏感。
[1] 陈镭, 侯东升, 郭玲玲, 司爱军, 邓福军. 新疆盐碱地形成特点及改良措施. 新疆农垦科技, 2009, 32(5): 56–57. Chen L, Hou D S, Guo L L, Si A J, Deng F J. Formation characteristics and improvement measures of saline and alkaline land in Xinjiang., 2009, 32(5): 56–57 (in Chinese).
[2] 杨淑萍, 危常州, 梁永超. 盐胁迫对海岛棉不同基因型幼苗生长及生理生态特征的影响. 生态学报, 2010, 30: 2322–2331. Yang S P, Wei C Z, Liang Y C. Effects of NaCl stress on growth and eco-physiological characteristics of different in sea island cotton genotypes in seedlings., 2010, 30: 2322–2331 (in Chinese with English abstract).
[3] Farooq M, Hussain M, Wakeel A, Siddique K H M. Salt stress in maize: effects, resistance mechanisms, and management: a review., 2015, 35: 461–481.
[4] 王永娟, 周妍, 徐明, 徐靖宇, 金晓飞, 石连旋. 盐胁迫对大豆种子萌发及矿质元素变化的影响. 生态学杂志, 2015, 34: 1565–1571. Wang Y J, Zhou Y, Xu M, Xu J Y, Jin X F, Shi L X. Germination parameters and mineral levels in soybean plants under salt stress., 2015, 34: 1565–1571 (in Chinese with English abstract).
[5] 周妍. 盐胁迫对大豆种子萌发、离子平衡及可溶性糖含量影响的研究. 东北师范大学硕士学位论文, 吉林长春, 2014. Zhou Y. Research on Germination, Ionic Balance and Soluble Sugars Contention ofunder Saline Stress. MS Thesis of Northeast Normal University, Changchun, Jilin, China, 2014 (in Chinese with English abstract).
[6] Harfi M E, Hanine H, Rizki H, Latrache H, Nabloussi A. Effect of drought and salt stresses on germination and early seedling growth of different color-seeds of sesame (L.)., 2016, 18: 1088–1094.
[7] Bahrami H, Razmjoo J. Effect of salinity stress (NaCl) on germination and early seedling growth of ten sesame cultivars (L.)., 2012, 2: 546–549.
[8] McCormack M L, Dickie I A, Eissenstat D M, Fahey T J, Fernandez C W, Guo D L, Helmisaari H S, Hobbie E A, Iversen C M, Jackson R B, Leppalammi-Kujansuu J, Norby R J, Phillips R P, Pregitzer K S, Pritchard S G, Rewald B, Zadworny M. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes., 2015, 207: 505–518.
[9] Schleiff U. Conceptual approach to lateral salinity gradients around roots of salt-sensitive and salt-tolerant crops under irrigation conditions., 2011, 14: 35–38.
[10] 刘正祥, 张华新, 杨秀艳, 刘涛, 狄文彬. NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性. 生态学报, 2014, 34: 326–336. Liu Z X, Zhang H X, Yang X Y, Liu T, Di W B. Growth, and cationic absorption, transportation and allocation of Elaeagnus angustifolia seedlings under NaCl stress., 2014, 34: 326–336 (in Chinese with English abstract).
[11] Qados A M S A. Effect of salt stress on plant growth and metabolism of bean plant(L.)., 2011, 10: 7–15.
[12] Lu Y, Lei J Q, Zeng F J, Zhang B, Liu G J, Liu B. Effect of NaCl-induced changes in growth, photosynthetic characteristics, water status and enzymatic antioxidant system ofseedlings., 2016, 55: 96–100.
[13] 杨淑萍, 危常州, 梁永超. 盐胁迫对不同基因型海岛棉种子萌发特性的影响. 中国棉花, 2012, 39(12): 6–10. Yang S P, Wei C Z, Liang Y C. Effects of NaCl stress on characteristics of seed germination of sea island cotton with different genotypes., 2012, 39(12): 6–10 (in Chinese).
[14] 王树凤, 胡韵雪, 孙海菁, 施翔, 潘红伟, 陈益泰. 盐胁迫对2种栎树苗期生长和根系生长发育的影响. 生态学报, 2014, 34: 1021–1029. Wang S F, Hu Y X, Sun H J, Shi X, Pan H W, Chen Y T. Effects of salt stress on growth and root development of two oak seedlings., 2014, 34: 1021–1029 (in Chinese with English abstract).
[15] Duan D. Effects of salt and water stress on the germination ofL. seed., 2005, 36: 793–800.
[16] Ibrahim D. Effect of salt and osmotic stresses on the germination of pepper seeds of different maturation stages., 2008, 51: 897–902.
[17] Byrt C S, Munns R, Burton R A, Gilliham M, Wege S. Root cell wall solutions for crop plants in saline soils., 2018, 269: 47–55.
[18] Llanes A, Andrade A, Masciarelli O, Alemano S, Luna V. Drought and salinity alter endogenous hormonal profiles at the seed germination phase., 2016, 26: 1–13.
[19] 郭剑, 李彩凤, 刘磊, 桑利敏, 陈明, 徐影, 盖志佳, 王玉波. Na2CO3胁迫下甜菜幼苗根际壤环境因子的变化及其相关性. 应用生态学报, 2016, 27: 904–910. Guo J, Li C F, Liu L, Sang L M, Chen M, Xu Y, Gai Z J, Wang Y B. Variation of rhizosphere environmental factors of sugarbeet seedlings under Na2CO3stress and their correlation., 2016, 27: 904–910 (in Chinese with English abstract).
[20] Guo W Q, Zhang P T, Li C H, Yin J M, Han X Y. Recovery of root growth and physiological characters in cotton after salt stress relief., 2015, 75: 85–91.
[21] 王佺珍, 刘倩, 高娅妮, 柳旭. 植物对盐碱胁迫的响应机制研究进展. 生态学报, 2017, 37: 5565–5577. Wang Q Z, Liu Q, Gao Y N, Liu X. Review on the mechanisms of the response to salinity-alkalinity stress in plants., 2017, 37: 5565–5577 (in Chinese with English abstract).
[22] 于天一, 王春晓, 孙学武, 孙秀山, 郑永美, 吴正锋, 沈浦, 王才斌. 碱胁迫对花生幼苗根系形态及干物质累积的影响. 中国油料作物学报, 2017, 39(2): 190–196. Yu T Y, Wang C X, Sun X W, Sun X S, Zheng Y M, Wu Z F, Shen P, Wang C B. Effects of alkaline stress on root morphology and dry matter accumulation characteristics of peanut seedling., 2017, 39(2): 190–196 (in Chinese with English abstract).
[23] 张华新, 刘正祥, 刘秋芳. 盐胁迫下树种芽苗期生长及其耐盐性. 生态学报, 2009, 29: 2263–2271. Zhang H X, Liu Z X, Liu Q F. Seedling growth and salt tolerance of tree species under NaCl stress., 2009, 29: 2263–2271 (in Chinese with English abstract).
[24] Mai W X, Tian C Y, Li L. Localized salt accumulation: the main reason for cotton root length decrease during advanced growth stages under drip irrigation with mulch film in a saline soil., 2014, 6: 361–370.
[25] 段九菊, 郭世荣, 康云艳, 李璟, 刘香娥. 盐胁迫对黄瓜芽苗期根系生长和多胺代谢的影响. 应用生态学报, 2008, 19: 57–64.Duan J J, Guo S R, Kang Y Y, Li J, Liu X E. Effects of salt stress on cucumber seedling root growth and polyamine metabolism., 2008, 19: 57–64 (in Chinese with English abstract).
[26] 张晓磊, 刘晓静, 齐敏兴, 刘艳楠, 蒯佳林. 混合盐碱对紫花苜蓿苗期根系特征的影响. 中国生态农业学报, 2013, 21: 340–346. Zhang X L, Liu X J, Qi M X, Liu Y N, Kuai J L. Alfalfa seeding root characteristics under complex saline-alkali stress., 2013, 21: 340–346 (in Chinese with English abstract).
[27] 刘新伟, 王巧兰, 段碧辉, 林亚蒙, 赵小虎, 胡承孝, 赵竹青. 亚硒酸盐对油菜幼苗硒吸收、根系形态及生理指标的影响. 应用生态学报, 2015, 26: 2050–2056. Liu X W, Wang Q L, Duan B H, Lin Y M, Zhao X H, Hu C X, Zhao Z Q. Effects of selenite addition on selenium absorption, root morphology and physiological characteristics of rape seedlings., 2015, 26: 2050–2056 (in Chinese with English abstract).
[28] 潘雄波, 向丽霞, 胡晓辉, 任文奇, 张丽, 倪新欣. 外源亚精胺对盐碱胁迫下番茄幼苗根系线粒体功能的影响. 应用生态学报, 2016, 27: 491–498. Pan X B, Xiang L X, Hu X H, Ren W Q, Zhang L, Ni X X. Effects of exogenous spermidine on mitochondrial function of tomato seedling roots under salinity-alkalinity stress., 2016, 27: 491–498 (in Chinese with English abstract).
[29] Guo P, Wei H X, Zhang W J, Bao Y J. Physiological responses of alfalfa to high-level salt stress: root ion flux and stomatal characteristics., 2016, 18: 125–133.
Effects of salinity stress on seed germination and root growth of seedlings in island cotton
YAN Qing-Qing, ZHANG Ju-Song*, LI Xing-Xing, and WANG Yan-Ti
Agriculture College, Xinjiang Agricultural University / Research Center of Cotton Engineering, Urumqi 830052, Xinjiang, China
In order to determine the response of seed germination and seedling root system of island cotton to salt stress, and to screen out island cotton varieties with high salt tolerance, an experiment was conducted using main sea island cotton varieties Xinhai 31, Xinhai 35, Xinhai 43, and Xinhai 48 grown in Xinxiang Aksu area, with treatment of neutral salt (neutral salt) mixed with NaCl, Na2SO4at 1:1 of mole ratio and treatment of alkali salt (alkaline salt) mixed with NaCl and NaHCO3at 1:1 of mole ratio, Total salt concentration (Na+) was 0, 120, 180, 240, 300, and 360 mmol L–1. Seed germination and seedling root growth parameters of island cotton under the stress were measured. The germination parameters, biomass, root and crown ratio, salt sensitivity index, salt tolerance index, root length, root surface area and root volume of the island cotton seeds decreased with the increase of salt concentration. Moreover, under high salt concentration, there was a significant negative correlation of plant height, root biomass, stem and leaf biomass with salt concentration, indicating that high salt environment inhibited cotton seed germination and normal growth of seedlings. Under the concentration of 120 mmol L–1, the total length of the root system of Xinhai 48 treated with neutral salt did not increase significantly compared with that of the control group, while that of the other varieties increased significantly. There was no significant difference in the total volume and total surface area of the roots. The low salt concentration promoted the elongation and growth of the fine roots (≤ 0.5 mm). The middle root (0.5 <≤ 2.0 mm) of Xinhai 43 increased significantly than that of CK, resulting in a significant increase in total root volume and total surface area. The total length, surface area, and volume in alkaline salt treatment were not significantly different from those of Xinhai 31 and the control, while decreased significantly in other varieties. At the concentration of 180–240 mmol L–1, the total length, surface area and volume of roots in neutral salt treatment had a significant decrease compared with these of the control except for Xinhai 43; there was no significant difference among all varieties; lot a decrease in alkaline salt treatment. Among them, the total length of the roots of Xinhai 35 decreased more slowly than that of other varieties. At the concentration of 300–360 mmol L–1, the total root length, volume and surface area of the two salt varieties dropped sharply. The alkaline salt stress had a more significant decrease effect than the neutral salt stress. Under the conditions of this experiment, the normal growth of island cotton seedlings could withstand the salt concentration of 240 mmol L–1, but the damage of alkaline salt to island cotton seedlings was much greater than that of neutral salt. The order of salt tolerance of the tested varieties was Xinhai 35, Xinhai 43, Xinhai 31, and Xinhai 48.
neutral salt; basic salt; island cotton; seed germination; seedling growth; root morphology
): 2018-05-11;
2018-08-20;
2018-09-27.
10.3724/SP.J.1006.2019.84067
通信作者(Corresponding author): 张巨松, E-mail: xjndzjs@163.com
E-mail: 1359055572@qq.com
本研究由国家重点研发计划项目(2017YFD0101605-05)资助。
This study was supported by the National Key Research and Development Program of China (2017YFD0101605-05).
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20180921.1811.008.html

