水稻圆粒基因RS的鉴定和定位
陈雅萍 缪 荣 刘 喜 陈本佳 兰 杰 马腾飞 王益华 刘世家 江 玲
水稻圆粒基因的鉴定和定位
陈雅萍 缪 荣 刘 喜 陈本佳 兰 杰 马腾飞 王益华 刘世家 江 玲*
南京农业大学作物遗传与种质创新国家重点实验室/ 江苏省植物基因工程技术研究中心, 江苏南京 210095
阐明水稻籽粒大小相关基因的遗传和分子机制对水稻产量形成具有重要意义。利用甲基磺酸乙酯(ethyl methanesulfonate, EMS)诱变粳稻品种“宁粳3号”筛选获得圆粒突变体()。遗传分析表明, 突变体圆粒表型由单隐性核基因控制。颖壳扫描电镜观察发现,籽粒变圆主要是细胞数目改变导致的。在突变体中, 细胞周期相关基因的表达较野生型显著升高。将定位在第3染色体短臂标记RM3413与N3-5之间, 物理距离约589 kb。突变影响BR信号途径, 改变了粒型相关基因的表达。本研究有助于阐明水稻籽粒发育的分子机制。
水稻; 圆粒突变体; 表型分析; 基因定位
水稻产量是一个复杂的性状, 与单株穗数、每穗粒数及粒重等有关, 而粒重与粒长、粒宽、粒厚等相关。所以, 优化籽粒形状对提高水稻产量至关重要[1]。
参与水稻粒型大小的调控途径众多, 如植物激素、泛素化蛋白酶体途径、G-蛋白信号、表观遗传学途径等。粒长粒重主效基因对粒重起负调控作用[2];编码一个环型E3泛素连接酶, 位于细胞质中将其底物锚定到蛋白酶体进行降解, 可负调节细胞的分裂[3];通过促进细胞分裂和细胞膨大调控籽粒大小[4]; 非洲稻通过调控外颖和内颖纵向细胞的伸长控制非洲栽培稻的粒长, 同时也能调控种子落粒性[5];位点上17.1-kb的串联重复引起表达水平上调, 并下调邻近负调因子表达, 从而增加水稻粒长并改善稻米外观品质[6];编码一个丝氨酸羧肽酶, 正向调控水稻籽粒大小, 高表达形成更大的籽粒[7]; HGW作为一个重要的上游调控蛋白促进抽穗和粒重相关基因的表达, 很可能直接通过控制水稻籽粒的重量[8];编码早期籽粒灌浆过程中碳分配所需的细胞壁转化酶,编码吲哚-3-乙酸(IAA)-葡萄糖水解酶, 影响胚乳合胞体向细胞期的转变, 二者都调节灌浆过程中的源-库关系, 从而影响最终的粒重[9-10];基因座上的等位基因变异是其启动子中的10 bp缺失, 显著降低了基因的表达水平并因此降低了谷粒宽度[11];编码一个钙调素结合蛋白, 与糖原合酶激酶GSK2互作并抑制GSK2激酶活性。GW5抑制GSK2的自磷酸化及GSK2对OsBZR1和DLT的磷酸化, 影响细胞核中未磷酸化的OsBZR1和DLT蛋白的积累, 从而调节油菜素内酯响应基因的表达[12]。水稻粒型基因中除与粒型相关的主效QTL外, 还有许多与作物的生长发育及激素传导相关的基因也影响粒型, 如、、、、等[13-17]。
本研究利用EMS诱变“宁粳3号”筛选到一个籽粒变圆且稳定遗传的突变体()。从表型、生理特性、遗传方式等方面对鉴定, 明确了其遗传特性, 并对突变基因进行了精细定位。对的研究有利于进一步加深人们对水稻粒型调控机制的认识, 为完善水稻粒型的调控网络奠定基础。
1 材料与方法
1.1 材料
利用与“宁粳3号”杂交构建遗传分析群体, 对F1和F2植株进行表型观察与统计。以与“滇粳优”杂交构建F2遗传分离群体, 用于基因定位。
1.2 突变体表型考察
将野生型和在同一时期种植于南京农业大学土桥实验基地。在成熟期分别测定野生型和的株高、穗长、分蘖数等主要农艺性状。利用万深SC-G自动考种分析仪测定粒长、粒宽、千粒重, 重复3次, 随机取20个单株测定株高等农艺性状。
1.3 颖壳扫描电镜观察
取野生型和抽穗后的颖壳, 将其固定在2.5%戊二醛溶液中, 抽真空1 h, 室温避光放置48 h, 而后利用扫描电镜(S-3000N, Hitachi, Tokyo, Japan)观察颖壳外表皮细胞。
1.4 基因定位
成熟期从与“滇粳优”构建的F2群体中选取与突变体粒型一致的极端个体220株, 采用CTAB法提取叶片DNA, 用于基因型分析。从实验室已有的分子标记中, 筛选突变体与“滇粳优”之间有多态性的标记, 最终筛选到均匀分布于12条染色体的有多态性标记256对。利用F2群体中的10个极端个体进行基因型和表型连锁分析, 确定与目的基因连锁的分子标记, 再进一步扩大极端个体数量进行精细定位。精细定位引物序列见表1。

表1 用于精细定位的分子标记
1.5 油菜素内酯(BR)处理
选取野生型和的饱满种子各100粒, 经浸种与催芽, 选发芽一致的播种, 在30℃培养箱中培养10 d, 培养条件为14 h光照/10 h黑暗, 待小苗长至三叶期后, 剪取包含第二叶的叶片、叶枕和叶鞘的2 cm区段于不同浓度梯度(0、0.1、1.0 μmol L–1)的BR溶液中浸泡, 在光照条件下30℃处理2 d后, 用量角器测量叶夹角, 并照相。
1.6 qRT-PCR分析
用总RNA提取试剂盒(康为世纪生物科技有限公司)提取和野生型幼苗叶片的总RNA, 用DU800分光光度计检测RNA的浓度及质量, 用琼脂糖凝胶电泳检测RNA的完整性。取2 μg RNA作模板, 用SuperScript II Kit试剂盒(TaKaRa公司)反转录合成cDNA。利用qRT-PCR分析及野生型中粒型相关基因、细胞周期相关基因、油菜素内酯合成和信号途径相关基因的表达水平。以()为内参基因, 扩增反应在 7900HT Real-time PCR仪(Applied Biosystems)进行。10 μL实时荧光定量PCR体系含cDNA模板2 μL、2× SYBRSelect Master Mix (TOYOBO) 5 μL、正反引物(10 μmol L–1)各0.3 μL, ddH2O补足10 μL。Real-time PCR程序为90℃反应30 s, 95℃反应5 s, 60℃反应34 s, 40个循环。待扩增反应结束后, 利用7900HT Real-time PCR仪(Applied Biosystems)自带的软件分析Ct值, 计算出目的基因的表达量。采用2–ΔΔCt方法分析基因表达, 设置3个生物重复。相关基因所用引物序列参照文献[18-19]。
2 结果与分析
2.1 突变体rs的表型鉴定
与野生型相比, 突变体的粒长变短、粒宽变大, 粒厚增加, 籽粒显著变圆(图1-B, C; 表2), 粒长、粒宽分别为6.39 mm和2.58 mm (图1-D, E), 为野生型的85.1%和114.4%。此外, 突变体的千粒重相对于野生型降低了约11.6% (图1-F), 结实率比野生型下降, 但在株高、穗长等方面差异不显著(图1-A和表2)。
2.2 突变性状的遗传分析
为明确水稻圆粒突变体的遗传特性, 对与野生型进行正、反交试验。正交与反交F1单株均表现与野生型类似的表型, 说明圆粒是受隐性核基因控制的。通过对各组合F2代分离群体调查发现, F2群体的单株可分为两类, 一类表型正常, 另一类与突变体表型相似, 且野生型和突变表型的单株在F2群体中的分离比符合3∶1 (表3), 表明的突变表型是由单隐性核基因控制。
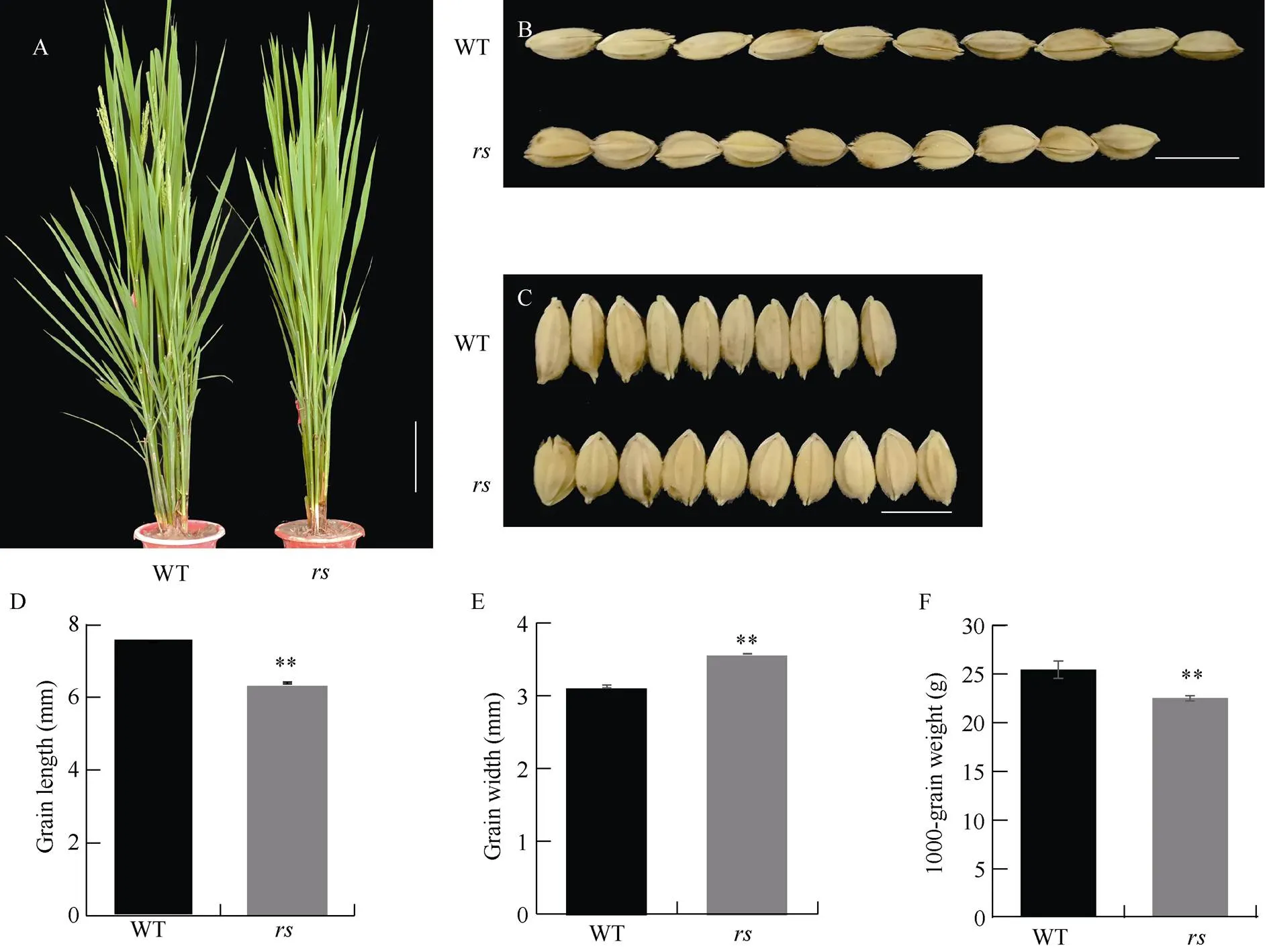
图1 野生型和突变体rs的表型
A: 野生型和在抽穗期植株表现, 比例尺为10 cm。B, C: 野生型和糙米籽粒表现。比例尺为6 mm。D, F: 野生型和粒长、粒宽与千粒重比较。**代表突变体与野生型之间在= 0.01水平上差异显著。
A: plants of the wild type and themutant at heading stage. Bar = 10 cm. B, C: grain phenotypes of the wild type and. Bar = 6 mm. D, F: comparisons of grain length, width, and the 1000-grain weight. ** Significant difference at= 0.01 level between the wild type and the mutant.
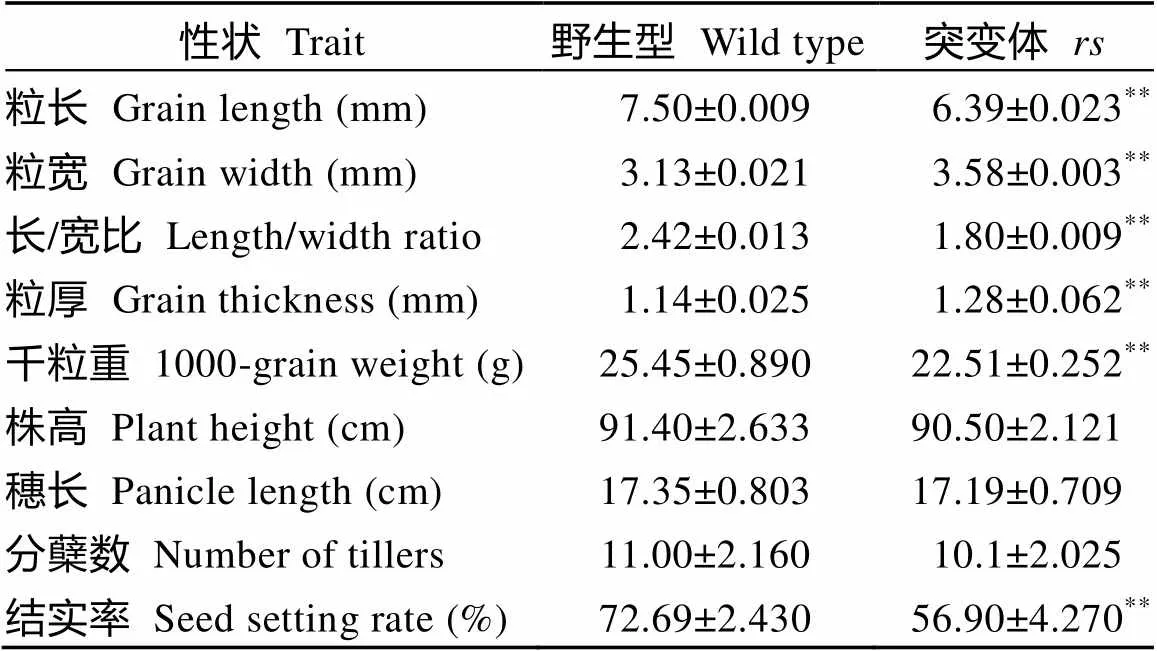
表2 野生型和rs的农艺性状比较
**在= 0.01 水平上差异显著。
**Significantly difference at= 0.01.

表3 突变体rs的遗传分析
χ2(0.05, 1)= 3.84. WT: wild type
2.3 颖壳外表皮细胞扫描电镜观察
水稻籽粒大小通常由颖壳细胞大小和细胞数目的多少决定。为了明确导致圆粒表型的原因, 对和野生型成熟籽粒颖壳的外表皮细胞进行扫描电镜观察(图2-A, B)。相比野生型,的细胞长度与宽度无显著差异(图2-C, D), 然而, 突变体和野生型细胞数目差异显著, 即纵向细胞数目减少约16.33% (图2-E), 横向细胞数目增加约15.38% (图2-F)。综上,籽粒变圆的原因主要是细胞数目改变。
2.4 细胞周期相关基因表达分析
细胞分裂是指活细胞为增殖其数量由一个细胞分裂为两个细胞的过程, 细胞数目的变化通常与细胞分裂的改变有关。为确定突变体细胞数目的变化是否与细胞分裂相关, 利用qRT-PCR分析细胞周期相关基因在野生型和中的表达水平。结果发现, 相比野生型, 多数与细胞周期相关的基因在突变体中显著上调, 如(图3)。综上, 突变体圆粒可能是与细胞周期的变化有关。
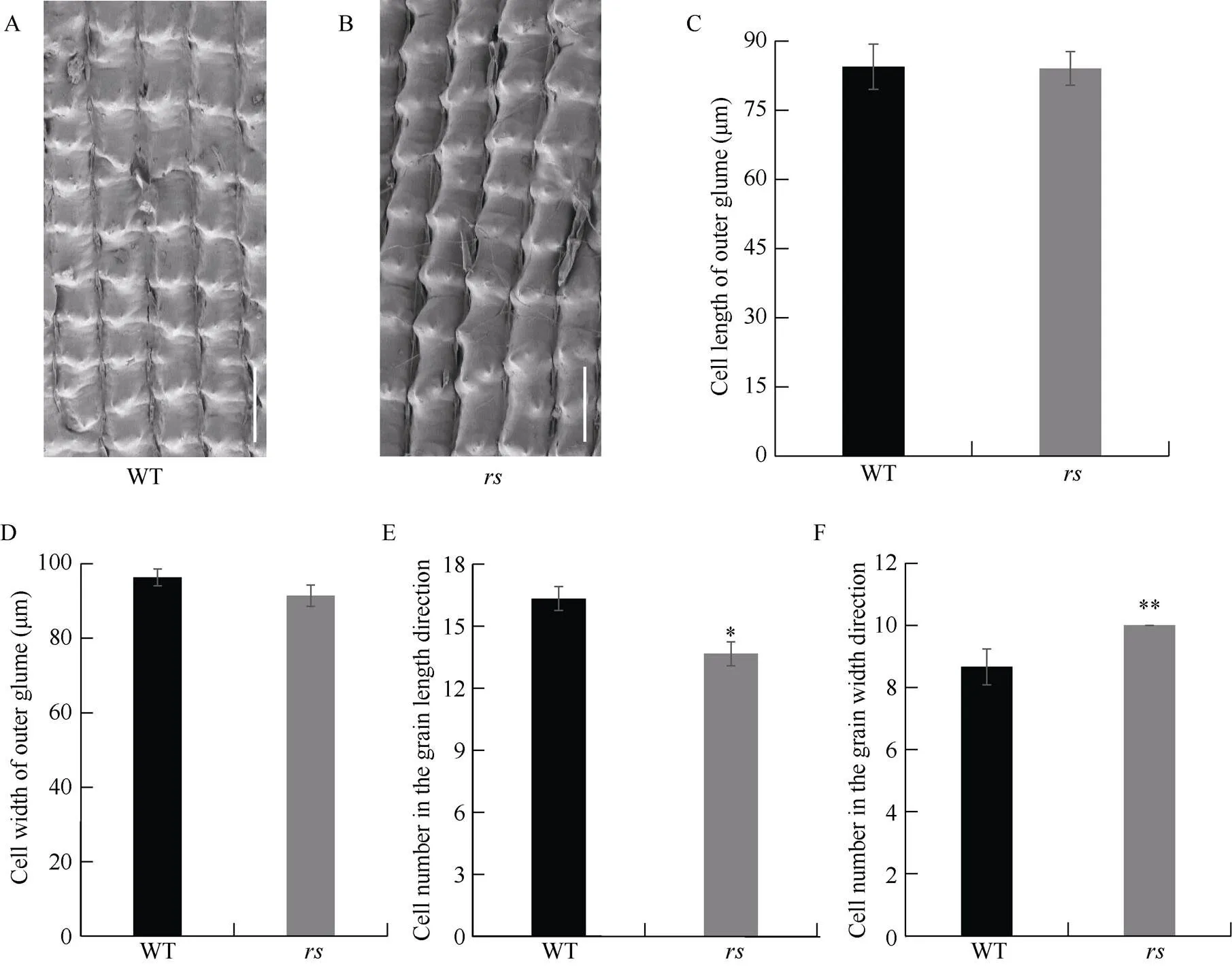
图2 颖壳组织学分析
A, B: 扫描电镜观察颖壳外表皮。比例尺为200 μm。C, D: 颖壳外表皮细胞长度与宽度的比较。E, F: 颖壳外表皮细胞数目的比较。 *和**分别表示在= 0.05与=0.01水平上差异显著。
A, B; scanning electron microscope analysis of the outer surfaces of glumes. Bar=200 μm. C, D: comparison of cell length and width in outer glumes. E, F: comparison of cell number in outer glumes. Data are given as means ± SD. *= 0.05; **= 0.01.

图3 细胞周期相关基因(CycA2;1、CycD4、E2F2、CycT1、CDKB、CDKA1、CycA2;2、Cdc20和CycA2;3)在野生型与rs中的表达分析
数据结果为3次生物重复平均值, *和**分别表示在= 0.05与0.01水平上差异显著。
Values are mean±SD (= 3). * and ** indicate significant differences between WT andat= 0.05 and= 0.01 by Student’s-test.
2.5 基因定位
为分离基因, 构建和“滇粳优”籼粳杂交F2群体, 利用10个具有典型突变性状的F2单株和覆盖水稻12条染色体的SSR标记进行初步连锁分析, 将突变基因初步定位于第3染色体标记RM3413和N3-10之间, 两者物理距离约为1116 kb。而后利用220个F2突变单株并开发新的InDel标记对目的基因进行精细定位。最终将目标基因定位在标记RM3413和N3-5间, 物理距离约589 kb (图4)。根据Gramane和RiceData等网站预测, 该区间内共有85个开放阅读框(ORF)分别为β-膨胀素前体、编码假定的蛋白、编码类似于EL2蛋白、编码含有同源框结构域的蛋白质、编码类似于转录因子同系物BTF3样蛋白质、编码肽酶、编码胰蛋白酶样丝氨酸和半胱氨酸结构域蛋白以及编码未知功能的DUF791家族蛋白等。在该区间内未见已克隆的与籽粒大小相关基因的报道。因此, 推测可能是与粒型相关的新基因。
2.6 油菜素内酯(BR)处理
为检测是否与油菜素内酯合成或信号转导途径相关, 利用油菜素内酯2,4-epiBL处理野生型和幼苗来检测其对BR敏感性。由图5-A可以看出, 野生型的叶夹角随着BR浓度升高呈增大趋势且增大幅度明显, 当2,4-epiBL的浓度达到1 μmol L–1时, 叶夹角为128.5°, 表现为下垂状态。然而, 随2,4-epiBL的浓度升高, 突变体叶夹角的增大趋势减缓, 当2,4-epiBL的浓度达到1 μmol L–1时, 叶夹角为96.25°, 表现为敏感性降低(图5-B)。另外, 利用qRT-PCR分析与油菜素内酯合成和信号转导相关基因在野生型和中的表达水平表明, 多数与BR合成和信号相关基因(、、、、)的表达呈下调趋势(图5-C), 而油菜素内酯合成限速酶基因、油菜素内酯信号相关基因、受到负反馈调节, 其表达呈显著上调。由此推断,的突变影响BR合成途径和信号途径。
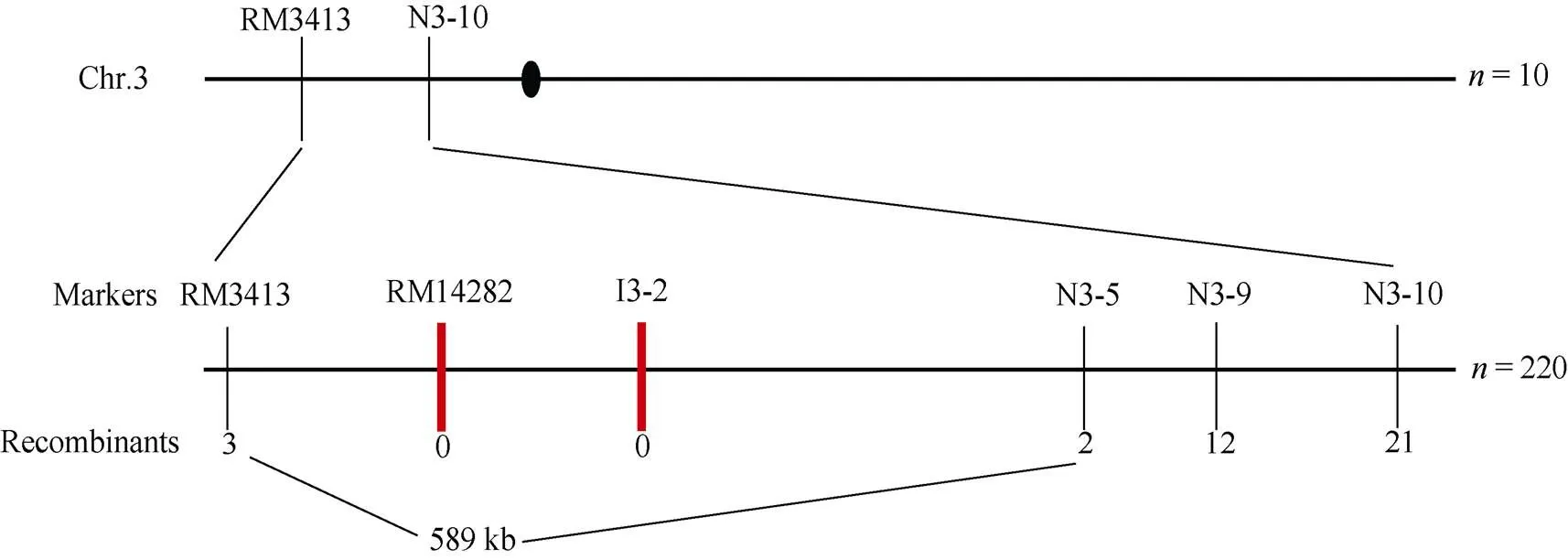
图4 RS基因的精细定位
黑色圆圈表示着丝粒; 粗竖线表示共分离标记; 标记下方的数字为极端个体的数目。
The black circle means the centromere; the thick vertical line means a co-segregate marker; the number under the markers means the number of extreme individuals.
2.7 粒型基因的表达分析
水稻粒型受复杂分子网络的调控, 目前在水稻中已经报道了一些参与调控籽粒大小的基因, 如、、、、、、、。为探究与这些粒型调控因子的相互关系, 我们对这些基因在野生型与突变体中的表达进行了qRT-PCR分析。结果发现, 相比野生型,、、等基因在中表达上调,、、等基因表达下调(图6), 这暗示的突变影响了粒型相关基因的表达。调控水稻粒型的具体分子机制将是后续研究的重点内容。

图5 野生型和突变体rs对2,4-epiBL处理的响应
A: 不同2,4-epiBL浓度处理, 上面为野生型, 下面为。B: 不同2,4-epiBL浓度处理叶夹角的变化。C: 野生型和中BR合成和信号转导途径基因的表达水平。**分别代表突变体与野生型之间差异达0.01显著水平。
A: performance of lamina joint to 2,4-epiBL in wild-type (up) and(down). B: changes of lamina inclination to 2,4-epiBL. C: expression levels of BR synthesis and signal transduction pathway genes in the wild type and** Significant difference at the 0.01 level between wild type and
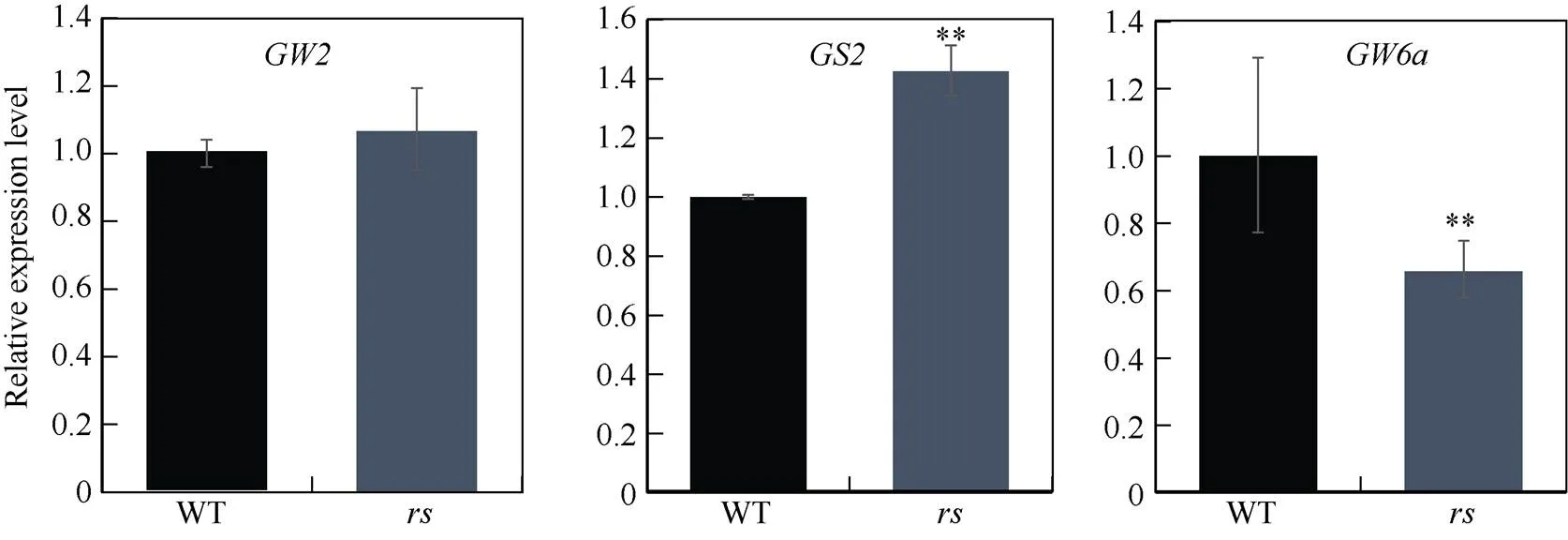
(图6)
*与**分别表示在= 0.05与0.01水平上差异显著。*= 0.05; **=0.01.
3 讨论
本研究通过EMS诱变的方法从“宁粳3号”为背景的突变体库中筛选到一个籽粒变圆的突变体。相关研究指出器官大小由细胞数目和细胞大小共同决定, 与之对应的是两个基本过程, 即细胞增殖和细胞扩张[20-21]。而细胞增殖和细胞扩张与植物体内激素含量相关。调控水稻粒重的编码IAA-葡萄糖水解酶, 通过控制IAA供应影响合胞体到细胞化阶段的转变, 从而限制了细胞数目和籽粒长度[22]。是生长素的原初响应基因, 参与调节生长素的转运, 是生长素响应和转运的正调控因子, 是植物特异的控制器官大小的调节因子[14]。是一个BR信号受体, 通过控制细胞分裂和伸长, 调控器官发育[23]。油菜素内酯是一种新型植物内源激素, 是第一个被分离出的具有活性的油菜素甾族化合物(brassinosteroids, BRs), 在自然界中已发现超过70种BR[24], 目前育种研究工作者已筛选出一些参与BR调控途径相关的突变体[25-26]。相比野生型,对外源BR敏感性降低, BR信号相关基因、与在突变体中显著下调, 而BR合成基因受负反馈调节而表达上调, 说明的突变影响了植株体内正常的BR信号转导过程。细胞学观察显示细胞数目的改变是导致籽粒变圆的原因, 遗传分析表明该突变受隐性单基因控制, 并将精细定位于第3染色体短臂末端, 位于标记RM3413和N3-5之间大约589 kb的区间内, 而第3染色体上已报道的控制粒型的相关基因、等均不在该区间内, 提示可能是一个新的控制粒型的基因。
植物激素对种子大小起着直接或间接的作用, 尤其是油菜素内酯和生长素。如是一个BR信号受体, 在植物生长和发育中起着重要作用, 通过控制细胞分裂和伸长, 调控器官发育[27]。参与油菜素内酯生物合成, 过表达会导致粒长、粒宽增加, 同时会引起发育的花药和种子中糖的积累[28]。是油菜素内酯信号传导的下游信号分子, 干扰抑制表达, 导致转基因水稻产生矮秆、直立叶的表型, BR敏感性降低且BR应答基因表达发生改变[29]。因此, 对基因进行克隆和功能研究, 可能为阐明BR调控水稻籽粒大小的分子网络提供新的线索。
可能影响与的表达, 来控制水稻籽粒大小。是籽粒大小的正向调控因子, 其突变会产生小粒[7]。参与生长素的转运, 正向调控籽粒大小, 其功能性获得突变体粒长和粒宽分别增加15.2%和17.0%[14]。相比野生型, 粒型基因与的表达水平在突变体中显著下调。突变体的表型可能与和表达下调有关。因此, 需要进一步克隆基因, 并进行功能分析, 阐述的分子调控网络, 为调控水稻粒型的分子育种提供基础。
4 结论
鉴定了一个圆粒突变体, 相比野生型,籽粒变圆, 而其他农艺性状无显著差异。对外源BR处理敏感性降低。细胞数目的改变是导致籽粒变圆的原因。突变是由1对隐性基因控制,该基因被定位在第3染色体标记RM3413和N3-5之间, 共包含80个ORFs。突变影响BR合成途径和信号途径, 改变了粒型相关基因的表达。
致谢:农业农村部长江中下游粳稻生物学与遗传育种重点实验室、长江流域杂交水稻协同创新中心、江苏省现代作物生产中心。
[1] Xing Y, Zhang Q. Genetic and molecular bases of rice yield., 2010, 61: 421–442.
[2] Mao H, Sun S, Yao J, Wang C, Yu S, Xu C, Li X, Zhang Q. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice.2010, 107: 19579–19584.
[3] Song X J, Huang W, Shi M, Zhu M Z, Lin H X. A QTL for rice grain width and weight encodes a previously unknown RING- type E3 ubiquitin ligase., 2007, 39: 623–630.
[4] Hu J, Wang Y, Fang Y, Zeng L, Xu J, Yu H, Shi Z, Pan J, Zhang D, Kang S, Zhu L, Dong G, Guo L, Zeng D, Zhang G, Xie L, Xiong G, Li J, Qian Q. A rare allele ofenhances grain size and grain yield in rice., 2015, 8: 1455–1465.
[5] Wu W, Liu X, Wang M, Meyer R S, Luo X, Ndjiondjop M N, Tan L, Zhang J, Wu J, Cai H, Sun C, Wang X, Wing RA, Zhu Z. A single-nucleotide polymorphism causes smaller grain size and loss of seed shattering during African rice domestication., 2017, 3: 17064–17071.
[6] Wang Y, Xiong G, Hu J, Jiang L, Yu H, Xu J, Fang Y, Zeng L, Xu E, Xu J, Ye W, Meng X, Liu R, Chen H, Jing Y, Wang Y, Zhu X, Li J, Qian Q. Copy number variation at thelocus contributes to grain size diversity in rice., 2015, 47: 944–952.
[7] Xu C, Liu Y, Li Y, Xu X, Xu C, Li X, Xiao J, Zhang Q. Differential expression ofregulates grain size in rice., 2015, 66: 2611–2634.
[8] Li J, Chu H, Zhang Y, Mou T, Wu C, Zhang Q, Xu J. The ricegene encodes a ubiquitin-associated (UBA) domain protein that regulates heading date and grain weight., 2012, 7: e34231.
[9] Wang E, Wang J, Zhu X, Hao W, Wang L, Li Q, Zhang L, He W, Lu B, Lin H, Ma H, Zhang G, He Z. Control of rice grain-filling and yield by a gene with a potential signature of domestication., 2008, 40: 1370–1374.
[10] Ishimaru K, Hirotsu N, Madoka Y, Murakami N, Hara N, Onodera H, Kashiwagi T, Ujiie K, Shimizu B, Onishi A, Miyagawa H, Katoh E. Loss of function of the IAA-glucose hydrolase geneenhances rice grain weight and increases yield., 2013, 45: 707–711.
[11] Wang S, Wu K, Yuan Q, Liu X, Liu Z, Lin X, Zeng R, Zhu H, Dong G, Qian Q, Zhang G, Fu X. Control of grain size, shape and quality byin rice., 2012, 44: 950–954.
[12] Liu J, Chen J, Zheng X, Wu F, Lin Q, Heng Y, Tian P, Cheng Z, Yu X, Zhou K, Zhang X, Guo X, Wang J, Wang H, Wan J M.acts in the brassinosteroid signaling pathway to regulate grain width and weight in rice., 2017, 3: 17043–17080.
[13] Hong Z, Ueguchi-Tanaka M, Umemura K, Uozu S, Fujioka S, Takatsuto S, Yoshida S, Ashikari M, Kitano H, Matsuoka M. A rice brassinosteroid-deficient mutant,(), is caused by a loss of function of a new member of cytochrome P450., 2003, 15: 2900–2910.
[14] Liu L, Tong H, Xiao Y, Che R, Xu F, Hu B, Liang C, Chu J, Li J, Chu C. Activation ofsignificantly improves grain size by regulating auxin transport in rice., 2015, 112: 11102–11107.
[15] Abbasi F, Onodera H, Toki S, Tanaka H, Komatsu S., a calcium-dependent protein kinase gene from rice, is induced in response to cold and gibberellin in rice leaf sheath., 2004, 55: 541–552.
[16] Yamamuro C, Ihara Y, Wu X, Noguchi T, Fujioka S, Takatsuto S, Ashikari M, Kitano H, Matsuoka M. Loss of function of a ricehomolog prevents internode elongation and bending of the lamina joint., 2000, 12: 1591–1605.
[17] Liu S, Hua L, Dong S, Chen H, Zhu X, Jiang J, Zhang F, Li Y, Fang X, Chen F., a mitogen-activated protein kinase, influences rice grain size and biomass production., 2015, 84: 672–681.
[18] Xia K, Ou X, Tang H, Wang R, Wu P, Jia Y, Wei X, Xu X, Kang S H, Kim S K, Zhang M. Rice microRNAtargets the obtusifoliol 14α-demethylase geneand mediates the biosynthesis of phytosterols and brassinosteroids during development and in response to stress.2015, 208: 790–802.
[19] Zhang S, Wu T, Liu S, Liu X, Jiang L, Wan J. Disruption ofis critical for floral organ development and plant architecture in rice (L.).2016, 34: 748–760.
[20] Horiguchi G, Ferjani A, Fujikura U, Tsukaya H. Coordination of cell proliferation and cell expansion in the control of leaf size in., 2006, 119: 37–42.
[21] Horvath B M, Magyar Z, Zhang Y, Hamburger A W, Bako L, Visser R G, Bachem C W, Bogre L.regulates organ size through cell growth and proliferation in plants., 2006, 25: 4909–4920.
[22] Ishimaru K, Hirotsu N, Madoka Y, Murakami N, Hara N, Onodera H, Kashiwagi T, Ujiie K, Shimizu B, Onishi A, Miyagawa H, Katoh E. Loss of function of the IAA-glucose hydrolase geneenhances rice grain weight and increases yield., 2013, 45: 707–718.
[23] Nakamura A, Matsuoka M. The role ofand its homologous genes,and, in rice., 2006, 140: 580–590.
[24] Andrzej B. Metabolism of brassinosteroids in plants., 2007, 45: 95–107.
[25] Hong Z, Ueguchitanaka M, Shimizusato S, Inukai Y, Fujioka S, Shimada Y, Takatsuto S, Agetsuma M, Yoshida S, Watanabe Y, Uozu S, Kitano H, Ashikari M, Matsuoka M. Loss-of-function of a rice brassinosteroid biosynthetic enzyme, C-6 oxidase, prevents the organized arrangement and polar elongation of cells in the leaves and stem., 2002, 32: 495–508.
[26] Sakamoto T, Morinaka Y, Inukai Y, Kitano H, Fujioka S. Auxin signal transcription factor regulates expression of the brassinosteroid receptor gene in rice., 2013, 73: 676–688.
[27] Gui J, Zheng S, Liu C, Shen J, Li J, Li L. OsREM4.1 interacts with OsSERK1 to coordinate the interlinking between abscisic acid and brassinosteroid signaling in rice., 2016, 38: 201–214.
[28] Zhu X, Liang W, Cui X, Chen M, Yin C, Luo Z, Zhu J, Lucas W J, Wang Z, Zhang D. Brassinosteroids promote development of rice pollen grains and seeds by triggering expression of, a MYB domain protein., 2015, 82: 570–581.
[29] Bai M Y, Zhang L Y, Gampala S S, Zhu S W, Song W Y, Chong K, Wang Z Y. Functions of OsBZR1and 14-3-3 proteins in brassinosteroid signaling in rice., 2007, 104: 13839–13844.
Identification and mapping of round seed related gene in rice (L.)
CHEN Ya-Ping, MIAO Rong, LIU Xi, CHEN Ben-Jia, LAN Jie, MA Teng-Fei, WANG Yi-Hua, LIU Shi-Jia, and JIANG Ling*
State Key Laboratory of Crop Genetics and Germplasm Enhancement / Research Center of Jiangsu Plant Gene Engineering, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
It is significant to clarify the genetic and molecular mechanism of genes related to rice grain size for rice yield. A mutant() was screened fromvariety “Ningjing 3” mutagenized by ethyl methane sulfonate (EMS). Genetic analysis revealed that the phenotype ofwas controlled by a single recessive nuclear gene. Scanning electron microscope observation indicated that the change of cell number was responsible for the mutant phenotype of. Compared with the wild type, the expression of cell cycle related-genes increased significantly in.was located in the 589 kb region of chromosome 3, between markers RM3413 and N3-5. Themutation affected BR signal pathway, and changed the expression of grain size-related genes. This research contributes to elucidating the molecular mechanism of rice grain development.
rice (L.); round seed mutant; phenotypic analysis; gene mapping
2018-06-07;
2018-10-08;
2018-11-01.
10.3724/SP.J.1006.2019.82032
通信作者(Corresponding author): 江玲, E-mail: jiangling@njau.edu.cn
E-mail: 11115225@njau.edu.cn
本研究由国家重点研发计划项目(2016YFD0100101-08), 国家自然科学基金重点项目(91535302)和国家级大学生创新性实验计划项目(201710307014)。
This study was supported by the National Key Research and Development Program of China (2016YFD0100101-08), the Key Projects of National Natural Science Foundation (91535302), and the National University Student Innovation Program (201710307014).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20181030.1120.004.html

