自拟溃结灌肠方调控Akt/NFκB信号通路治疗大鼠溃疡性结肠炎的作用机制研究
顾红,马炯,袁保,王雯雯
(南京中医药大学江阴附属医院肛肠科,江苏 江阴 214400)
溃疡性结肠炎(Ulcerative colitis, UC)是特发于结肠或者直肠黏膜的一种慢性肠道炎症疾病,属于炎症性肠病(Inflammatory Bowel Disease, IBD)其中一种。本病可始于直肠,通常以连续的方式向近端延伸至部分或整个结肠[1]。溃疡性结肠炎的全球发病率约为1~24人/万人[2],腹泻和黏液脓血样大便是UC的特征性症状,此外本病尚可出现腹痛、发热或肠外临床症状[1]。理论研究表明UC发病与遗传、环境和饮食习惯等多种因素关系密切,发病机理复杂,尚无较好的针对性治疗方法[3]。西医多采用抗炎、免疫抑制剂、激素治疗UC,近年来肽类/蛋白类制剂用于UC的治疗亦取得了一定成效[4],但是长期应用可能引起耐药、机体免疫功能障碍、肝肾损伤等,副作用较大,加上价格昂贵,限制了药品的使用,因此临床上亟待开发出低毒高效的溃疡性结肠炎的治疗药物。祖国传统医药灿若瑰宝,在UC治疗方面,中医药治疗具有治疗途径多(包括口服、外用、辅助手段等),疗效确切,副作用小的特点[5-7]。笔者依据UC发病机制,结合长期临床经验,采用自拟的溃结灌肠方治疗UC取得了较好的疗效,但其作用机制尚不明确。因此,本研究采用葡聚糖硫酸钠(DSS)诱导大鼠UC模型,通过检测药物对白介素1(IL-1)、白介素6(IL-6)、肿瘤坏死因子(TNF-α)含量变化,并结合现代分子生物学手段研究药物对蛋白激酶B(Akt)及核转录因子(NFκB)蛋白表达的影响,探讨自拟溃结灌肠液对UC大鼠肠道炎症的作用机制。现报告如下。
1 实验材料
1.1 实验动物
35只健康SD雄性大鼠,8周龄,体质量(200±20)g,购自上海西普尔-必凯实验动物有限公司,动物合格证编号:SCXK(沪)2018-0006。
1.2 药物与实验试剂
自拟溃结灌肠方组成:荔枝草30 g,茜草炭10 g,紫草15 g,五倍子5 g。药物加入500 mL蒸馏水浸泡30 min后,100℃沸水提取30 min,提取3次,合并滤液,50℃减压蒸馏获得浓缩浸膏,生理盐水复溶,配置成0.5 g/mL的溶液,4℃保存备用。柳氮磺吡啶肠溶片(批号:22181013,上海信福达制药有限公司),用研钵将药品均匀研成粉末,生理盐水溶解,配置成0.35 g/mL的溶液,4℃保存备用。
葡聚糖硫酸钠(Dextran Sulfate Sodium, DSS, MW5kDa, 货号S14048)购自上海源叶生物科技有限公司;IL-1、IL-6及TNF-αELISA试剂盒(货号:PI303,PI328,PT516)购自上海碧云天生物制剂公司;Akt(货号:#4691, 稀释比例1∶1 000),p-Akt(货号:#9271, 稀释比例1∶1 000),NFκB(货号:#6956, 稀释比例1∶1 000),p-NFκB(货号:#3033, 稀释比例1∶1 000),辣根过氧化酶标记的兔二抗(货号:#7074, 稀释比例1∶2 000),辣根过氧化酶标记的鼠二抗(货号:#7076, 稀释比例1∶2 000)购自美国Cell Signaling Technology公司。全蛋白提取试剂盒(货号:KGP2100)、BCA蛋白含量检测试剂盒(货号:KGP902),5×SDS-PAGE蛋白上样缓冲液(货号:KGP101X)购自凯基生物技术股份有限公司。尿粪隐血检测试剂盒(货号:C027-1-1)购自南京建成生物工程研究所。
1.3 实验仪器与设备
显微镜为蔡司Axio Zoom.V16 Zoom Microscope(Carl Zeiss, Oberkochen, Germany);酶标仪为Molecular Devices Spectra Max Plus automatic plate reader (Molecular Device, Sunnyvale, CA, USA);凝胶成像系统为天能2500R;垂直电泳系统、转膜系统购自北京君意东方电泳设备有限公司;高速冷冻离心机为长沙湘智高速离心机,型号TGL21M;匀浆器为沪析FJ200。
2 实验方法
2.1 分组与造模
35只SD大鼠饲养于南京中医药大学动物实验中心(SPF级,12/12 h明暗交替,温度20±2℃,湿度40%~60%),适应性喂养1周后进行随机分组,空白对照组6只(CON组),其余29只大鼠参考前人文献采用DSS诱导建立UC模型[8],具体方法为:配制5%的DSS溶液,给予大鼠自由饮用7 d,对照组给予饮用蒸馏水。造模结束后随机选取5只取结肠组织,进行病理切片,判断模型是否复制成功。其余24只UC大鼠随机分为4组,每组6只,即模型组(UC组),柳氮磺吡啶阳性药组(SUL组),自拟溃结灌肠方低剂量组(KJF-L组)及自拟溃结灌肠方高剂量组(KJF-H组)。
2.2 给药剂量及给药方法
造模结束后,分别进行灌肠给药,阳性药组给予0.35 g/kg的柳氮磺吡啶灌肠液,中药给药低剂量组给予3 g/kg的溃结灌肠方提取液,高剂量组给予6 g/kg的溃结灌肠方提取液;空白对照组和UC模型组给予同体积生理盐水进行灌肠。灌肠体积均为1 mL/100 g,每日给药1次,给药周期为14 d。具体灌肠方法为:大鼠麻醉后,采用注射器吸取药液或对照溶液,经儿童用肛软管插入大鼠肛门8 cm处进行灌肠,操作时应注意避免损伤大鼠肠道,灌肠结束后保持大鼠仰卧位,避免药液流出,直至大鼠苏醒后放归饲养笼。
2.3 样品采集
(1)血液样品:末次灌肠治疗结束后,禁食不禁水12 h后,大鼠麻醉后,迅速用注射器抽取心脏血置于离心管中,4000转离心15 min后取上清,分装后于-80℃冻存待测。
(2)组织样品:沿腹中线剖开腹部,取肛门处向上6~10 cm左右的结肠,采用冰冷生理盐水冲洗结肠肠管,剪刀剖开肠管,观测病变情况,选取病变明显的部位,用4%多聚甲醛溶液固定,剩余病变组织采用液氮速冻保存备用。
2.4 指标观察和检测
(1)疾病活动指数评价:实验周期中,注意观察大鼠毛发、精神状态、活动程度。并于造模结束后,记录大鼠体质量,观察大鼠粪便性状,检测粪便潜血,根据评估疾病活动指数(DAI)=体质量下降指数+大便性状+大便潜血)/3计算公式,评价UC疾病活动指数。具体评价标准如下:体质量下降指数:无下降记0分,下降1%~5%记1分,5%~10%记2分,10%~20%记3分,大于20%记4分;大便性状:正常记0分,松软记2分,腹泻记4分;大便潜血,无记0分,阳性2分,肉眼可见便血记4分[8-9]。
(2)结肠组织病理学评价:4%甲醛固定的结肠病变组织经过脱钙、脱水、透明、浸蜡包埋后,采用自动切片机制作成厚度5 μm的切片,常规HE染色后,采用光学显微镜观察结肠黏膜形态结构,并进行病理学评分,评分标准参考Dieleman等人[10]的研究。评分分为4部分:①病变深度:0分,无病变;1分,病变侵袭黏膜表层;2分,病变侵袭至黏膜下层;3分,病变穿透黏膜。②炎症程度:0分,无炎症;1分,炎症程度轻;2分,炎症程度中;3分,炎症程度重。③病变范围:0分,无病变;1分,小于25%;2分,大于25%,小于50%;3分,大于50%,小于75%;4分,大于75%。④隐窝损伤:0分,无;1分,1/3隐窝损伤;2分,2/3隐窝损伤;3分,隐窝损伤,上皮表面完整;4分,隐窝损伤,上皮表面消失。
(3)血清中IL-1、IL-6、TNF-α检测:严格按照ELISA检测试剂盒进行操作。
(4)Westernblot检测结肠组织中Akt、NFκB蛋白的表达:取液氮冻存的各组结肠组织,电动匀浆器研磨组织获得匀浆,采用全蛋白提取试剂盒提取组织蛋白,并用BCA试剂盒测定蛋白含量,调整浓度为5 mg/mL。加入SDS上样缓冲液使蛋白变性。25 μg变性蛋白采用垂直电泳系统在10% SDS聚丙烯酰胺凝胶上进行分离,并转移到PVDF膜上。膜用5%脱脂奶粉溶液常温封闭2 h。按比例稀释Akt、NFκB及对应磷酸化抗体,将膜与一抗4℃孵育过夜。清洗残余一抗,将膜与辣根过氧化酶标记的二抗室温孵育2 h。采用化学发光法检测蛋白,采用天能成像系统采集光学信号。采用成像仪自带的图像分析系统对Western条带进行灰度分析,并计算平均值(n=3)。
2.5 统计学方法
3 结果
3.1 各组大鼠一般情况观察及DAI评分比较
正常组大鼠毛皮光滑,行动敏捷,大便性状正常,饮食饮水量无明显变化,体质量逐渐增加。而UC模型组随着造模时间增加逐渐出现停滞不动,行动迟缓,粪便不成形,造模后期出现明显肉眼可见的便血,进食饮水量减少。而给予自拟溃结灌肠方治疗可逆转上述症状。DAI评分见表1,结果表明与空白组相比,模型组DAI评分显著升高(P<0.01),给予自拟溃结灌肠方后DAI评分随剂量升高降低(P<0.01)。
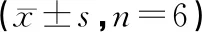
表1 自拟溃结灌肠方对DSS诱导UC大鼠模型中对DAI评分的作用
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01
3.2 结肠黏膜组织病理切片评价
由图1可以看出,空白对照组小鼠结肠黏膜平整、皱襞清晰,腺体结构完整,无炎性介质。与空白组相比,模型组小鼠结肠病理切片显示黏膜结构变形扭曲,黏膜上皮层有缺失,固有层腺体数量显著减少,并伴随慢性炎性细胞增多,病理学评分(见表2)显著高于空白组(P<0.01)。给予中药治疗后,与模型组相比,中药组和柳氮磺吡啶组小鼠结肠溃疡部位病理切片显示,腺体结构完整度均逐渐好转,溃疡面逐渐减少,慢性炎细胞浸润也显著低于模型组,病理评分显著降低,具有显著性差异(P<0.01)。
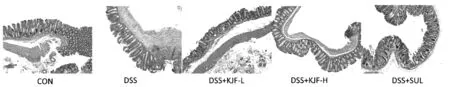
注:CON:对照组;DSS:葡聚糖硫酸钠诱导的UC模型组;DSS+KJF-L:模型+溃结灌肠方低剂量组;DSS+KJF-H:模型+溃结灌肠方高剂量组;DSS+SUL:模型+阳性药柳氮磺吡啶组图1 自拟溃结灌肠方对DSS诱导UC大鼠模型中结肠病理切片的影响(×100)
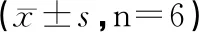
表2 自拟溃结灌肠方对DSS诱导UC大鼠模型肠粘膜病理评分比较
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01
3.3 大鼠血清中IL-1、IL-6及TNF-α含量比较
由表3可以看出,与正常组相比,DSS诱导的UC大鼠模型血清中IL-1、IL-6及TNF-α含量显著升高(P<0.01);给予药物治疗后,与模型组相比,自拟溃结灌肠方各剂量组及阳性药柳氮磺吡啶组均可显著降低上述指标(P<0.01)

表3 自拟溃结灌肠方对DSS诱导UC大鼠模型中促炎细胞因子的影响
注:与对照组比较,##P<0.01;与模型组比较,**P<0.01
3.4 大鼠结肠组织中Akt、NFκB蛋白表达影响
本研究进一步采用westernblot研究自拟溃结灌肠方治疗DSS诱导的溃疡性结肠炎的作用机制。与空白组相比,模型组肠道中Akt磷酸化水平显著升高(P<0.01, 图2A),给予药物治疗后,Akt磷酸化水平显著降低(P<0.01, 图2A);模型组中NFκB磷酸化水平显著升高(P<0.01, 图2B),给予自拟溃结灌肠方治疗后,NFκB磷酸化水平显著降低(P<0.01,图2B)。
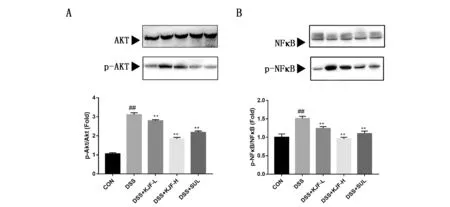
注:CON:对照组;DSS:葡聚糖硫酸钠诱导的UC模型组;DSS+KJF-L:模型+溃结灌肠方低剂量组;DSS+KJF-H:模型+溃结灌肠方高剂量组;DSS+SUL:模型+阳性药柳氮磺吡啶组;与对照组比较,##P<0.01;与模型组比较,**P<0.01图2 自拟溃结灌肠方对DSS诱导UC大鼠模型中结肠组织AKT(A)及NFκB(B)的影响
4 讨论
溃疡性结肠炎是遗传、环境、生活习惯、机体免疫等多种因素诱发的肠道组织慢性炎症反应[3]。炎症反应是本病最主要的病理变化,主要包括致炎因子水平失衡、黏膜水肿、炎性细胞渗出等。研究表明UC患者及相关动物模型中白介素、肿瘤坏死因子等促炎细胞因子指标显著升高[8,11-13]。因此,抗炎治疗是治疗UC的一种重要措施。西医抗炎治疗UC多采用水杨酸及激素类药物,但存在药物不耐受、副作用明显、易复发等问题。因此临床亟需寻找新的治疗UC的方法。中药灌肠治疗UC因其性质温和刺激性小、直达患处、避免口服药首过效应、且由于药物直接进入肠道,有利于药物有效成分直接吸收入血循环,因而效果显著,且中药灌肠具有副作用小、费用相对于免疫抑制剂费用低廉,复发率低的优势,不仅成为临床常用的治疗方法,也引起了研究者的注意[6,14-15]。
根据UC的发病机制及特点,结合中医古籍肠道症状的描述,可将UC划归于“久痢”“肠澼”等范畴。结合临床实践,自拟溃结灌肠方进行局部灌肠治疗UC,获得良好效果,本方主要由荔枝草、茜草炭、紫草、五倍子组成。荔枝草性苦凉,具有清热解毒,凉血止血作用;茜草止血而不留瘀;紫草有凉血、活血功效;五倍子,味酸涩,归肺、大肠、肾经,具有涩肠止泻,收湿敛疮之功效。诸药合用凉血止血,涩肠止泻,清热化湿,去腐敛疮。本方配伍合理、效果显著,受到患者好评。为进一步探索自拟溃结灌肠方治疗UC的作用机制,本研究采用国际公认的造模方法,采用5%DSS诱导构建大鼠UC模型,给予本方治疗后,对大鼠DAI疾病活动评分,血清炎性细胞因子指标IL-1、IL-6及TNF-α含量,结肠组织Akt及NFκB磷酸化水平进行评价。本研究发现,DSS造模后第二日大鼠即出现便潜血阳性、粪便稀不成形的特点,随着造模时间增加,大鼠出现活动减少、反应迟钝、毛发发暗粘连等症状,DAI指数显著升高。病理切片显示DSS诱导的模型大鼠结肠黏膜结构破坏,炎性细胞浸润,与人类UC情况相似。给予自拟溃结灌肠方灌肠后,大鼠DAI指数显著降低,病理切片显示炎性细胞浸润减少,结肠黏膜结构得到一定程度的恢复。细胞因子IL-1、IL-6及TNF-α与炎症关系密切,在炎性反应的发生、放大中起重要作用,是UC发病中重要的炎症指标[16]。实验发现,DSS诱导的UC大鼠模型血清中IL-1、IL-6及TNF-α显著上升,经过自拟溃结灌肠方灌肠治疗的大鼠上述指标显著下降,提示本方可通过抑制炎性细胞因子,减轻炎症反应从而达到治疗UC的目的。
Akt是一种丝氨酸/苏氨酸激酶,Akt参与的信号转导通路在炎性肠病(inflammatory bowel disease, IBD)的发病机制中起到重要作用,许多研究表明抑制Akt蛋白磷酸化可以减少炎性细胞因子释放,起到治疗溃疡性结肠炎的作用[17-18]。除此之外,NFκB同样参与炎症细胞因子信号转导,具体表现为:NFκB由同型或异二聚体p50/p65和抑制性IκB蛋白组成,IκB激酶复合物(IKKβ)被激活后,IκB磷酸化并最终降解。IκB的降解进一步导致p50/p65的激活,激活的p50/p65进入细胞核并激活其下游靶基因的转录,包括TNF-α,IL-1,IL-6,IL-17和其他炎症介质,从而促进肠道炎症的发生发展[15]。综上所述,在肠道炎症过程中,Akt/NFκB信号通路通过调节转录和翻译,密切参与调节炎症介质的合成,抑制Akt/NFκB信号通路可以减少炎症细胞因子的释放,减轻炎症反应,治疗UC[17-18]。本实验研究结果与前人研究一致,结果表明,DSS诱导的UC模型中Akt及NFκB磷酸化水平显著升高,给予自拟溃结灌肠方治疗可抑制Akt及NFκB磷酸化,减轻炎症反应,治疗UC。
本研究结果提示,以中医理论为基础,结合临床实际情况自拟的溃结灌肠方为治疗溃疡性结肠炎提供了一种新的、效果显著的临床治疗方法,并初步探讨了本方可能通过调节Akt/NFκB信号通路,抑制炎性细胞因子IL-1、IL-6、TNF-α的释放,减轻炎症反应,从而达到治疗溃疡性结肠炎的作用,治疗效果呈现一定的剂量依赖性。但由于中药组方成分复杂,我们将进一步寻找其有效活性成分,深入研究其作用机制。

