QuEChERS-超高效液相色谱-串联质谱法测定畜肉中伊维菌素残留量
金鑫 朱志
摘 要:采用QuEChERS技术提取畜肉中的伊维菌素(ivermectin,IVM),经碱性氧化铝固相萃取柱净化后氮吹浓缩,以乙腈和2.5 mmol/L乙酸铵水溶液为流动相,经Kinetex C18色谱柱洗脱分离,采用电喷雾离子源,多反应监测正离子模式进行分析,建立超高效液相色谱-三重四极杆串联质谱法测定畜肉中IVM含量的分析方法。结果表明:在1.0~500.0 μg/kg添加量范围内,IVM质谱响应强度与其质量浓度呈良好的线性关系,相关系数(r)为0.999 7;检出限为0.3 μg/kg,定量限为1.0 μg/kg;加标回收率为94.7%~97.4%,相对标准偏差为1.0%~3.2%。该法前处理简单、准确度高、精密度好,可为畜牧养殖和畜肉质量安全监控提供检测方法。
关键词:伊维菌素;超高效液相色譜-串联质谱法;QuEChERS;畜肉;残留量测定
Abstract: This paper reports on the development of an analytical method for the determination of ivermectin residues in livestock meat using ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry (UPLC-MS/MS). Ivermectin from samples was extracted by the QuEChERS method, purified by solid phase extraction on an alkaline alumina column and concentrated by nitrogen blowing. Using a mobile phase consisting of acetonitrile and 2.5 mmol/L ammonium acetate aqueous solution, the chromatographic separation was performed on a Kinetex C18 column. The analyte was detected by multiple reaction monitoring (MRM) with an electrospray ionization source in the positive ion mode. The results showed that the concentration of ivermectin in the range from 1.0 to 500.0 μg/kg showed a good linear relationship with mass spectral response values, with a correlation coefficient (r) of 0.9997. The limit of detection and limit of quantitation were 0.3 and 1.0 μg/kg, respectively. The recoveries for spiked samples were in the range from 94.8% to 97.4%, with relative standard deviations (RSDs) of 1.3% to 3.2%. The method had the advantages of simple pretreatment, high accuracy and good recovery, and it could be useful in animal husbandry and livestock meat quality and safety supervision.
Keywords: ivermectin; ultra-high performance liquid chromatography-tandem mass spectrometry; QuEChERS; livestock meat; residue determination
DOI:10.7506/rlyj1001-8123-20190802-174
中图分类号:TS251.7 文献标志码:A 文章编号:
伊维菌素(ivermectin,IVM),又名22,23-二氢阿巴美丁或依维菌素[1-2],化学式为C48H74O14,是由链霉菌(Streptomyces avermitilis)发酵产生的十六元大环内酯化合物[3-5],对体内外寄生虫,特别是线虫和节肢动物具有良好的驱杀功效,是一种高效、广谱、低毒抗生素类抗寄生虫药物[6-8],广泛用于治疗家畜的胃肠线虫病、牛皮蝇蛆、纹皮蝇蛆、羊鼻蝇蛆和猪、羊疥螨病[9-11]。我国农业部规定IVM在牛肾脏组织中的最高残留限量(maximum residue limit,MRL)为30 μg/kg;欧盟(EU)No418/2014号法规规定IVM在动物源性食品中的MRL为30~100 μg/kg;日本“食品中残留农业化学品肯定列表制度”规定IVM在牛、猪、马、羊等畜肉中的MRL为10~100 μg/kg[6-7,9]。但IVM会通过动物饲料中添加、动物寄生虫预防和治疗等途径导致家畜体内IVM残留,经食物链进入人体,若长期误食含有IVM残留的家畜肉,将导致人体神经系统及生殖系统紊乱[12-14],甚至威胁人类健康。因此,研究畜肉中IVM残留量检测方法对于指导IVM的安全及合理使用具有重要意义。
目前,IVM残留量的测定方法有酶联免疫吸附法[15-16]、液相色谱法[17-19]和高效液相色谱-质谱联用法[20-22],其中酶联免疫吸附法仪器简单易携、灵敏度高,但易出现假阳性,液相色谱-荧光法样品前处理繁琐,需衍生化,且灵敏度不高[23-24],高效液相色谱-质谱联用法具有高灵敏度、高选择性、抗干扰能力强等优点,已成为药物残留分析研究中不可或缺的技术[25-26]。QuEChERS(quick, easy, cheap, effective, rugged, safe)是一种样品快速前处理技术[27-29],具有回收率高、精确度高、操作简便等优势[30]。本研究采用QuEChERS技术提取牛肉、猪肉、马肉、山羊肉和绵羊肉中的IVM,经碱性氧化铝固相萃取柱净化后氮吹浓缩,以乙腈和2.5 mmol/L乙酸铵水溶液为流动相,经Kinetex C18色谱柱洗脱分离,采用电喷雾离子源(electron spray ionization,ESI),多反应监测(multiple reaction monitoring,MRM)正离子模式进行分析,建立超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法测定畜肉中IVM含量的分析方法,提供准确度高、灵敏度好的检测技术,为畜牧养殖和畜肉质量安全提供保障。
1 材料与方法
1.1 材料与试剂
IVM标准物质(纯度均大于99%) 美国AccuStandard公司;甲醇、乙腈、丙酮、正己烷、乙酸乙酯、二氯甲烷、乙酸铵(均为色谱纯) 美国Tedia公司;其余试剂均为分析纯 天津市科密欧化学试剂有限公司;牛肉、猪肉、马肉、山羊肉、绵羊肉(各6 份) 乌兰察布四子王旗农贸市场。
1.2 仪器与设备
UPLC Xevo TQ MS超高效液相色谱-三重四级杆串联质谱仪 美国Waters公司;S10高速匀浆机 宁波新芝生物科技股份有限公司;CPA324S电子天平、Sartorius arium confort Ⅱ超纯水器 德国Sartorius公司;5810R高速冷冻离心机 德国Eppendorf公司;WH-12水浴氮吹仪 杭州佑宁仪器有限公司;碱性氧化铝固相萃取柱(规格500 mg/6 mL) 天津博纳艾杰尔科技有限公司。
1.3 方法
1.3.1 样品前处理
取新鲜或解冻的畜肉组织,剪碎,10 000 r/min匀浆1 min;准确称取5.0 g匀浆后的畜肉,置于50 mL离心管中,依次加入20 mL纯乙腈、5 g无水硫酸镁、2 g氯化钠和150 mg乙二胺-N-丙基硅烷(ethylenediamine-N-propyl silane,PSA),8 000 r/min匀浆10 min后,10 000 r/min离心5 min;上清液经碱性氧化铝柱净化,收集流出液;用5 mL乙腈淋洗小柱,合并流出液,45 ℃氮吹近干,用乙腈定容至1 mL,0.22 μm微孔有机滤膜过滤,供UPLC-MS/MS测定。
1.3.2 溶液配制
标准储备液:准确称取IVM标准品10 mg,用乙腈溶解并定容至100 mL,配制成质量浓度为100 μg/mL的标准储备液。
1.3.3 液相色谱条件
色谱柱为Kinetex C18(150 mm×2.1 mm,1.7 ?m);流动相A为乙腈,流动相B为2.5 mmol/L乙酸铵水溶液;流速0.2 mL/min;进样量10.0 μL;柱温35 ℃。梯度洗脱程序:0~2.0 min,10%流动相A;2.0~4.0 min,10%~90%流动相A;4.0~5.0 min,90%流动相A;5.0~7.0 min,90%~10%流动相A;7.0~10.0 min,10%流动相A。
1.3.4 质谱条件
离子化模式:ESI,采用正离子扫描模式;采集模式:MRM;离子源温度200 ℃;脱溶剂气温度600 ℃;毛细管电压2.2 kV;碰撞气:氩气(纯度>99.99%);雾化气:氮气(纯度>99.99%),流速3 mL/min;驻留时间0.05 s;定性离子对:890.3/305.1(m/z);定量离子对:890.3/567.4(m/z);锥孔电压50 V;碰撞能量35 eV。
1.4 数据处理
每组实验重复6 次,结果表示为平均值,采用SPSS 16.0软件进行数据分析。
2 结果与分析
2.1 QuEChERS提取溶剂和净化柱的选择
根据IVM的理化性质,结合QuEChERS方法,分析甲醇、乙腈、丙酮、乙酸乙酯、二氯甲烷和正己烷6 种溶剂以及混合型阳离子柱(MCX)、混合型阴离子柱(MAX)、中性氧化铝柱(AluN)、酸性氧化铝柱(AluA)和碱性氧化铝柱(AluB)5 种固相萃取柱对畜肉中IVM的提取和净化效果。结果表明:乙腈、丙酮和乙酸乙酯对畜肉中IVM均具有较好的提取效果,提取回收率为85.7%~98.6%,但甲醇和乙酸乙酯提取液杂质峰较多,后续固相萃取净化效果不理想,这可能是由于畜肉中高含量的脂肪和蛋白质对IVM吸附所致;乙腈提取液杂质峰较少,后续固相萃取净化完全,这可能是由于乙腈极性较大,对畜肉中蛋白质沉淀效果好,提取回收率為98.6%;碱性氧化铝柱对IVM的净化效果最好,加标回收率最高,达99.3%。因此选择乙腈作为提取溶剂,选择碱性氧化铝作为净化柱。
2.2 UPLC色谱柱的选择
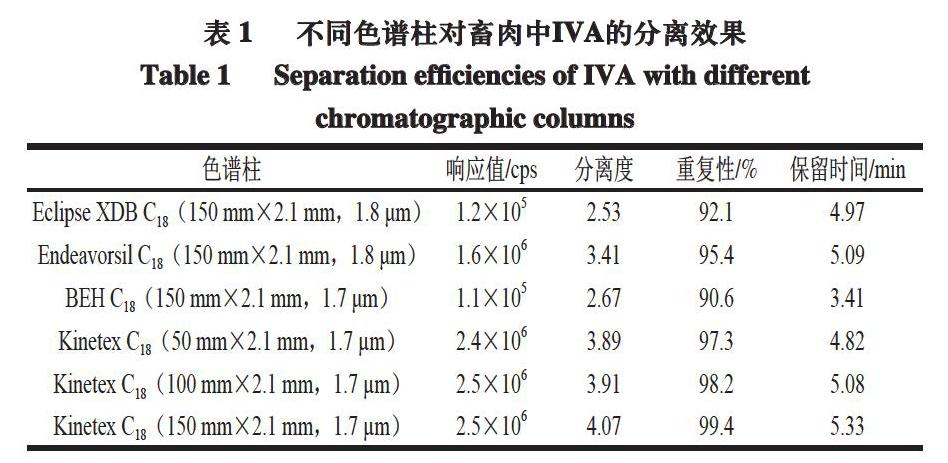
在相同流动相条件下,以色谱柱的IVM色谱响应值、分离度和重复性为指标,分析安捷伦Eclipse XDB C18、迪马Endeavorsil C18、沃特世BEH C18、飞诺美Kinetex C18等不同商品化UPLC柱对畜肉中IVM的分离效果。
由表1可知:采用Kinetex C18色谱柱不仅可以有效分离IVM,而且目标峰响应值高、重复性好;采用相同粒径(1.7 ?m)和内径(2.1 mm)的Kinetex C18色谱柱时,短柱(50、100 mm)分析时间较短,但个别复杂基质样品中目标物的峰形较差,而150 mm柱分析时间适中、重复性好,可有效提高复杂基质样品中共提取基质成分与IVM的分离效果,有效提高IVM的测定准确度和重复性。故分析柱选择Kinetex C18(150 mm×2.1 mm,1.7 ?m)色谱柱。
2.3 流动相的选择
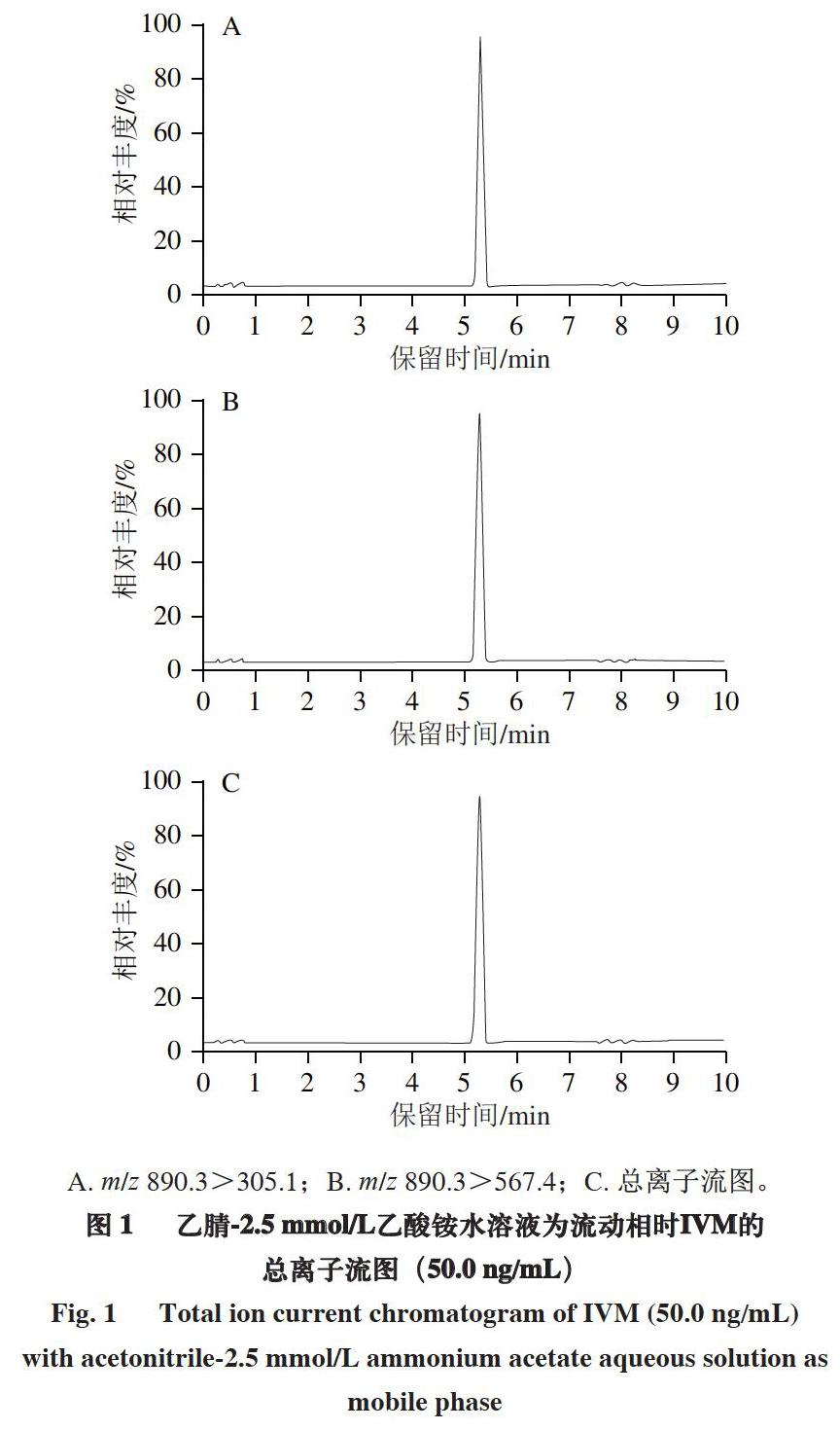
以Kinetex C18色谱柱(150 mm×2.1 mm,1.7 ?m)为分析柱,分析甲醇/乙腈-水、甲醇/乙腈-0.1%甲酸水溶液、甲醇/乙腈-不同浓度(1.5~3.0 mmol/L)乙酸铵溶液等流动相对畜肉中IVM的分离效果及质谱响应情况。由图1可知:有机相选用乙腈比选用甲醇具有更良好的峰形和响应值;水相选用乙酸铵水溶液比纯水、0.1%甲酸水溶液更容易使IVM形成带正电荷的分子离子峰[M+NH4]+,且质谱响应值良好,尤其是采用2.5 mmol/L乙酸铵水溶液时,IVM的分离效果良好,保留时间适中,且色谱峰峰形尖锐、对称。故选择乙腈-2.5 mmol/L乙酸铵水溶液作为流动相。
2.4 质谱条件的优化
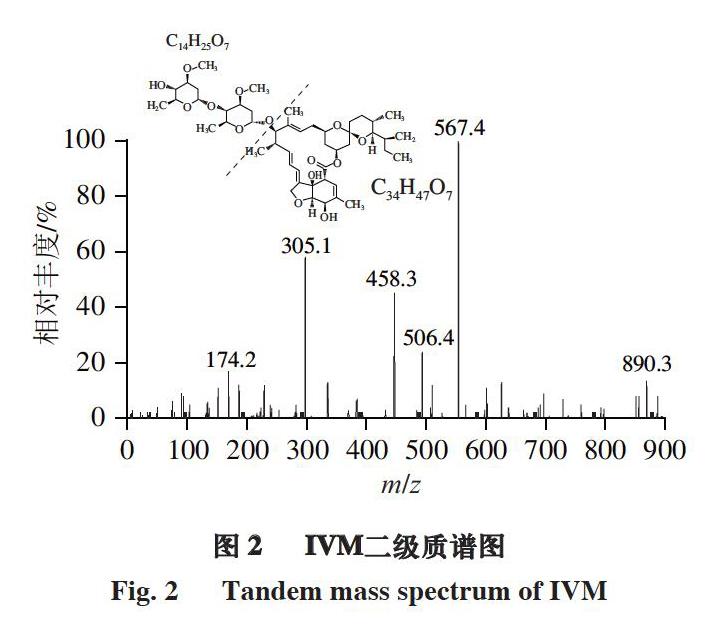
以在线流动注射方式将质量浓度1.0 μg/mL IVM标准溶液注入ESI离子源中,分别在ESI+和ESI-模式下进行质谱分析(母离子扫描)。结果表明:在ESI+模式下可产生带正电荷的分子离子峰[M+H]+、[M+NH4]+、[M+Na]+和[M+H+H2O]+,其中[M+NH4]+分子离子峰响应值高、抗干扰,故选择[M+NH4]+作为母离子(m/z 890.3)(一级质谱分析);对母离子[M+NH4]+进行子离子扫描,优化锥孔电压和碰撞能量,获得相对强度较大的碎片离子m/z 305.1、m/z 307.1和m/z 567.4,其中m/z 305.1结构式可能为C14H25O7,m/z 567.4结构式可能为C34H47O7(二级质谱分析)。结果表明,选择ESI+模式,母离子为m/z 890.3,定性子离子为m/z 305.1;定量子离子为m/z 567.4。
2.5 基质效应(matrix effect,ME)
为提高本研究所建立的UPLC-MS/MS法测定畜肉中IVM的特异性,降低样品基质对IVM测定的干扰,采用标准添加法,用IVM在畜肉和纯乙腈2 种不同基质中的响应值比值(ME=A/B×100%,其中A为畜肉中IVM的响应值,B为纯乙腈中IVM的响应值)来评估ME。若90%
由表2可知,采用本研究所建UPLC-MS/MS法测定IVM的ME为93.4%~104.6%,即不存在基质效应。
2.6 线性范围、检出限与定量限
用不含目标物的空白基质依次配制IVM质量浓度分别为1.0、5.0、50.0、250.0、500.0 ng/mL的标准溶液,按本研究所建立的UPLC-MS/MS法测定,以IVM质谱响应强度(y)为纵坐标,以IVM质量浓度(x)为横坐标,绘制标准曲线。结果表明,在1.0~500.0 ng/mL质量浓度范围内,IVM质谱响应强度与质量浓度呈良好的线性关系,线性回归方程为y=3.24×105x+2.25×103(r=0.999 7)。在不含目标物的空白畜肉基质中添加低添加量的IVM标准物质,采用国际纯粹与应用化学联合会规定的检出限和定量限测定方法,平行测定20 次,以信噪比(RS/N)=3为检出限,RS/N=10为定量限。结果表明,检出限为0.3 μg/kg,定量限为1.0 μg/kg。
2.7 加标回收率和精密度
在不含目标物的空白牛肉、猪肉、马肉、山羊肉、绵羊肉中分别加入IVM标准物质,每种畜肉中IVM添加量分别为1.0、250.0、500.0 μg/kg,按本研究所建立的UPLC-MS/MS法测定加标回收率和精密度(n=6)。
由表3可知,在1.0~500.0 μg/kg添加量范围内,IVM的平均加标回收率为94.7%~97.4%,RSD为1.0%~3.2%。
2.8 实际样品测定与分析
针对随机选购的30 份畜肉,按本研究所建立的UPLC-MS/MS法测定畜肉中IVM含量。由图3可知,30 份被检畜肉中,2 份畜肉检出IVM残留(其余28 份样品检测结果为阴性),检出量分别为5.8、13.7 μg/kg,说明目前所售畜肉中存在IVM残留风险。鉴于IVM在禽畜体内吸收、分布、转化和消除均需要一段時间,为避免畜肉中IVM残留量超标,必须严格执行休药期。
2.9 与现有方法的比较
以使用儀器、分析对象、检出限、回收率和精密度为评估指标,将本研究所建立的UPLC-MS/MS法与现有国家标准及文献报道中的测定方法进行比较。由表4可知,不同方法适用于不同基质样品,本研究所建立的UPLC-MS/MS法在回收率、RSD、检出限等方面均符合方法学要求,且该方法准确度高、精密度好。
3 结 论
采用QuEChERS技术提取畜肉中的IVM,经碱性氧化铝固相萃取柱净化,Kinetex C18色谱柱洗脱分离,建立UPLC-MS/MS法测定畜肉中IVM残留量的分析方法。该方法样品前处理简单、准确度高、精密度好,可为畜牧养殖和畜肉质量安全监控提供检测方法。
参考文献:
[1] 林诗宇, 赵谨, 李霞辉, 等. 注射用伊维菌素混合胶束的急性毒性试验[J]. 四川农业大学学报, 2016, 34(1): 106-109. DOI:10.16036/j.issn.1000-2650.2016.01.019.
[2] GAMBOA G V U, PALMA S D, LIFSCHITZ A, et al. Ivermectin-loaded lipid nanocapsules: toward the development of a new antiparasitic delivery system for veterinary applications[J]. Parasitology Research, 2016, 115(5): 1945-1953. DOI:10.1007/s00436-016-4937-1.
[3] HEDAYATI M, SADEGHI A, MAROUFPOOR M, et al. Transgenerational sublethal effects of abamectin and pyridaben on demographic traits of Phytonemus pallidus (Banks) (Acari: Tarsonemidae)[J]. Ecotoxicology, 2019, 28(4): 467-477. DOI:10.1007/s10646-019-02040-2.
[4] GOBBI F, DORA B, FRANCESCA T, et al. Efficacy of high-dose albendazole with ivermectin for treating imported loiasis, Italy[J]. Emerging Infectious Diseases, 2019, 25(8): 1574-1576. DOI:10.3201/eid2508.190011.
[5] 毕然. 各种氮源物质对阿维链霉菌GB-156发酵生产阿维菌素的影响[J]. 食品与发酵工业, 2006, 37(11): 116-118. DOI:10.3321/j.issn:0253-990X.2006.11.029.
[6] BALKHAIR A, TAHER H B, AL BUSAIDI I, et al. Disseminated strongyloidiasis complicated by alveolar hemorrhage, meningitis, and septic shock treated with albendazole and subcutaneous ivermectin[J]. International Journal of Infectious Diseases, 2019, 86(9): 44-46. DOI:10.1016/j.ijid.2019.06.026.
[7] ISHIKAWA I, IWASA M. Toxicological effect of ivermectin on the survival, reproduction, and feeding activity of four species of dung beetles (Coleoptera: Scarabaeidae and Geotrupidae) in Japan[J]. Bulletin of Entomological Research, 2019, 13(6): 1-9. DOI:10.1017/S0007485319000385.
[8] 冶海珍, 李艳. 羔羊伊维菌素中毒的防治[J]. 养殖与饲料, 2019, 18(6): 97-98. DOI:10.13300/j.cnki.cn42-1648/s.2019.06.046.
[9] 陈吉香, 谢体波, 冯才伟. 阿维菌素、埃比菌素的残留检测[J]. 食品研究与开发, 2018, 39(8): 119-124. DOI:10.3969/j.issn.1005-6521.2018.08.021.
[10] 谢成丽. 伊维菌素治疗牦牛疥螨病的疗效试验[J]. 农业工程技术, 2018, 38(8): 19-20. DOI:10.16815/j.cnki.11-5436/s.2018.08.014.
[11] 朱庆贺, 陈曦, 王丽坤, 等. 伊维菌素微乳的研制及质量评价[J]. 动物医学进展, 2018, 39(1): 67-72. DOI:10.16437/j.cnki.1007-5038.2018.01.012.
[12] BRANCATO A, BROCCA D, CABRERA L C, et al. Modification of the existing maximum residue level for abamectin in citrus fruits[J]. EFSA Journal, 2018, 16(4): 5254-5264. DOI:10.2903/j.efsa.2018.5254.
[13] JENNINA T W, SENAN A, BERMUDEZ I, et al. Species specific RNA A-to-I editing of mosquito RDL modulates GABA potency and influences agonistic, potentiating and antagonistic actions of ivermectin[J]. Insect Biochemistry and Molecular Biology, 2018, 93(2): 1-11. DOI:10.1016/j.ibmb.2017.12.001.
[14] AOYAMA T, UCHIYAMA A, KON K, et al. Ivermectin, an antiparasitic agent, attenuates DDC-induced sclerosing cholangitis with biliary fibrosis in mice[J]. Gastroenterology, 2017, 152(5): 1185-1185. DOI:10.1016/S0016-5085(17)33953-7.
[15] 程茹, 吴玉娥, 陈吉香, 等. ELISA法测定鸡肉和虾肉中阿维菌素类药物的残留[J]. 安徽农业科学, 2018, 46(9): 157-160. DOI:10.13989/j.cnki.0517-6611.2018.09.051.
[16] 李玉立, 陈可心, 唐塔娅, 等. 动物源样品中阿维菌素类药物残留检测方法研究进展[J]. 中国畜牧兽医, 2018, 45(11): 3296-3304. DOI:10.16431/j.cnki.1671-7236.2018.11.038.
[17] 覃国新, 劳水兵, 莫仁甫, 等. 超高效液相色谱法测定甘蓝和橙子中的阿维菌素残留[J]. 现代食品科技, 2018, 34(4): 227-231. DOI:10.13982/j.mfst.1673-9078.2018.04.034.
[18] 周海明. 高效液相色谱-荧光法测定谷物类农产品中阿维菌素、埃瑪菌素和伊维菌素的多残留量[J]. 浙江农业科学, 2011(5): 1134-1138. DOI:10.16178/j.issn.0528-9017.2011.05.037.
[19] 宋永青, 郭文萍. 动物组织中伊维菌素残留量的高效液相色谱法测定[J]. 肉类研究, 2009, 23(5): 51-53. DOI:10.7506/rlyj1001-8123-200905013.
[20] 李光满, 夏明星, 唐璜, 等. 液相色谱-串联质谱法检测食用动物血液中伊维菌素残留[J]. 中国畜牧杂志, 2017, 53(10): 106-109. DOI:10.19556/j.0258-7033.2017-10-106.
[21] DUVAN E H O, YUDY A C O, GUSTAVO A P M. Development and validation of a highly sensitive quantitative/confirmatory method for the determination of ivermectin residues in bovine tissues by UHPLC-MS/MS[J]. Food Chemistry, 2017, 221(4): 891-897. DOI:10.1016/j.foodchem.2016.11.077.
[22] 谭华东, 张汇杰, 武春媛. QuEChERS/UPLC-MS/MS法快速测定土壤中吡虫啉、啶虫脒与阿维菌素残留[J]. 农药, 2019, 58(1): 45-49. DOI:10.16820/j.cnki.1006-0413.2019.01.012.
[23] 中华人民共和国农业部, 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 水产品中阿维菌素和伊维菌素多残留的测定 高效液相色谱法: GB 29695—2013[S]. 北京: 中国标准出版社, 2013.
[24] 赵莉, 谢显传, 占绣萍. 高效液相色谱-荧光法同时检测蔬菜中阿维菌素、甲氨基阿维菌素苯甲酸盐和伊维菌素的多残留量[J].中国农业科学, 2010, 43(16): 3467-3472. DOI:10.3864/j.issn.0578-1752.2010.16.025.
[25] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源性食品中阿维菌素类药物残留量的测定 液相色谱-串联质谱法: GB/T 21320—2007[S]. 北京: 中国标准出版社, 2007.
[26] 熊永, 万亚美, 郭聪聪, 等. 螺虫乙酯·伊维菌素在梨和土壤中的残留分析方法[J]. 河北农业大学学报, 2018, 41(4): 82-86. DOI:10.13320/j.cnki.jauh.2018.0083.
[27] 李丽春, 刘书贵, 尹怡, 等. QuECHRS结合UPLC-MS/MS法测定水产品中酰胺醇类抗生素残留及基质效应[J]. 中国渔业质量与标准, 2018, 8(6): 32-39. DOI:10.3969/j.issn.2095-1833.2018.06.005.
[28] 方从容, 高洁, 王雨昕, 等. QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125 种兽药残留[J]. 色谱, 2018, 36(11): 1119-1131. DOI:10.3724/SP.J.1123.2018.06007.
[29] ARCHIBOLD B K, MARC S H. Validation of a modified QuEChERS method for the analysis of organochlorine pesticides in fatty biological tissues using two-dimensional gas chromatography[J]. Journal of Chromatography B, 2019, 1105(1): 85-92. DOI:10.1016/j.jchromb.2018.12.010.
[30] 王文兰, 刘艳辉, 祖岫杰, 等. 鱼肌肉中阿维菌素和伊维菌素药物残留测定的样品前处理[J]. 分析试验室, 2015, 34(4): 475-479. DOI:10.13595/j.cnki.issn1000-0720.2015.0107.

