D2-40和Prox1在弥漫性躯体性血管角化瘤及匐行性血管瘤中的表达差异
顾安康 陈凤鸣 王雷
空军军医大学第一附属医院皮肤科,西安 710032
顾安康现在天津市中医药研究院附属医院病理科 300120
弥漫性躯体性血管角化瘤(angiokeratoma corporis diffusum,ACD)是特定酶缺乏引起的几种罕见的遗传性溶酶体贮积病的重要皮肤标志,66%的男性和36%的女性溶酶体贮积病患者有该种皮肤表现[1],皮损通常出现于青春期之前,临床表现为针尖大小红褐色角化性丘疹,呈片状分布于腰腹部及其周围。溶酶体贮积病可以多种不同的形式出现,也有患者仅有皮肤损害而无代谢性疾病[2]。匐行性血管瘤(angioma serpiginosum,AS)属于良性血管增生性肿瘤[3],青少年多发,四肢为好发部位,尤其是下肢,皮损特征为红斑基础上出现逐渐增多的针头大小红色丘疹。ACD与AS的皮损表现有一定差别,大多情况下临床可以鉴别,但少数情况下易混淆。国外有文献报道血管角化瘤部分表达淋巴管标记[4-5],可能是淋巴管起源。我们回顾性分析我院确诊的9 例ACD 及6 例AS 临床及病理资料,同时进行血管及淋巴管标记,探讨其能否成为二者鉴别诊断的可靠指标。
对象与方法
一、对象
9例ACD及6例AS患者均为 2006—2017 年第四军医大学西京皮肤医院门诊患者,具有完整、详细的临床及病理资料。所有病例均由两位以上主任医师复核,并根据文献[6]确诊。
二、方法
1.组织切片复核:光镜下观察所有苏木精-伊红(HE)染色切片,评估有无表皮角化过度、棘层增生肥厚、真皮浅层及深层血管改变(扩张亦或增生)、内皮细胞排列和增生情况以及内皮细胞胞质内有无泡沫样物质。
2.免疫组化染色:选用的抗体包括抗CD31(1∶50,Clone JC70A,丹麦Dako 公司)、D2-40(1∶100,Clone D2-40,丹麦Dako 公司)和同源异形盒蛋白1(prospero homeobox protein 1,Prox1,1∶200,polyclone,美国AngioBio公司)抗体。采用瑞士罗氏公司全自动免疫组化仪按照说明书进行染色。每张组化切片中正常淋巴管组织可作为阳性内对照。
结 果
一、临床资料
9 例 ACD 中男 3 例,女 6 例,发病年龄 3 ~ 25(11.67 ± 8.48)岁,发病至确诊时间2 ~ 20(11.78 ±6.82)年。临床以臀部、大腿和躯干多发的小米粒大小的深红色角化性丘疹为特征(图1A),3例患者伴有明显的双侧肢痛,1 例患者的弟弟患相同疾病,1例患者有蛋白尿。
6 例 AS 中,男 3 例,女 3 例,发病年龄 2 ~ 26(17.00 ± 8.94)岁,发病至确诊时间1 ~ 10(6.67 ±3.44)年。皮损位于单侧肢体或躯干部位,呈带状分布或沿Blaschko线分布,以橘红色或红色斑片基础上逐渐增多的针头大小红色丘疹为特征(图2A)。系统检查及血尿常规均未见明显异常。
二、组织病理学表现
9例ACD均表现为真皮乳头管腔扩张,管腔内衬单层内皮细胞,内皮细胞胞质内无泡沫样物质;表皮呈不同程度角化过度及棘层增厚(图1B)。6例AS 表现为真皮乳头层小血管轻度增生,血管内皮轻度增生,周围出现增厚的基底膜(图2B)。
三、免疫组化检测结果
ACD 异常血管免疫组化检测(表1)示9 例CD31 均呈弱阳性或阴性(图1C),4 例D2-40 局灶阳性(图1D),5 例阴性;9 例Prox1 阳性(图1E)。6例AS增生的小血管内皮CD31阳性(图2C),而D2-40(图2D)和Prox1均阴性(图2E)。
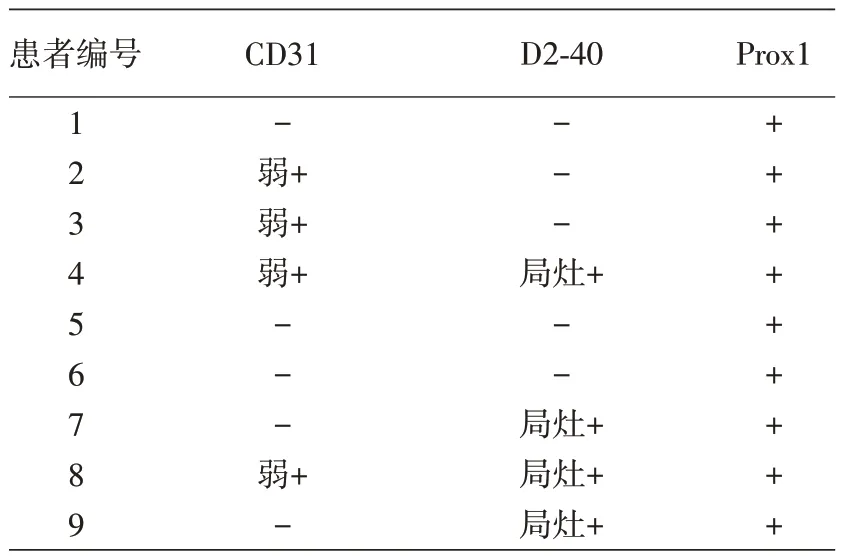
表1 弥漫性躯体性血管角化瘤患者免疫组化特征

图1 弥漫性躯体性血管角化瘤患者临床、组织病理表现及免疫组化染色结果 1A:右侧臀部多发暗红色丘疹;1B:组织病理学检查显示扩张血管伴有角化过度和表皮增生(HE×100);1C ~1E:分别示管腔内皮细胞CD31阳性、D2-40局灶阳性、Prox1核阳性(免疫组化×200)
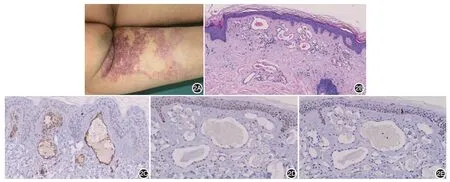
图2 匐行性血管瘤临床、组织病理表现及免疫组化染色结果 2A:左大腿后侧见橘红色斑疹,其上及周围可见针尖大小斑点及丘疹;2B:组织病理学检查显示真皮乳头层轻度增生的小血管,血管内皮轻度增生(HE×100);2C ~2E:分别示管腔内皮细胞CD31阳性以及D2-40和Prox1阴性(免疫组化×200)
讨 论
血管角化瘤为一组异质性疾病,病理表现相似,即真皮乳头血管扩张充血,同时伴有其上表皮的增生和角化过度,然而临床表现差异很大。ACD是溶酶体贮积病显著的皮肤特征,溶酶体贮积病中最常见的是Fabry 病,其他还有岩藻糖苷沉积症、GM1 神经节苷脂贮积病、β 甘露糖苷贮积症等[7]。除Fabry 病外,其他病症都有相关的一些智力受损[2],本文9例患者智力均正常,临床及病理均符合ACD 诊断,因此我们考虑均为Fabry 病,但不能除外未知类型的酶缺陷。Fabry 病的发生与染色体Xq22.1的α-半乳糖苷酶A基因突变有关[7],理论上携带该基因突变(半合子)的男性Fabry病患者都会发病,但是女性患者的发病亦不在少数[7-9],女性(杂合子)表型表现出严重程度的广泛变异,主要是由于女性胚胎的一些或所有细胞中的1 条X 染色体随机失活(里昂假说)[7],症状强度主要取决于酶的残留活性。溶酶体贮积病可以多种不同的形式出现,也有患者仅有皮肤损害而无代谢性疾病的基础。日本的 Yasuike 等[2]报道 18 例无代谢异常的ACD患者,其中有8例女性。本文9例ACD患者中,6例为女性患者,仅3例为男性患者,与既往研究的性别比存在差异,可能与本文病例数偏少有关。
AS是一种发生在真皮浅层和真皮乳头的以毛细血管扩张为表现的罕见血管增生性皮肤病,临床多见于20岁以下女性,多发生在四肢,表现为匐行排列和蔓延的红色或暗红色斑疹,单侧簇集或小片状分布,病程缓慢,压之不褪色。王华等[3]报道19 例AS 患者,以20 岁以下患者为主,但未见明显性别差异;除3 例患者临床初步诊断为AS外,其余大部分患者临床诊断为毛细血管扩张(9例)、血管角化瘤(3例)或血管瘤(3例)。可见,部分AS临床表现缺乏特异性,当ACD 患者皮肤损害亦不典型且不伴代谢性疾病时,通过临床表现及病理学特征鉴别二者比较困难。又因以往研究中被提及的性别差异亦不是二者鉴别诊断的可靠指标[3],找到鉴别诊断的新方法成为迫切需要解决的问题。
国外有文献报道,血管角化瘤部分表达淋巴管标记[4-5],至少在一定程度上显示淋巴管内皮分化。通常情况下,淋巴管管壁内有不连续的平坦内皮细胞以及均质嗜酸性物质,然而在形态学上,我们难以将淋巴管与小静脉或毛细血管区分开。胚胎起源上,淋巴管内皮细胞是从胚胎静脉中分化而来[10],许多增生的淋巴管内含有从交通的血管中迁移过来的红细胞,因此单纯依靠HE 染色区分淋巴管与血管也很难。但是,随着1996 年淋巴管特异性标志血管内皮细胞生长因子C 及其受体血管内皮细胞生长因子3的问世[11],淋巴管研究进入分子时代,淋巴管标记物如podoplanin 和Prox1 可用于定义淋巴管的形态学特征[10]。Prox1是一种转录因子,在淋巴管内皮细胞自胚胎静脉分化的早期阶段起关键作用,并持续存在于成熟的淋巴管内皮细胞中,被认为是一种敏感和特异的淋巴管标志物。podoplanin是在淋巴管内皮细胞中表达的跨膜黏蛋白,不表达于原始的从静脉分化而来的淋巴管内皮细胞,而是表达于成熟的毛细淋巴管及集合淋巴管内皮细胞。D2-40是针对人podoplanin的单克隆抗体,对鉴定淋巴管内皮细胞具有高特异性,但仅具有中等敏感性。Prox1可标记较大的管腔,对大型淋巴管的敏感性高于D2-40[5]。两种标记物均对小淋巴管的内皮细胞具有高度敏感性。在增殖的淋巴管内皮细胞中,D2-40 通常呈局灶性阳性,有时呈阴性,其原因难于解释。一些作者认为不存在纯淋巴管畸形,因为损伤的淋巴管内总是存在正常或异常的静脉元素[12],可能表现出淋巴管标记物的可变表达。我们的结果与以上研究结论相似,9 例ACD中4例D2-40局部阳性,并且所有病例均Prox1阳性,因此提示淋巴谱系。而6 例AS 均显示血管标记阳性而淋巴管标记阴性,提示血管谱系。Wang 等[4]认为 Fabry 病患者 α-半乳糖苷酶 A 缺乏导致神经酰胺三己糖苷(Gb3)等鞘糖脂类物质在各种组织细胞中堆积,可能在血管发育的早期阶段影响内皮细胞向淋巴管分化,但其具体的分子机制尚不清楚。
总之,女性ACD 患者并不少见,性别不能作为其与AS 可靠的鉴别点。大多数情况下ACD 管腔内皮表达淋巴管标记,而AS 管腔内皮表达血管标记,对于不能通过临床病理鉴别的病例,应用淋巴管标记在二者的鉴别诊断上具有明确的意义。
利益冲突所有作者均声明不存在利益冲突

