红景天苷对过氧化氢诱导的人脱落乳牙牙髓干细胞氧化应激损伤的保护作用
李文周 陈艳艳 徐敏 邓祖辉 李一圣

[摘要]目的 探討红景天苷对过氧化氢(H2O2)诱导的人脱落乳牙牙髓干细胞(SHED)氧化应激损伤的保护作用。方法 以H2O2刺激SHED建立氧化应激损伤的细胞模型。实验分为空白对照组、H2O2模型组和红景天苷各剂量组(包括高、中、低剂量组)。以荧光染色剂对细胞进行染色并观察细胞形态变化,酶联免疫吸附法(ELISA)测定细胞丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性,免疫印迹法检测p38和p-p38蛋白的表达情况。结果 显微镜下观察,H2O2模型组的细胞变形明显,部分细胞脱落悬浮于培养液中;红景天苷低剂量组的细胞变形程度轻于H2O2模型组,脱落悬浮细胞较少;红景天苷高剂量组的细胞形态更趋于正常形态,脱落少见。H2O2模型组、红景天苷各剂量组的MDA含量均显著高于空白对照组,且红景天苷各剂量组的MDA含量均显著低于H2O2模型组,差异有统计学意义(P<0.01)。H2O2模型组、红景天苷各剂量组的SOD活性均低于空白对照组,差异有统计学意义(P<0.05);红景天苷低剂量组的SOD活性与H2O2模型组比较,差异无统计学意义(P>0.05);红景天苷高、中剂量组的SOD活性均高于H2O2模型组,差异有统计学意义(P<0.05)。H2O2模型组、红景天苷低剂量组的p38蛋白磷酸化水平高于空白对照组,差异有统计学意义(P<0.01);红景天苷高剂量组的p38蛋白磷酸化水平低于H2O2模型组,差异有统计学意义(P<0.05)。结论 红景天苷可保护SHED,减轻H2O2诱导的氧化应激损伤,其机制与抑制p38蛋白磷酸化有关。
[关键词]红景天苷;过氧化氢;人脱落乳牙牙髓干细胞;氧化应激
[中图分类号] R979.7 [文献标识码] A [文章编号] 1674-4721(2019)10(a)-0020-04
[Abstract] Objective To investigate the protective effect of salidroside on oxidative stress injury of stem cells from human deciduous teeth (SHED) induced by hydrogen peroxide (H2O2). Methods SHED were treated with H2O2 to build the oxidative stress cell model, and the cells were divided into control group, H2O2 group and each dose group of salidroside (including high dose, medium dose and low dose groups). The cell morphology was observed under microscope after treatment with fluorescence staining. The malondialdehyde (MDA) content and superoxide dismutase (SOD) activity were determined by ELISA, and the expression of p38 and p-p38 proteins were detected using Western blot. Results Microscopically, the cells in H2O2 model group were obviously deformed and some cells were suspended in the culture solution. The cell deformation degree of salidroside low dose group was lighter than that of H2O2 model group, and the number of exfoliated suspended cells was less. The cell morphology in high dose group of salidroside tends to normal morphology, and shedding was rare. The MDA content in H2O2 model group and salidroside dose group were significantly higher than that in blank control group, and the MDA content in salidroside dose group was significantly lower than that in H2O2 model group, the differences were statistically significant (P<0.01). The SOD activity of H2O2 model group and salidroside in each dose group were lower than those of blank control group, and the differences were statistically significant (P<0.05). There was no significant difference in SOD activity between low dose salidroside group and H2O2 model group (P>0.05). The SOD activity in high and medium dose groups of salidroside were higher than those in H2O2 model group, and the differences were statistically significant (P<0.05). The phosphorylation level of p38 protein in H2O2 model group and salidroside low dose group were higher than those in blank control group, the differences were statistically significant (P<0.01). The phosphorylation level of p38 protein in salidroside high dose group was lower than that in H2O2 model group, and the difference was statistically significant (P<0.05). Conclusion Salidroside protect against SHED oxidative stress injury induced by H2O2 partly through inhibiting p38 phosphorylation.
[Key words] Salidroside; Hydrogen peroxide; Stem cells from human exfoliated deciduous teeth; Oxidative stress
人脱落乳牙牙髓干细胞(stem cells from human exfoliated deciduous teeth,SHED)是从脱落乳牙的牙髓中分离得到的一种具有高度增殖能力和多向分化能力的干细胞,其在组织工程和再生医学领域具有良好的应用潜力,因此颇受关注[1]。干细胞的增殖和分化能力受环境影响甚大,其中氧自由基可对牙髓干细胞的分化和自我更新潜力产生不良影响[2],因此,考察氧化应激对SHED的影响并寻找可行的干预措施具有重要意义。红景天生长于高山地区,具有益气活血、通脉平喘之功效[3],为临床常用药,红景天苷为其主要活性成分之一[4]。据报道,红景天苷具有调节免疫系统、抗疲劳等药理作用,对多系统细胞氧化及细胞衰老具有抵抗作用[5]。本实验以过氧化氢刺激SHED,构建氧化应激损伤的细胞模型,研究红景天苷对SHED氧化应激损伤的保护作用,为SHED的研究及应用提供支持,报道如下。
1材料与方法
1.1材料
红景天苷购于中国食品药品检定研究院,加少量二甲亚砜溶解,再加培养基稀释成1 mg/ml的溶液;SHED由深圳市龙岗区耳鼻咽喉医院口腔研究所分离得到;最小必需培养基(MEM-α)、胎牛血清、双抗和胰酶消化液均为Gibco产品;3% H2O2为广东恒健制药有限公司产品;蛋白定量试剂盒、荧光染色剂(C10045)均购于赛默飞世尔有限公司;磷酸缓冲盐溶液(PBS,pH 7.4)和细胞裂解液购于上海生工生物工程股份有限公司;超氧化物歧化酶(SOD)(WST-1法)和细胞丙二醛(MDA)(微板法)的ELISA试剂盒购于南京建成生物工程研究所;p38和p-p38抗体购于德国CST股份公司。
1.2方法
1.2.1实验分组及处理 实验分为空白对照组、H2O2模型组、红景天苷低剂量组、中剂量组和高剂量组。细胞在含10%胎牛血清和1%双抗的MEM-α培养液、37℃、饱和湿度、5% CO2的条件下培养[6],传代两次后,取对数生长期细胞用于实验。空白对照组含正常细胞和基础培养液,H2O2模型组在此基础上加入H2O2(终浓度400 μmol/L,下同)进行刺激,红景天苷各剂量组细胞于接种4 h后,加红景天苷(低、中、高剂量组终浓度分别为10、20和40 μg/ml)共培养,测定指标前加入H2O2刺激2 h。
1.2.2细胞形态观察 将SHED按1×104细胞/孔的密度接种于24孔板中,每组设3个复孔,置于细胞培养箱中,4 h后红景天苷组加入不同剂量红景天苷,继续培养24 h,H2O2模型组和红景天苷组均加入H2O2刺激2 h,弃去培养液,PBS洗3次,荧光染色剂染色,再加PBS洗3次,荧光显微镜下观察各组细胞行态,拍照。
1.2.3 ELISA法检测各组细胞的SOD活性和MDA含量 取生长良好的SHED,以0.5×105细胞/ml密度接种于96孔板,每孔200 μl,按“1.2.1”项下方法分组和处理,每组设5个复孔,按照试剂盒说明书,取培养上清液用于测定SOD活性。另将细胞接种于24孔板中,相同方法处理,最后弃去培养上清液,将细胞刮下,按照说明书方法,测定MDA含量。
1.2.4 免疫印迹法(Western blot)检测p38和p-p38蛋白的表达 取生长良好的SHED接种于6孔板中,按照“1.2.1”项下方法分组和处理,每组设3个复孔,处理完成后弃去上层培养液,PBS洗净细胞,提取细胞蛋白,按蛋白浓度测定试剂盒方法测定蛋白浓度,Western blot检测p38和p-p38蛋白的表达情况,并以p-p38/p38相对灰度值为指标,比较不同分组p38蛋白磷酸化水平。
1.3统计学方法
采用Graph Pad Prism 7软件进行数据统计学分析并绘图,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1各组SHED形态观察结果
荧光显微镜下观察经不同方法处理的SHED,结果提示,空白对照组细胞形态舒展,贴壁好;H2O2模型组细胞紧缩变形,部分细胞脱落悬浮于培养液中;红景天苷低剂量组细胞变形程度轻于H2O2模型组,脱落悬浮细胞较少;红景天苷高剂量组细胞形态更趋于正常状态,脱落情况少见(图1,见封三)。
2.2各组MDA含量和SOD活性测定结果的比较
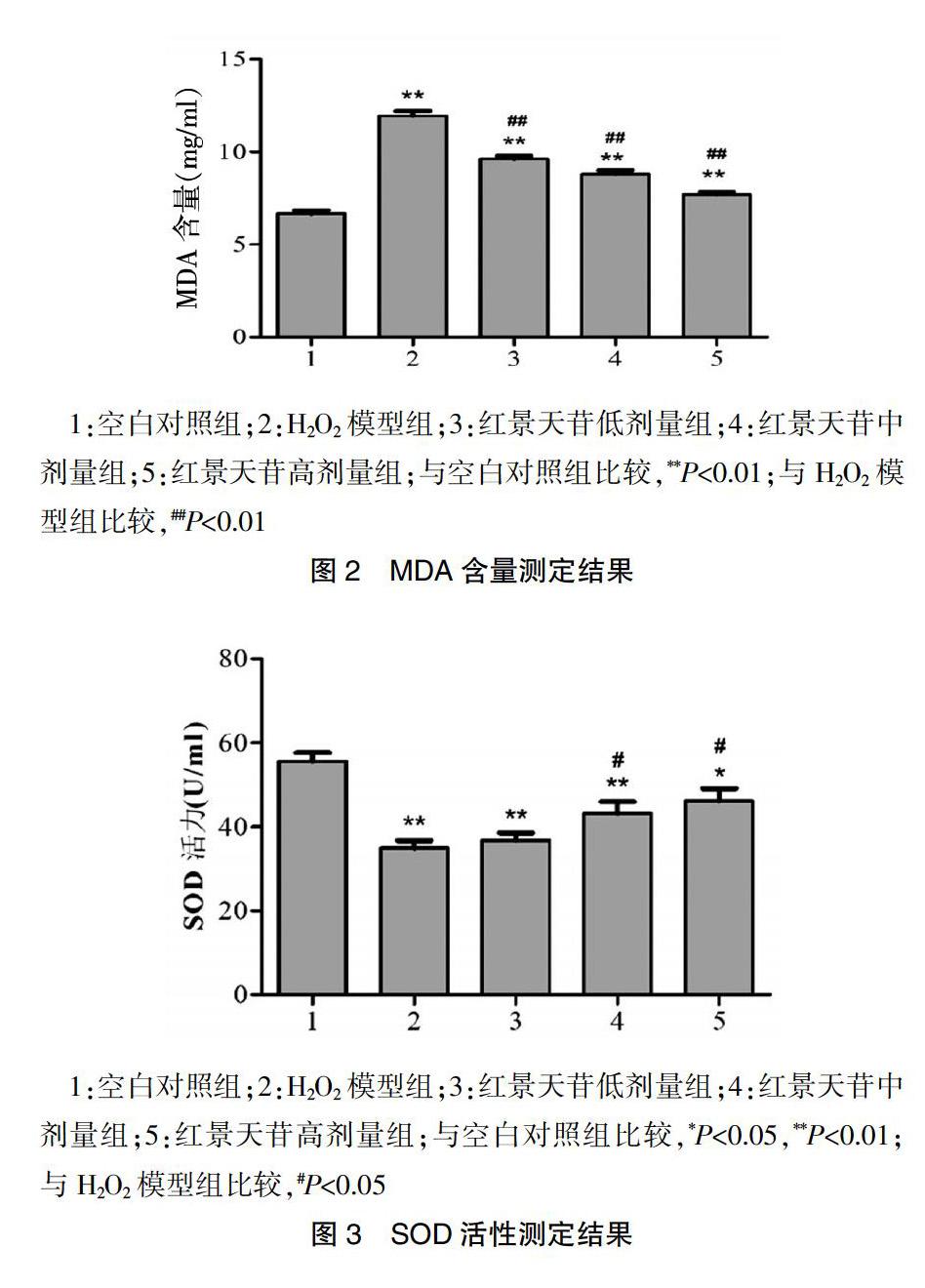
ELISA测定结果提示,H2O2模型组、红景天苷各剂量组的MDA含量均显著高于空白對照组,且红景天苷各剂量组的MDA含量均显著低于H2O2模型组,差异有统计学意义(P<0.01)(图2)。
SOD活性测症结果提示,H2O2模型组、红景天苷各剂量组的SOD活性均低于空白对照组,差异有统计学意义(P<0.05);红景天苷低剂量组的SOD活性与H2O2模型组比较,差异无统计学意义(P>0.05);红景天苷高、中剂量组的SOD活性均高于H2O2模型组,差异有统计学意义(P<0.05)(图3)。
2.3相关蛋白表达情况测定结果
Western blot结果提示,H2O2模型组、红景天苷低剂量组的p38蛋白磷酸化水平高于空白对照组,差异有统计学意义(P<0.01);红景天苷高剂量组的p38蛋白磷酸化水平低于H2O2模型组,差异有统计学意义(P<0.05)(图4、5)。
3讨论
由于SHED具有高度增殖、多向分化能力和易获得的特征,有学者认为其是可以在组织工程和再生医学领域发挥重要作用的最佳干细胞[7]。目前SHED已被成功诱导为成骨细胞、牙本质细胞、软骨细胞和神经细胞等。动物实验也显示,SHED在不同部位缺损骨组织的修复中起到了出色的作用,展示了其在组织修复方面的应用潜力[1],颇受学者关注。
氧化应激是由体内产生过量的活性氧(ROS)和活性氮(RNS)而导致[8],过量的活性自由基使体内氧化与抗氧化作用失衡,产生较大量氧化中间产物,从而对细胞和组织产生不良影响[9]。研究表明,氧化应激与多种疾病的发生和发展密切相关,干细胞生长、组织修复过程中也伴随着氧化应激的影响[10-12]。那么,SHED生长过程中是否也易受氧化应激的影响?红景天苷是否具有相应的保护作用?为探讨上述问题,首先需要建立氧化应激损伤的细胞模型。通过查阅文献发现,相关研究较常见的是H2O2氧化损伤模型。H2O2作为一种活性小分子,易于透过各种生物膜进入细胞内,发生反应并生成高活性的自由基,引发氧化应激反应[13-14]。关于H2O2的浓度和作用时间,针对不同细胞,文献报道及实验研究结果也各不相同[15-16]。因此,本研究进行了相关的预实验,用H2O2 100、200、400和500 μmol/L等不同浓度,分别刺激1、2、3、4和5 h,观察细胞形态变化,并最终选择了400 μmol/L作用2 h。本研究的预实验还考察了红景天苷对SHED存活率的影响,观察其对细胞的毒性作用,结果提示,红景天苷在本研究所设定的浓度下,并未降低细胞存活率,表明其对SHED不具有明显毒性。本研究通过对细胞的形态学观察,结果提示,红景天苷对H2O2所致的细胞损伤具有保护作用,ELISA测定结果提示红景天苷抑制H2O2诱导的MDA升高和SOD下降,印证了这一作用。
参与氧化应激的细胞通路较多,丝裂原活化蛋白激酶(MAPK)信号通路是其中最重要的通路之一[17],该通路在细胞増殖、分化、死亡等生命过程中有重要作用,已被证实与多种疾病的发生发展有关[18-19]。p38是MAPK家族的一个主要成员,其被定义为刺激应答激酶,参与了细胞凋亡的调控[20]。有研究报道[21],p38能被H2O2所激活,从而在H2O2诱导的细胞氧化应激损伤过程中起关键作用。因此,本研究通过观察p38和p-p38的蛋白表达情况发现,H2O2诱导p38蛋白磷酸化表达,而红景天苷对此具有抑制作用。
综上所述,本研究证实了氧化应激对SHED的损伤作用,以及红景天苷对该损伤的保护作用,并发现这种保护作用与红景天苷抑制H2O2诱导的p38磷酸化表达有关,但更进一步的作用机制仍有待继续研究。
[参考文献]
[1]Saez DM,Sasaki RT,Da Costa NA,et al.Stem cells from human exfoliated deciduous teeth: a growing literature[J].Cells Tissues Organs,2016,202(5-6):269-280.
[2]Choi YJ,Lee JY,Chung CP,et al.Cell-penetrating superoxide dismutase attenuates oxidative stress-induced senescence by regulating the p53-p21 Cip1 pathway and restores osteoblastic differentiation in human dental pulp stem cells[J].Int J Nanomed,2012,7:5091.
[3]国家药典委员会.中国药典2015年版(一部)[S].北京:中国医药科技出版社,2015:154-155.
[4]李雪彤,吴委林,权伍荣.红景天属药用植物研究进展[J].延边大学农学学报,2018,40(4):83-90.
[5]孙安琪,颜天华,巨修练.红景天苷药理作用及分子机制的研究进展[J].时珍国医国药,2018,29(6):1440-1443.
[6]Gong T,Heng BC,Xu J,et al.Decellularized extracellular matrix of human umbilical vein endothelial cells promotes endothelial differentiation of stem cells from exfoliated deciduous teeth[J].J Biomed Mater Res A,2017,105(4):1083-1093.
[7]Nakamura S,Yamada Y,Katagiri W,et al.Stem cell proliferation pathways comparison between human exfoliated deciduous teeth and dental pulp stem cells by gene expression profile from promising dental pulp[J].J Endod,2009,35(11):1536-1542.
[8]Dai P,Mao Y,Sun X,et al.Attenuation of oxidative stress-induced osteoblast apoptosis by curcumin is associated with preservation of mitochondrial functions and increased Akt-GSK3β signaling[J].Cell Physiol Biochem,2017,41(2):661-677.
[9]田晓华.氧化應激与细胞凋亡[M].国外医学(卫生学分册),1997,2:6-10.
[10]陈君婷,张静莹.氧化应激对人源牙髓干细胞的影响:组织修复应用中的关键问题[J].中国组织工程研究,2018,22(17):2755-2760.
[11]徐克,冯桂娟,冯兴梅,等.过氧化氢刺激人牙髓干细胞的衰老进程[J].中国组织工程研究,2016,20(10):1481-1487.
[12]汪文婧,陈旭昕,韩志海.干细胞衰老机制及应对策略的研究进展[J].转化医学杂志,2016,5(4):253-257.
[13]张斌,夏作理,赵晓民,等.氧化应激模型的建立及其评价[J].中国临床康复,2006,44:112-114.
[14]何方婷,陈嘉熠,徐佳伊,等.氧化应激细胞模型建立的研究进展[J].食品工业科技,2019,40(7):341-345.
[15]常小洁,郭奇桑,李笑天.过氧化氢诱导人胎盘滋养细胞HTR-8/SVneo氧化应激模型的建立[J].复旦学报(医学版),2014,41(1):40-46.
[16]林文新,马阮昕,冯真英.川芎嗪对过氧化氢诱导PC12细胞氧化应激的作用[J].江西中医药,2018,49(2):29-31.
[17]Arimoto K,Fukuda H,Imajoh-Ohmi S,et al.Formation of stress granules inhibits apoptosis by suppressing stress-responsive MAPK pathways[J].Nat Cell Biol,2008,10(11):1324.
[18]胡彦武.基于MAPK信号通路的淫羊藿苷抗动脉粥样硬化作用及机制研究[D].长春:吉林大学,2016.
[19]聂黎黎.MAPK在骨髓间充质干细胞信号转导机制中的作用[D].长春:吉林大学,2013.
[20]Chen K,Lu Y,Liu C,et al.Morroniside prevents H2O2 or Aβ1-42-induced apoptosis via attenuating JNK and p38 MAPK phosphorylation[J].Eur J Pharmacol,2018,834:295-304.
[21]杨东雪.白藜芦醇对过氧化氢诱导的IPEC-J2细胞凋亡的保护作用[D].长春:吉林大学,2017.
(收稿日期:2019-04-30 本文編辑:孟庆卿)

