PVA@Au凝胶催化剂还原4-硝基苯酚的影响因素
秦少龙 杨晓娇 周元林 王善强
(1.西南科技大学环境友好能源材料国家重点实验室 四川绵阳 621010;2.中国工程物理研究院材料研究所四川绵阳 621908;3.国民核生化灾害防护国家重点实验室 北京 102205)
在工业发达的今天,催化剂是高科技行业之一,在国民经济中有着举足轻重的地位。当新的催化剂和新的催化工艺出现时,都会在石油、化工、能源等重要行业引起重大的工艺技术革新,大大降低生产成本。
由于金属催化剂纳米颗粒尺寸小、表面能高,这就导致纳米粒容易出现团聚现象。为了解决团聚问题,通常需要用稳定剂来稳定金属纳米粒子。聚乙烯醇(PVA)是一种具有较高兼容性、无毒、水溶性的富含羟基的聚合物,容易与不同的交联剂发生交联反应形成凝胶[1]。通过在聚乙烯醇高分子链上引入炔基,使其炔基功能化,可以得到一种新的稳定剂[2]。为了方便催化剂的回收与分离,许多科研工作者会引入一些载体负载在纳米金属上,常用的载体有碳 纳 米 管[3]、石 墨 烯[4]、金 属 氧 化 物[5](如Fe3O4)、介孔硅类[6]、高分子聚合物[7]等,这不仅可以提高催化剂的催化性能,也可以减少催化剂的用量。由于贵金属优异的催化活性,可以催化一些难以发生的化学反应,如氧化反应[8]、还原反应[9]、各类偶联反应[10]等。本实验通过调控Au纳米粒子粒径获得小粒径PVA@Au凝胶催化剂,并用其催化4-硝基苯酚还原反应研究其催化活性。
1 实验部分
1.1 材料与仪器
聚乙烯醇(PVA):醇解度78%,MW=6 000,分析纯,Acros;炔丙胺:分析纯,Accela;N,N-羰基二咪唑(CDI):分析纯Alfa Aesar;N,N-二甲基甲酰胺(DMF):分析纯,阿拉丁,氢化钙搅拌过夜后减压蒸馏;乙醇:分析纯,阿拉丁;硼氢化钠(NaBH4):分析纯,阿拉丁;四氯金酸:分析纯,阿拉丁;4-硝基苯酚:分析纯,阿尔法;浓盐酸:分析,国药化学集团有限公司;氢氧化钠:分析纯,国药化学集团有限公司;多壁碳纳米管(MWCNT):TNM1,中时代;石墨烯粉末:德阳稀碳科技有限公司;实验室用水为去离子水。
紫外可见分光光度计:HIMADZU UV-1800型,岛津(香港)有限公司;pH计:HS-25,上海仪电科学仪器股份有限公司;高速离心机:TG16-WS型,湖南湘仪实验室仪器开发有限公司;超高分辨场发射透射电子显微镜:Libra200,德国Carl zeissirts公司。红外光谱仪:Nicolet-5700,美国Nicolet公司。
1.2 PVA@Au凝胶催化剂的制备[2]
称取50 mg聚乙烯醇置于50 mL的三口烧瓶中,通入氮气以排尽装置中的空气。注入2 mL经氢化钙处理过的DMF于三口烧瓶中,油浴加热(85℃)并不断搅拌直到聚乙烯醇完全溶解为止。待冷却至室温后加入90 mg CDI,在室温下磁力搅拌3 h,然后加入20 mg炔丙胺,再搅拌16 h。反应结束后,用吸管将三口烧瓶中的反应液吸出,滴入盛有50 mL装有乙醇溶液的烧杯中,不断搅拌直至产物全部析出为止,用乙醇溶液多次清洗并过滤,将滤渣真空干燥后得到白色絮状的固体产物。将固体产物溶于5 mL DMF溶液中,然后加入11.5 mg(0.034 mmol)四氯金酸,在室温下放置24 h,待深褐色凝胶形成后,再加12.9 mg(0.34 mmol)硼氢化钠还原,多次洗涤、过滤、烘干,得到炔基化后的PVA@Au催化剂,其结构设计如图1所示。

图1 PVA@Au结构设计Fig.1 PVA@Au structural design
1.3 羟基化MXene(Ti4C3)的制备
用无氧水配置质量分数为5% KOH,投加MXene超声混匀,室温下振荡器180 r/min震荡2 h过滤,再将滤渣反复洗涤过滤,最后将滤渣放入真空干燥箱中烘干。
1.4 PVA@Au/载体的制备
将1 mg PVA@Au催化剂分别与9 mg石墨烯、羟基化MXene(Ti4C3)、多壁碳纳米管(MWCNT)混合研磨30 min。
1.5 4-硝基苯酚还原反应
由于PVA@Au粉末不溶于水,故将0.68 mg PVA@Au粉末分散于5 mL去离子水中,超声30 min,再磁力搅拌20 min,移取0.5 mL于5 mL比色皿中,再加入2 mL 0.187 5 mmol/L 4-硝基苯酚溶液和4.5 mg硼氢化钠,NaBH4还原过程见图2。通过紫外分光光度计监测反应过程(3 min扫描一次)。
图2 NaBH 4还原过程Fig.2 Reduction process of NaBH4
分别称取1.1 mg PVA@Au/石墨烯、PVA@Au/羟基化MXene(Ti3C2)和PVA@Au/多壁碳纳米管于5 mL比色皿中,并加入2.5 mL 0.15 mmol/L 4-硝基苯酚溶液和4.5 mg硼氢化钠,通过紫外分光光度计监测反应过程(3 min扫描一次)。
1.6 测试与表征方法
红外光谱测试:通过红外光谱仪对PVA@Au结构进行表征。
TEM测试:取少许PVA@Au分散在无水乙醇中,超声一段时间,再把分散液滴少许在铜网上烘干,进行TEM测试。
2 结果与讨论
2.1 结构分析
通过红外光谱对PVA@Au结构分析可知(图3(a)):聚乙烯醇分子链上引入炔基后在2 100 cm-1左右处的波峰消失,说明聚乙烯醇与炔丙胺发生反应,在聚乙烯醇高分子链上成功引入炔基。通过TEM对PVA@Au的表征可以直观地观察到形貌和粒径分布,Au纳米粒子成功地分散在PVA高分子凝胶上,呈均一分布,粒径约为5 nm,无明显的团聚现象(图3(b))。

图3 PVA@Au的红外光谱图和TEM图Fig.3 IR analysis of PVA@Au and TEM image
2.2 4-硝基苯酚的还原反应
该反应是在金属纳米颗粒表面进行,常用来测试纳米金属颗粒催化剂的活性,因此在反应中用过量的硼氢化钠(NaBH4)作为还原剂,在室温下测试PVA@Au把4-硝基苯酚还原成4-氨基苯酚的催化活性。该反应过程由紫外可见光分光光度计监测。在4-硝基苯酚溶液中加入NaBH4后,4-硝基酚离子的形成使溶液从亮黄色变成深黄色,这时在317 nm处的特征波峰发生红移,在400 nm处产生新的特征峰,吸光度也增强(图4)。

图4 4-硝基苯酚溶液加入NaBH 4前后紫外光谱图Fig.4 UV-vis spectra of 4-nitrophenol in aqueous solution before and after adding NaBH4 solution
由于硝基酚盐离子在碱性介质中的存在,引起电子带在λ=400 nm处吸收率降低。随着产物4-氨基苯酚的生成,在λ=300 nm处可以看见伴随着波峰的增加[11]。该催化反应机制也可由Langmuir-Hinshelwood模型来解释[12](图5)。

图5 4-硝基苯酚在纳米金颗粒表面还原反应的Langmuir-Hinshelwood模型Fig.5 Scheme of the Langmuir-Hinshelwood mechanism for the reduction of 4-nitrophenol on the surface of the Au nanoparticles
2.2.1 PVA@Au还原4-硝基苯酚
图6 所示为一段时间内PVA@Au催化还原4-硝基苯酚的紫外光谱图。从图中可以看出,在400 nm特征峰处吸光度下降的趋势比较慢,表示PVA@Au凝胶催化剂在催化4-硝基苯酚还原反应中的催化性能并不理想,因此,考虑通过引入载体来提高其催化活性,同时有利于产物和催化剂的分离和回收利用。
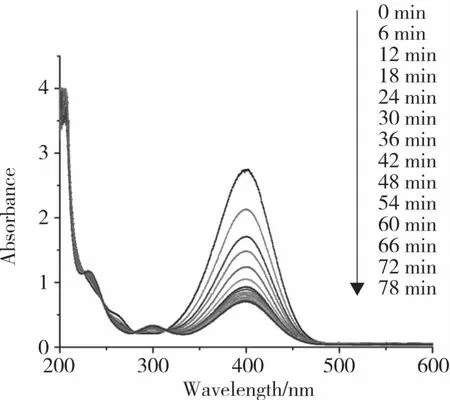
图6 PVA@Au催化4-硝基苯酚还原紫外光谱Fig.6 UV-vis spectra for the reduction of 4-nitrophenol catalyzed with PVA@Au
2.2.2 载体对PVA@Au还原4-硝基苯酚的影响
在本实验中用石墨烯、羟基化MXene(Ti4C3)、多壁碳纳米管为载体来探究3种载体对PVA@Au催化性能的影响。从图7(a)、图7(b)的紫外光谱图可以看出,在60 min内石墨烯、羟基化MXene(Ti4C3)并没有使PVA@Au催化还原4-硝基苯酚的反应结束,故催化性能未得到明显提高。从图7(c)可以看出多壁碳纳米管使PVA@Au的催化性能得到明显提高,只要15 min就可以完全反应,因此,多壁碳纳米管是3种载体中比较理想的载体。

图7 不同载体催化还原4-硝基苯酚的紫外光谱Fig.7 UV-vis spectra for the reduction of 4-nitrophenol catalyzed with different carriers
2.2.3 PVA@Au/MWCNT不同用量对4-硝基苯酚还原反应的影响
从图8可以看出,当催化剂加入后,随着反应的进行,在400 nm处的特征峰不断降低,表示反应物在催化剂的作用下逐渐被硼氢化钠还原,在300 nm处的特征峰不断增强,表示随着反应的进行有大量的4-氨基苯酚生成,当400 nm处吸光度为零和300 nm处吸光度不再发生变化时,表明4-硝基苯酚已经完全还原成4-氨基苯酚。另外,从紫外光谱可以看出,在400 nm处波峰刚开始下降趋势比较慢,随着反应进行波峰下降趋势变快,反应到一定程度后波峰下降趋势变慢,说明PVA@Au/MWCNT在催化还原4-硝基苯酚反应中存在明显的诱导期。
相对于4-硝基苯酚浓度而言,硼氢化钠是过量的,还原速率可以视为与其浓度无关。可以将PVA@Au/MWCNT催化还原4-硝基苯酚反应视为伪一级反应,遵循一级动力学定律。因此,ln(Ct/C0)与时间t呈线性关系(图9)。由于4-硝基苯酚吸光度与其浓度成正比,即ln(Ct/C0)=-kt与ln(At/A0)=-kt等价(Ct表示t时刻4-硝基苯酚浓度,C0表示4-硝基苯酚初始浓度,At表示t时刻的吸光度,A0表示t=0时的吸光度),故对其稳定期进行一次线性拟合,得到速率常数k值。
从图9所示的散点图可以看出,加入PVA@Au/MWCNT催化剂之后,存在一段诱导反应时间ti,10%,8%(图8(a),图8(b))诱导反应时间ti=3 min,6%,4%,2%(图8(c),图8(d),图8(e))诱导反应时间ti=6 min,在这段反应时间内ln(At/A0)散点下降的趋势比较慢,过了诱导反应时间之后,就趋于一条直线,遵循一级反应动力学定律。有文献报道[13-14],有些贵重金属也表现出诱导效应,这通常是因为:在催化4-硝基苯酚还原反应中,开始反应前反应物吸附到催化剂表面需要扩散时间。有学者认为在诱导时间内原子表面重新排列,将金属纳米粒子转化为一种活性催化剂[15],还有学者认为这段时间是留给硼氢化钠用来清除纳米粒子表面氧化物[16]。总之,随着催化剂用量降低,完全反应所需要的时间也就越长,速率常数k也随之变小。

图8 不同质量分数PVA@Au/MWCNT催化还原4-硝基苯酚的紫外光谱Fig.8 UV-vis spectrra of catalytic reduction of 4-nitrophenol by different mass fraction of PVA@Au/MWCNT
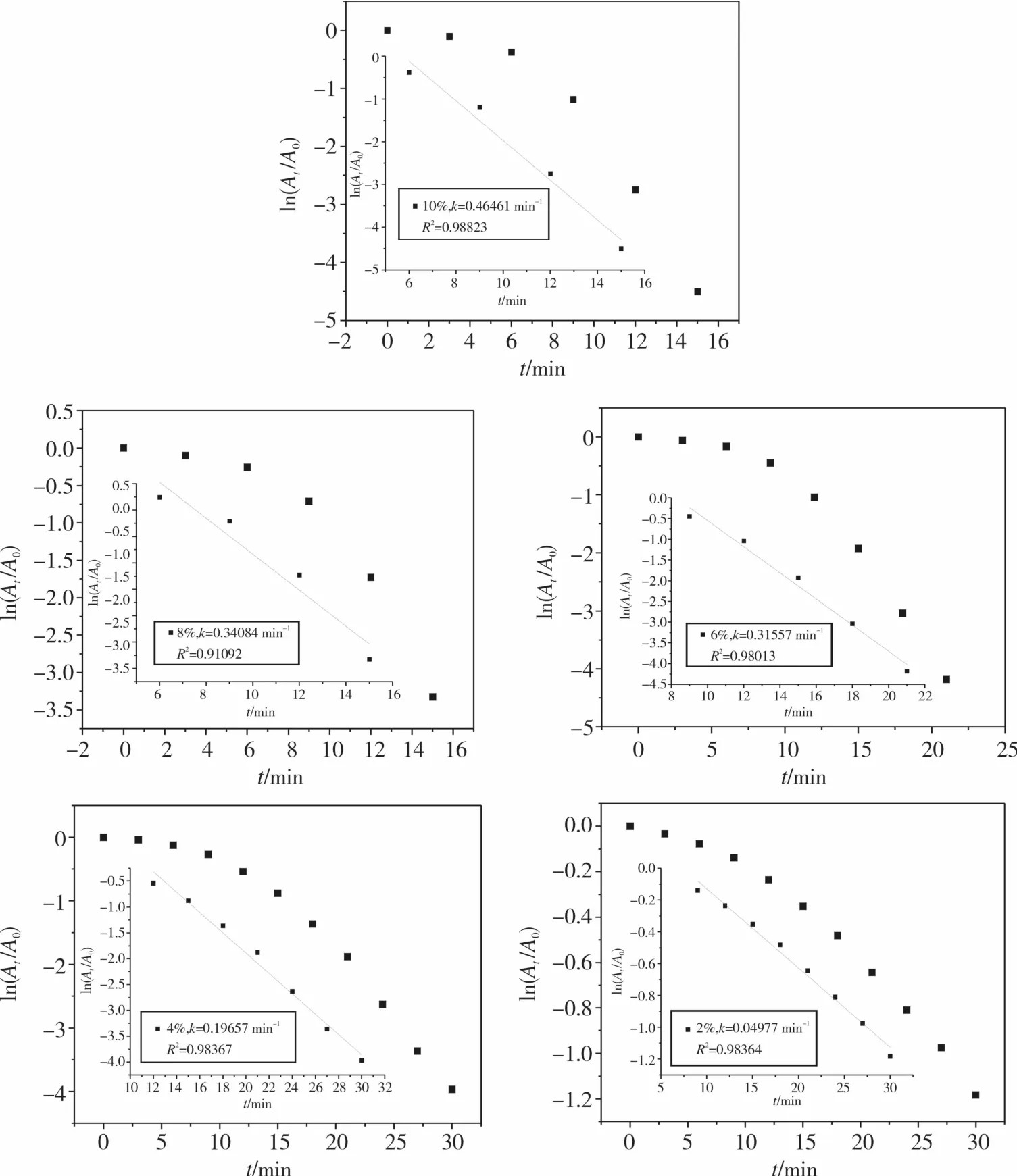
图9 PVA@Au/MWCN不同用量催化还原4-硝基苯酚ln(At/A0)散点图Fig.9 The plot of ln(At/A0)versus time corresponding to the reduction of 4-nitrophenol catalyzed by different amount of PVA@Au/MWCN
2.2.4 pH值对PVA@Au/MWCNT还原4-硝基苯酚反应的影响
通过用0.1 mol/L的盐酸溶液和0.1 mol/L的氢氧化钠溶液来调节0.15 mmol/L 4-硝基苯酚溶液pH值,分别考察了6%的PVA@Au/MWCNT凝胶在不同pH值下(pH=5,7,9,11)对4-硝基苯酚还原反应的影响。当将pH值调到5时,溶液颜色由亮黄色变成无色,当逐渐增加pH值时,溶液颜色由亮黄色逐渐变向深黄色,并且完全反应所需要的时间越长。从图10(a)、图10(b)可以看出,在pH值为5和7条件下,4-硝基苯酚完全反应所需要的时间一样为18 min。另外,PVA@Au/MWCN在不同pH值下催化还原4-硝基苯酚反应也有明显的诱导反应时间,pH值越大,诱导反应时间越长。

图10 p H值对4-硝基苯酚还原反应的影响Fig.10 Effect of pH on PVA@Au/MWCNT reduction of 4-nitrophenol
从图11可以看出,随着pH值逐渐增加,完全反应所需要的时间更长,其反应速率逐渐降低。比较而言,在酸性条件下要比在碱性条件下需要的诱导反应时间短:当pH值为5和7时,其诱导反应时间ti=3 min;当pH值为9和11时,其诱导反应时间ti=6 min。
分析图11可知,散点图都呈曲线分布,刚开始下降趋势比较慢,反应一段时间后呈直线趋势,遵循一级动力学定律。据文献报道[4],在4-硝基苯酚还原反应中,酸性条件更有利于反应进行,而碱性条件则不利于反应进行,其解释如下:

图11 不同p H值下PVA@Au/MWCNT催化4-硝基苯酚还原反应ln(At/A0)散点图Fig.11 The plot of ln(At/A0)versus time corresponding to the reduction of 4-nitrophenol catalyzed by different pH values of PVA@Au/MWCNT

由于在溶液中BH4-水解产生H2速率要比水电离产生H+的速率低,当pH值比较低时,溶液中H+比较多,容易与BH4-结合形成氢气,通过将硝基基团吸附到Au粒子表面,硝基接受H2所提供的电子从而生成了氨基基团。当pH值过高时,溶液中H+较少,给BH4-提供的电子供体较少,产生H2的速度降低,反应速率自然也就降低。因此,pH值较低时反应速率较快。
2.2.5 回收实验
催化剂可循环利用性也是评价催化剂催化活性的重要指标。非均相催化剂的可重复利用性是降低化学工艺成本的一大优势,因为它使分离和回收更容易用于实际的催化应用。通过多次清洗和离心就可以回收混合物中的催化剂,并在新的反应循环中对其催化性能进行测试,研究催化剂的可重复利用性。从图12可知,以硼氢化钠作为还原剂,对质量分数为10%的PVA@Au/MWCNT进行3次循环回收实验,都能使4-硝基苯酚转化为4-氨基苯酚,转化率达到100%,但是随着循环次数的增加,会造成该催化剂部分损失和加剧Au粒子团聚现象,导致该催化剂活性降低,完全反应所需要的时间存在明显的差异,分别需要21,33,63 min。

图12 PVA@Au/MWCNT催化4-硝基苯酚还原反应的循环和时间Fig.12 Plots of conversion versus cycles and time corresponding to the reduction of 4-nitrophenol catalyzed with PVA@Au/MWCNT
3 结论
通过在聚乙烯醇(PVA)高分子链上引入炔基形成炔基化聚乙烯醇高分子聚合物,采用溶胶-凝胶法与Au纳米粒子制备出凝胶催化剂,通过TEM透镜图可知Au粒子均匀分散在聚乙烯醇(PVA)凝胶上面,呈均一分布,粒径约5 nm。从不同载体对催化剂活性的影响、不同PVA@Au/MWCNT用量对催化剂活性的影响、不同pH值对PVA@Au/MWCNT催化活性的影响几个方面对其催化活性进行了评价,结果表明多壁碳纳米管(MWCNT)是一种比较理想的载体,可以明显提高PVA@Au的催化活性;PVA@Au/MWCNT在酸性条件下的催化活性要比在碱性条件下更好,循环利用3次后仍然可以使4-硝基苯酚的转化率达到100%,回收方便,更贴近实际的催化应用。

