GnRH拮抗剂方案对黄体中期子宫内膜免疫细胞数量的影响
徐士儒,许健,陈聪,陈婉如,武娅娅,曾勇,李玉叶*
(1. 深圳中山泌尿外科医院生殖中心,深圳 518043;2. 深圳市围着床期生殖免疫重点实验室,深圳 518043)
控制性超促排卵(COH)可以成功获得多个成熟卵子,其应用于辅助生殖技术后,大大提高了体外受精-胚胎移植(IVF-ET)的妊娠成功率。随着COH药物及方案的发展,如何选择合适的COH方案,成为临床医生关注的焦点。IVF的成功取决于夫妇双方的自身条件和IVF临床实施过程的调控,在胚胎实验室技术和环境稳定的前提下,临床促排卵方案的选择对临床结局的影响至关重要。目前,常用方案主要包括促性腺激素释放激素激动剂(GnRH-a)长方案和近年来新兴的GnRH拮抗剂(GnRH-ant)方案。
GnRH-ant是下丘脑分泌产生的肽类激素,其主要的生理作用是促进性腺激素的释放,即黄体生成激素(LH)和卵泡刺激素(FSH)。GnRH-ant可通过与垂体GnRH受体结合,阻断内源性GnRH的作用,以抑制促性腺激素的释放,进而抑制内源性LH释放,减少FSH的产生。国内外大量临床研究已证实GnRH-ant方案有效、简便、灵活、安全,且作用更加迅速[1],因此GnRH-ant在辅助生殖领域得到了广泛的应用。也有越来越多的研究表明,与传统GnRH-a长方案相比,GnRH-ant方案可获得相似的临床妊娠率及活产率[2-3]。然而研究发现与GnRH-a相比,GnRH-ant方案的新鲜周期移植妊娠率比较低,但是采用冻融胚胎移植(FET)时两者的妊娠率并无显著性差异,提示GnRH-ant对内膜可能存在不良影响[4]。文献报道GnRH-ant组子宫内膜容受性标志性分子同源框基因10(HOXA10)的表达显著下降[5-6],然而有研究发现与自然周期相比较,GnRH-ant方案对子宫内膜组织形态学的影响并无明显差异[7]。因此,GnRH-ant方案对子宫内膜容受性的影响仍存在争议。
在胚胎种植过程中,子宫内膜募集大量的免疫细胞并表达多种细胞因子及关键分子,参与滋养层侵袭、血管新生、蜕膜化及母胎免疫耐受等关键事件,在胚胎着床及胎儿正常生长发育过程中发挥重要作用。在种植窗期,若子宫内膜免疫细胞数量发生异常,将导致不良妊娠结局的发生。目前GnRH-ant方案是否对子宫内膜免疫细胞数量产生影响尚未见相关报道。因此本研究收集了育龄妇女自然周期黄体中期、GnRH-ant与GnRH-a方案取卵后黄体中期的子宫内膜样本,探讨GnRH-ant方案对子宫内膜免疫细胞数量的影响。
资料与方法
一、研究对象
收集2017年5~11月在深圳中山泌尿外科医院生殖医学中心行IVF-ET治疗的女性为研究对象,纳入标准:(1)年龄20~40岁;(2)B超及子宫输卵管造影排除子宫畸形;(3)近3个月无激素类药物使用史;(4)月经周期规律,周期28~32 d;(5)排卵日子宫内膜厚度≥8 mm;(6)自然周期B超监测正常排卵的患者或COH周期中获卵数≥20个为预防卵巢过度刺激综合征(OHSS)而取消新鲜胚胎移植的患者;(7)FSH<10 U/L,抗苗勒管激素(AMH)>3.0 ng/ml。
严格按照纳入标准,共纳入34例研究对象,按照促排卵方案不同分为3组:自然周期组19例,GnRH-ant组7例,GnRH-a组8例。本研究获得深圳中山泌尿外科医院伦理委员会批准,所有样本的采集均签署知情同意书。
二、促排卵方案
1.GnRH-ant方案:患者月经周期第2~3天抽血查基础性激素水平,同时B超监测卵泡状态,当E2<293.6 pmol/L、FSH<10 U/L且B超最大卵泡直径<8 mm时,开始促排卵。使用重组人促卵泡素(默克,德国)及注射用尿促性素(珠海丽珠)112.5~225 U/d进行COH,定期监测卵泡生长及血清E2水平,当主导卵泡直径达到11~12 mm时,加用GnRH-ant(酸醋加尼瑞克,默克,德国)0.25 mg/d直至HCG扳机日,当有3个主导卵泡直径≥17 mm或2个优势卵泡直径≥18 mm时,注射HCG(珠海丽珠)5 000~10 000 U,36 h后在阴道B超引导下实施采卵术。
2.GnRH-a方案:患者于前一周期黄体中期开始皮下注射醋酸曲普瑞林(达必佳,辉凌,德国)0.1 mg/d,降调16 d后,抽血查基础性激素水平及B超监测卵泡发育情况,当垂体抑制达到相应标准(E2<183.5 pmol/L,无卵巢囊肿,最大窦卵泡直径<8 mm)时,开始使用重组人促卵泡素及尿促性素112.5~225 U/d进行COH,定期监测卵泡生长及血清E2水平,当有3个主导卵泡直径≥17 mm或2个优势卵泡直径≥18 mm时,注射HCG 5 000~10 000 U,36 h后在阴道B超引导下实施采卵术。
3. 自然周期方案:自月经周期第10天起,B超结合尿LH监测排卵。
三、内膜标本收集
1.自然周期黄体中期取内膜:自月经周期第10天起,B超结合尿LH监测排卵,排卵后第7~8天,利用子宫内膜取样器(Gynetics,Belgium,比利时)刮取少量子宫腔内膜组织,磷酸盐缓冲液(PBS)清洗去除组织表面血污,于10%中性福尔马林固定液中固定4~6 h。组织常规梯度乙醇脱水、二甲苯透明、浸蜡及包埋。
2.GnRH-ant方案和GnRH-a方案取内膜:GnRH-ant方案和GnRH-a方案取卵后取消或自动放弃新鲜胚胎移植患者,取卵后第2天开始黄体酮(安琪坦,博赏,法国)600 mg/d黄体支持,7 d后行内膜抽吸,内膜标本处理同自然周期。
四、子宫内膜形态学分期
常规苏木素-伊红(HE)染色,根据Noyes标准[8],在光镜显微镜下确定子宫内膜分期。
五、免疫组化检测方法及结果判定
石蜡包埋的子宫内膜组织作4 μm厚度切片,运用自动免疫组化仪(Leica,Bond Ⅲ,美国)进行免疫组化实验。免疫组化使用的一抗信息:CD56(上海基因科技),CD68(Novocastra,美国),CD163(上海基因科技),CD1a(Novocastra,美国),CD8(Novocastra,美国),Foxp3(eBioscience,美国)。
为准确定量分析子宫内膜各免疫细胞的含量,我中心引进Vectra自动病理成像定量分析系统(Perkin Elmer,美国)。首先在低倍镜下扫描整张切片,然后在高倍镜视野下(放大率×200),每张切片随机采集30张图像。使用InForm多光谱图像分析软件进行图像的光谱分析,准确探测和测量弱信号以及重叠的信号。根据不同的着色,在病理技术人员的监督下对每张玻片的每种染色进行不同光谱的拆分,训导软件自动识别视野下的组织区域、空白区域以及分布在组织区域的阳性免疫细胞和所有子宫内膜细胞,操作流程按参考文献所述。最后,纳入被组织覆盖面积超过80%的图像,阳性细胞率定义为阳性免疫细胞数/子宫内膜总细胞数×100%,最终计算30张图像的平均值为该免疫细胞的阳性细胞率。
六、性激素水平测定
采用罗氏电化学发光仪(Cobas e601,罗氏,瑞士)检测血清E2、孕酮(P)水平,所用配套试剂盒均购于瑞士罗氏公司。
七、统计学分析
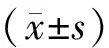
结 果
一、患者一般资料
本项研究共纳入34例研究对象,其中自然周期组19例,GnRH-ant组7例,GnRH-a组8例。3组患者间年龄、体重指数(BMI)以及取子宫内膜当天子宫内膜厚度比较均无显著性差异(P>0.05);GnRH-ant组与GnRH-a组的获卵数及HCG日E2水平比较均无显著性差异(P均>0.05);而GnRH-ant组的HCG日P水平显著高于GnRH-a组(P<0.05)(表1)。
表1 三组患者基本资料比较(-±s)
二、子宫内膜组织学分期
根据“NOYES(1950)时序”子宫内膜形态学分期标准[8],对不同促排方案收集的子宫内膜进行组织形态学比较。本研究纳入的3组患者的分期情况分别是:自然周期组患者(中期19例),GnRH-ant组患者(中期7例),GnRH-a组患者(中期7例、晚期1例)。结果显示,与自然周期相比,GnRH-ant与GnRH-a组患者的子宫内膜分期并无显著性差异(P>0.05),大部分处于中期。
三、子宫内膜免疫细胞数量的变化
运用免疫组化及自动化数字分析体系对黄体中期子宫内膜各免疫细胞进行定量分析,比较GnRH-ant组、GnRH-a组及自然周期组子宫内膜各免疫细胞数量变化情况。与自然周期组比较,GnRH-ant组子宫内膜CD56+NK细胞、CD1a+树突状细胞及CD8+T细胞阳性细胞率显著上升(P均<0.05);GnRH-a组子宫内膜CD56+NK细胞,CD68+巨噬细胞显著增加(P均<0.05);而GnRH-ant组与GnRH-a组之间比较,各免疫细胞的数量变化无显著性差异(P均>0.05)(表2,图1)。
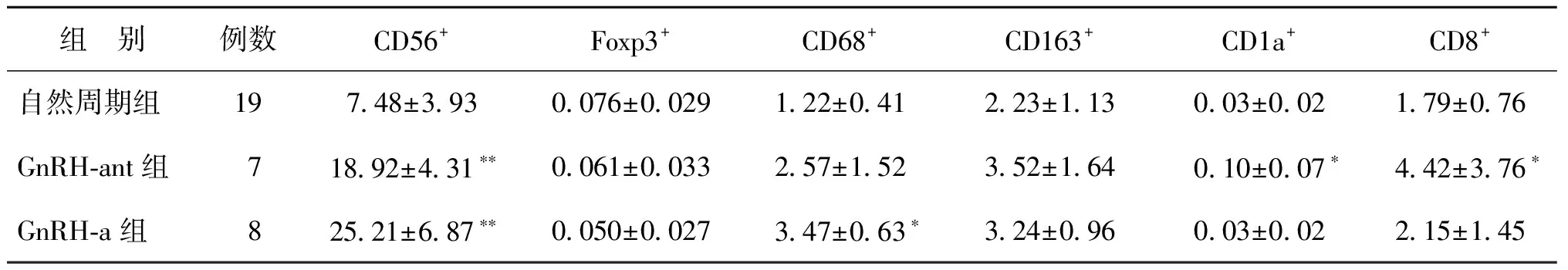
表2 三种不同促排方案间子宫内膜各免疫细胞阳性细胞率比较 (%)

A:CD56+细胞占子宫内膜总细胞的百分比;B:Foxp3+细胞占子宫内膜总细胞的百分比;C:CD163+细胞占子宫内膜总细胞的百分比;D:CD68+细胞占子宫内膜总细胞的百分比;E:CD1a+细胞占子宫内膜总细胞的百分比;F:CD8+细胞占子宫内膜总细胞的百分比。GnRH-ant组和GnRH-a组分别与自然周期组相比较,*P<0.05,**P<0.01,***P<0.001图1 不同促排方案间子宫内膜各免疫细胞阳性细胞率比较
讨 论
GnRH-ant是一种垂体GnRH受体的竞争性阻断剂,它作用快速、安全,且GnRH-ant最大的好处在于不会引起类似GnRH-a造成的卵巢抑制,减少了外源性促性腺激素的剂量,从而减轻患者的经济负担。并且在COH过程中,选择GnRH-ant方案,结合GnRH-a替代HCG诱发卵子成熟,能够降低OHSS的发生率[9]。由于具有上述优势,近年来,GnRH-ant被广泛应用于辅助生殖技术中。
虽然有很多Meta分析比较GnRH-ant与GnRH-a方案对妊娠结局的影响,然而得出的结论不尽相同[2,10-11]。有研究认为尚不能将所有反应类型的患者合并分析GnRH-a和GnRH-ant对妊娠结局的影响。在不同反应类型患者之间,两种方案对妊娠结局的影响可能存在差异。另有文献报道,行GnRH-ant方案的患者,采用FET的妊娠率与GnRH-a方案无显著性差异,而采用新鲜周期移植的妊娠率则明显低于GnRH-a方案组,由此猜测GnRH-ant对内膜容受性可能存在不良影响[4]。小鼠实验证明,GnRH-ant通过改变HOXA10 DNA的甲基化,抑制HOXA10的表达,从而降低子宫内膜容受性[5-6]。Ruan等[12]在小鼠实验中,对种植窗期子宫内膜容受性标记分子进行检测,结果发现,与GnRH-a组相比,GnRH-ant组的胚胎种植率降低,同时内膜容受性标志分子白血病抑制因子(LIF)和整合素β3的表达也相应减少。由此可见,GnRH-ant可能通过降低与胚胎种植相关的关键蛋白的表达,降低了子宫内膜容受性。Macklon等[13]的研究发现,与自然周期相比,GnRH-ant方案引起子宫内膜多种基因表达出现显著变化,这些基因主要与T细胞受体信号通路、细胞黏附及信号转导相关。然而GnRH-ant与GnRH-a方案对子宫内膜容受性影响的机制,至今仍未阐明。
胚胎的种植及早期生长发育是一个炎症刺激过程,在这一过程中,母体子宫内膜募集大量的免疫细胞以帮助胚胎成功种植与生长,同时也要防止母体对胚胎的免疫排斥。一旦免疫细胞的数量发生异常,则会导致妊娠失败的发生[14-15]。本研究检测了高反应人群使用GnRH-ant和GnRH-a方案对子宫内膜各免疫细胞数量的影响,结果显示与自然周期比较,GnRH-ant和GnRH-a方案均可显著增加子宫内膜NK细胞数量。有研究发现NK细胞在胚胎种植、滋养细胞侵袭、血管生成及妊娠维持过程中发挥关键作用[16-17]。反复种植失败及复发性流产患者子宫内膜NK细胞数量过高[18-19]。然而子宫内膜NK细胞数量过高对妊娠结局的影响仍需要多中心的临床研究进一步证实。本研究结果显示,与自然周期比较,高反应人群GnRH-ant和GnRH-a方案子宫内膜NK细胞的数量显著升高。研究证实,促排过程中过高的雌孕激素可能影响子宫内膜免疫细胞的募集[20],因此我们猜测促排过程中过高的雌激素可能促进了子宫内膜NK细胞数量的增加。而高反应人群使用GnRH-ant和GnRH-a方案后过高的NK细胞是否影响妊娠结局还需进一步探索。
同时,本研究进一步发现相较于自然周期组,GnRH-ant可上调子宫内膜未成熟树突状细胞和CD8+T细胞的数量,而GnRH-a组无明显改变。研究证实子宫内膜或蜕膜树突状细胞参与胚胎植入、螺旋动脉重铸和胎盘发育等诸多妊娠生理过程,它还可以通过作用于T细胞和NK细胞并调节其产生细胞因子,共同参与妊娠过程中的母胎对话。在早期妊娠建立的过程中,蜕膜树突状细胞直接参与了蜕膜化和胎盘的形成,条件性敲除蜕膜树突状细胞可导致严重的胚胎种植障碍,进而引起胚胎丢失[21],而回输树突状细胞可显著降低孕鼠的胚胎吸收率[22]。同时,证据表明在母胎界面蜕膜CD8+T细胞能够有效识别胎儿特异性抗原[23-24]。Blois等[25]在小鼠模型研究中发现,敲除CD8+T细胞可破坏孕酮的保胎作用,进一步提示其在妊娠免疫耐受调节中发挥重要作用。由此我们猜测GnRH-ant方案显著促进了子宫内膜未成熟树突状细胞和CD8+T细胞数量的增加,这一现象可能破坏了子宫内膜局部免疫微环境的稳定,进而影响胚胎的种植。
综上所述,GnRH-ant方案与GnRH-a方案相比,对子宫内膜形态学分期无显著影响,两种方案对子宫内膜各免疫细胞的影响也无显著差异。但与自然周期相比,GnRH-ant方案与GnRH-a方案可显著上调子宫内膜不同免疫细胞的数量。由于本研究采集的样本全部来自我中心且样本量较少,因此仍需多中心大样本量的前瞻性研究,对GnRH-ant具体是通过何种机制影响子宫内膜各免疫细胞的数量以及是否影响妊娠结局进行深入探讨。

