直肠癌组织中Twist、Vimentin的表达及临床意义
胡志良,阿里木江·阿不拉,王伟,肖永彪
直肠癌是常见的消化系统恶性肿瘤之一,2015年我国结直肠癌发病例数达37.6万例,死亡例数达19.1万例,严重危害我国人民健康[1]。目前直肠癌的治疗方式包括手术、放化疗及靶向药物治疗等,但对于中晚期患者治疗效果不理想,易复发转移,预后较差[2]。由于直肠癌的病因及发病机制尚不明确,近年来对直肠癌发生发展分子机制的研究受到广发关注。Twist基因位于7p21.1,编码蛋白是具有特征性的螺旋-环-螺旋(bHLH)的Twist转录因子,其可形成同二聚体和异二聚体,与DNA 中E盒序列结合并调节胚胎发育过程,如调节神经管闭合、肢体发育和棕色脂肪代谢等[3]。研究表明,在肺癌、肝癌等多种肿瘤中Twist表达升高,其能促进下游基因如E-钙黏素(E-cadherin)表达降低,导致肿瘤细胞发生上皮间质转化(EMT),肿瘤细胞浸润、侵袭能力增强[4-5]。波形蛋白(Vimentin)位于10p13,该基因编码Ⅲ型中间丝蛋白,与微管和肌动蛋白微丝一起构成细胞骨架,功能上负责维持细胞质的细胞形状和完整性,并稳定细胞骨架相互作用,还作为参与细胞粘附、迁移及信号传导等许多其他重要生物学过程。研究表明,肿瘤细胞中核因子-κB等信号通路的激活能够促进Vimentin表达升高,导致肿瘤细胞易发生局部浸润和远处转移[6]。此外,在非小细胞肺癌中Twist表达与Vimentin表达呈有关,两者可能存在表达调控的关系,促进肿瘤的发生发展[7]。本研究通过检测直肠癌组织中Twist及Vimentin表达,分析两者之间的相关性,初步探讨其作用机制及临床意义。
1 资料与方法
1.1 一般资料
收集2016年1月至2019年3月间在我院诊治的80例直肠癌患者的临床病理资料。其中男性43例,女性37例;年龄29~76岁,平均年龄(53.2±6.1)岁;伴远隔器官转移19例,无远隔器官转移61例;肿瘤直径:<5 cm者55例,≥5 cm者25例;肿瘤分期:Ⅰ~Ⅱ期58例,Ⅲ~Ⅳ期22例;分化程度:高分化19例,中分化30例,低分化31例;浸润深度:肌层23例,浆膜层57例;伴淋巴结转移37例,无淋巴结转移43例。纳入标准[7]:①经病理检查明确诊断为直肠腺癌;②患者既往未接受过放化疗、免疫治疗等;③患者临床病理资料和随访相关资料完整。排除标准:①合并有急慢性肠炎、炎症性肠病等消化系统疾病;②合并急性泌尿系感染、结核菌感染等感染性疾病;③合并其它器官的恶性肿瘤。本研究经我院伦理委员会审核批准通过。
1.2 研究方法
应用实时荧光定量PCR(qRT-PCR)法检测癌组织和癌旁正常组织中Twist及Vimentin的表达。将术中新鲜留取(离体30 min以内)的组织置于EP管中,液氮冻存后置于-80 ℃冰箱保存。取约50 mg的组织标本,应用Trizol法提取组织中总RNA。以总RNA为模板,进行逆转录合成cDNA。反转录条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃5 min,反转录试剂盒购自Takara公司,实验步骤严格按照试剂盒说明书进行。Twist正向引物序列:5′-GTCCGCAGTCTTACGAGGAG-3′,反向引物序列:5′-GCTTGAGGGTCTGAATCTTGCT-3′;Vimentin正向引物:5′-GACGCCATCAACACCGAGTT-3′,反向引物序列:5′-CTTTGTCGTTGGTTAGCTGGT-3′;内参基因GAPDH的正向引物序列5′-CTGGGCTACACTGAG-CACC-3′,反向引物序列:5′-AAGTGGTCGTTGAGG-GCAATG-3′。qPCR反应体系20 μL,包括模板cDNA 2 μL,正向及反向引物各1 μL,2×Taq PCR Master Mix 10 μL, 无RNA酶水6 μL。 Twist qPCR反应条件94 ℃预变性10 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共25个循环。Vimentin qPCR反应条件为:96 ℃ 10 min,96 ℃ 30 s,70 ℃ 30 s,40个循环。每个样本重复3次。Twist及Vimentin的相对表达量采用2-ΔCt法表示,目的基因Twist或Vimentin的表达水平相对于内参基因GAPDH的比值为2-ΔCt,ΔCt=CtTwist/Vimentin-CtGAPDH。
1.3 统计学方法

2 结果
2.1 癌组织与癌旁组织中Twist、Vimentin表达比较
直肠癌组织中Twist的相对表达量为1.081±0.115,显著高于癌旁组织的0.213±0.051(t=60.713,P=0.000);直肠癌组织中Vimentin的相对表达量为2.138±0.216,显著高于癌旁组织的1.037±0.134(t=38.741,P=0.000);见图1。
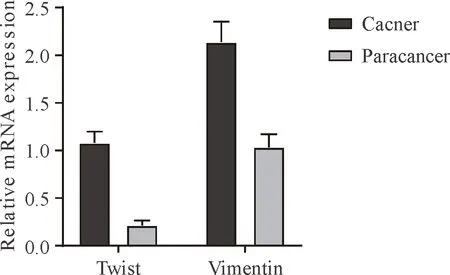
图1直肠癌组织与癌旁组织Twist、Vimentin表达比较
2.2 癌组织中Twist、Vimentin表达与临床病理特征间的关系
直肠癌组织中Twist、Vimentin的表达与肿瘤分期、淋巴结转移有关,而与性别、年龄、肿瘤直径、肿瘤分化程度及浆膜浸润无关,见表1。
2.3 直肠癌组织中Twist与Vimentin表达的相关性
Pearson线性相关分析结果表明,直肠癌癌组织中Twist的mRNA的相对表达量与Vimentin的mRNA的相对表达量呈明显正相关(r=0.613,P=0.009),见图2。
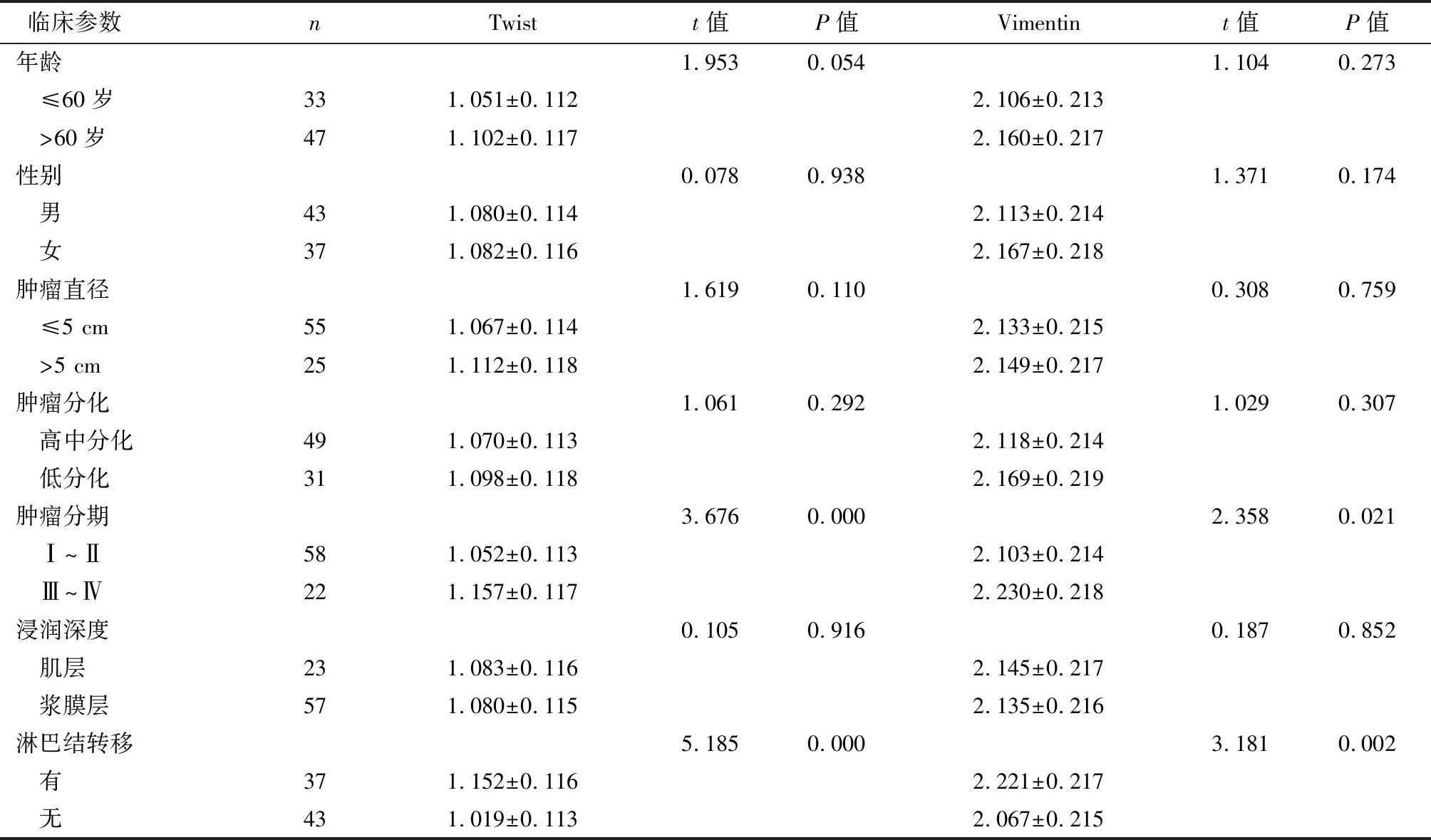
表1直肠癌组织中Twist、Vimentin表达与患者临床病理特征的关系

图2直肠癌组织中Twist与Vimentin表达的相关性
3 讨论
近年来随着我国人民生活水平的提高,直肠癌的发病率逐渐升高,我国每年新发病例数约占全球发病例数的18%,严重威胁我国人民健康[8]。直肠癌的局部解剖结构复杂,手术难度较大,术后并发症及复发率较高,特别是对于局部进展期及晚期患者,患者死亡率较高,预后较差[9]。因此需对直肠癌的发生和发展机制进行深入研究,寻找具有临床意义的肿瘤标志物。上皮-间质转化(EMT)是使处于静止稳定状态的上皮细胞能够以单细胞的形式获得迁移和侵入的能力的过程。大量研究表明,肿瘤细胞EMT重新激活,肿瘤细胞分子表型发生改变,上皮性表型特征的部分丧失,而部分获得间充质表型,促进肿瘤的发生发展[10]。
Twist又称Twist家族bHLH转录因子1,含有特征性的bHLH结构域,能够结合靶基因的DNA序列,发挥转录调控的作用。Twist能够诱导肿瘤干细胞的形成促进肿瘤发生、促进原发性肿瘤生长及肿瘤转移。研究表明,Twist在多种肿瘤中过表达,Twist的过度表达诱导EMT,促进肿瘤转移形成,靶向药物抑制Twist及下游相关分子能够明显抑制肿瘤生长、限制肿瘤转移、逆转耐药性,从而提高癌症患者的存活率[11]。本研究中,直肠癌组织中Twist的mRNA的相对表达量明显高于癌旁正常组织,目前其具体调控机制尚不清楚,可能与肿瘤微环境中免疫细胞、肿瘤细胞间释放的TNF、TGF-β等细胞因子增多有关。研究表明,TNF、TGF-β等能结合于肿瘤细胞表面的相应受体,激活相应细胞信号传导通路,如核因子κB通路等,促进Twist的表达[12]。本研究中直肠癌组织中Twist的表达与肿瘤分期及淋巴结转移有关,表明Twist表达与直肠癌的发生发展有关。一方面,Twist表达水平升高能够直接结合并抑制细胞周期蛋白依赖性激酶抑制剂2A(ARF)的表达,从而抑制P53凋亡信号通路,导致肿瘤细胞过度增殖,凋亡减少,肿瘤分期升高[13]。另一方面,肿瘤细胞中Twist的表达升高后,通过调节钙粘蛋白家族的表达,影响肿瘤的发生发展,如肿瘤细胞表面N-钙黏素表达降低,导致细胞间粘附能力下降,促进肿瘤细胞的淋巴或血行转移[14]。
Vimentin是中间丝蛋白家族的主要成分,在正常间充质细胞中普遍表达,维持细胞完整性及抗应激性。Vimentin是EMT的重要标志物之一,在多种恶性肿瘤中过表达,包括前列腺癌、胃肠道肿瘤、乳腺癌及肺癌等[15]。肿瘤中Vimentin的过度表达与肿瘤增殖、侵袭和患者预后不良密切相关,因而有可能作为肿瘤诊断、治疗的潜在靶标。本研究中,直肠癌组织中Vimentin的相对表达量显著高于癌旁组织,其机制可能是转录后调控机制异常有关。研究表明,肿瘤发生时负性调控Vimentin表达的微小RNA -145表达下调,Vimentin的mRNA稳定性增加,导致Vimentin的表达水平增加[16]。此外,本研究中,直肠癌组织中Vimentin的相对表达量与肿瘤分期、淋巴结转移有关,较高肿瘤分期及伴淋巴结转移的肿瘤组织中Vimentin表达明显较高。Vimentin在正常生理条件下维持间充质细胞的可塑性,而在肿瘤中具有促进肿瘤细胞迁移的作用,机制可能是Vimentin通过整合来自环境的机械输入信号并调节微管和肌动球蛋白网络的动力学来促进细胞迁移,促进癌细胞局部侵袭及淋巴结转移[17-18]。本研究进一步研究直肠癌癌组织中Twist与Vimentin表达的相关性,结果两者表达呈显著正相关,表明两者可能存在直接或间接的相互作用关系。研究表明,肿瘤细胞中转化生长因子β信号通路激活后,促进Twist等转录因子的表达,Twist能够直接结合Vimentin启动子区,并促进间质性表型Vimentin的表达,发挥促进肿瘤细胞恶性进展和转移能力[19-20]。
综上所述,直肠癌组织中Twist与Vimentin均表达升高,两者表达呈明显正相关,且均与肿瘤分期及淋巴结转移有关,有可能成为新的直肠癌诊断、治疗及预后评估的肿瘤标志物,但对于两者之间具体相互作用及调控机制有待进一步研究。

