COX-2基因rs20417、rs689466位点多态性与帕金森病发病相关性分析
张 拉,阿地拉·艾尼瓦尔,蒋 森,王 丹,楼 伟,高 华,孟新玲,杨新玲
(新疆医科大学1第二临床医学院(第二附属医院神经内科),2第二附属医院神经内科,乌鲁木齐 830028;3第五附属医院神经内科;4附属中医医院脑病一科,乌鲁木齐 830011)
帕金森病(Parkinson′s disease,PD)是一种进行性、慢性、年龄相关的第二常见的多因素神经退行性疾病[1],随着人口预期寿命的增加,帕金森病的患病率和发病率也在增加,预计到2030年两者将翻一番[2]。据估计,全球60岁左右人群的患病率为2%,80岁以上人群的患病率为3%[3]。迄今为止,发病机制尚不清楚,与PD相关的治疗都是通过靶向神经递质和/或受体水平来恢复多巴胺的。这些方法试图修复损伤,但不能解决导致细胞死亡的潜在过程,如氧化应激和神经炎症[4]。近年来对帕金森病的实验和临床研究指出神经炎症在神经退行性病变发病机制中的重要作用,其中包括了小胶质细胞和星形胶质细胞的活化、T淋巴细胞浸润和血脑屏障破坏[5]。然而,PD的神经炎症调节机制尚未完全阐明。
环氧化酶-2 (COX-2)可引发促炎过程,在许多神经系统疾病中可加重神经退行性变和功能损害[6]。COX是一种催化花生四烯酸生成前列腺素的限速酶,在组织损伤、炎症等情况下增强。COX-2诱导前列腺素合成的增强刺激癌细胞增殖,促进血管生成,抑制细胞凋亡,增加转移潜能。COX-2具有氧化包括多巴胺在内的儿茶酚胺的潜能,并导致PD中多巴胺能细胞的优先易感性[7]。有研究表明,口服低重复剂量的非甾体类抗炎药可能延缓帕金森病情的进展[8],因此COX-2作为多巴胺能神经元氧化应激的重要来源而备受关注,是一个具有潜在临床应用价值的研究热点。本研究探讨COX-2基因启动子区rs20417和rs689466 两个位点的多态性与PD的关系,从而为进一步阐释PD的病因提供依据。
1 资料与方法
1.1 主要仪器和试剂凝胶成像仪(Gene Genius,英国Syngene),PCR仪(Verity 96well,美国 ABI),冷冻离心机(HC-2518R,加拿大 BBI),测序仪(3730XL,美国 ABI),电泳仪(DYY-8C,北京六一仪器厂)。主要试剂:dNTP Mixture (2.5 mM)(TaKaRa,R001A),10×PCR Buffer (Mg2+plus)(TaKaRa,R001A),TaKaRa Taq Polymerase (5 U/μL)(TaKaRa,R001A),DL2000 DNA Marker(TaKaRa,D501B),核酸染料(北京百泰克)。
1.2 标本的收集及分组选取2018年3月-2019年7月新疆医科大学相关附属医院确诊为PD的患者225例作为病例组。年龄≤50岁为早发型帕金森病组(EOPD 组),年龄>50岁为晚发型帕金森病组(LOPD 组),其中EOPD组32例,LOPD组193 例,男性患者114例,女性患者111例,发病年龄42~82岁,平均发病年龄为(63.50±10.40)岁,以Hoehn-Yahr(H-Y)分级评分量表评估病情严重程度[9],小于3级为轻度,3级及3级以上为重度。对照组为与PD组在年龄、性别上相匹配的,与PD组同期就诊于同一医院的健康志愿者人群及体检者共231例,其中男性123例,女性108例,年龄40~80岁,平均年龄(61.59±9.76)岁。两组年龄、性别比较差异无统计学意义(P>0.05)。纳入及排除标准:纳入的PD组均符合英国 Brain Bank诊断标准,排除帕金森叠加综合征、继发性PD和其他神经系统疾病。均由两个副主任医师级别以上的医生严格按照诊断标准诊断。PD组和对照组个体之间无亲缘关系,所有受试对象均签署知情同意书。
1.3 研究方法
1.3.1 标本的采集 取受试者静脉血2 mL于EDTA抗凝管中,使用离心柱型DNA提取试剂盒(北京天根生化有限公司)以提取DNA,严格按照其试剂盒中配套的说明书操作。检测DNA浓度≥10 ng/μL,纯度为1.7~1.9,则为提取的DNA样本合格。对于不合格样本,予以重新提取,样本在-20℃保存,备用。
1.3.2 引物的设计与合成 引物序列的设计是根据NCBI数据库获得COX-2基因序列找到位点所在位置,由上海生工公司合成。rs20417位点的上游引物为5′-AGCCCAGGCAACTGAAAAGT-3′,下游引物为5′-AGCCCAGGCAACTGAAAAGT-3′,PCR产物长度604 bp。rs689466位点的上游引物为5′-GCAGGGACGCTAAATGTCCA-3′,下游引物为5′-CCTCCCTGAGCACTACCCAT-3′,PCR产物长度351 bp。
1.3.3 PCR反应体系 30 μL:10×PCR Buffer 3 μL(Mg2+plus),上游及下游引物各取1.5 μL,dNTP Mixture 3 μL(2.5 mM),TaKaRa TaqTM Polymerase 0.3 μL(5 U/μL),DNA模板1 μL,加水至30 μL;PCR反应条件为:95℃预变性5 min后,再95℃变性30 s,退火30 s(rs20417 59℃,rs689466 60℃),72℃延伸(rs20417 60 s,rs689466 45 s),35个循环后,4℃保存。

2 结果
2.1 Hardy-Weinberg平衡检验病例组与对照组COX-2基因rs689466、rs20417位点的基因型分布比较,P值均>0.05,符合Hardy-Weinberg平衡定律。说明本实验所选取的样本基因型频率处于平衡状态,具有群体代表性。
2.2 PCR扩增病例组共送检225例,rs20417位点测得GG型196例、CG型29例,未发现CC型;rs689466位点TT型107例,CT型87例,CC型31例。对照组共送检231例,其中rs20417位点GG型207例、CG型24例,未发现CC型;rs689466位点TT型84例,CT型102例,CC型45例。COX-2基因rs20417、rs689466位点经过PCR扩增后,产物片段分别为604 bp、351 bp,2%琼脂糖凝胶的电泳上显示PCR扩增产物(图1、2),直接测序结果见图3,可见图中纯合为单峰图,杂合则为双峰图。

图1 rs20417(604bp)位点PCR扩增后产物片段

图2 rs689466(351bp)位点PCR扩增后产物片段
2.3 COX-2基因rs20417和rs689466位点在分组、性别、年龄及病情严重程度中的基因型及等位基因频率分布rs20417位点有GG型、CG型、CC型3种基因型,但本次研究未发现有CC型变异,COX-2基因rs20417位点GG基因型在病例组及对照组分布频率分别为87.1%和89.6%,CG基因型分布频率为12.9%和10.4%。等位基因频率C、G在PD组为6.4%和93.6%,对照组为5.2%和94.8%,PD组与对照组在基因型及等位基因频率分布差异无统计学意义(P>0.05)。分层分析中,PD组与对照组中年龄、性别、病情严重程度亚组间rs20417位点基因型以及等位基因频率差异均无统计学意义(P均>0.05),见表1。COX-2基因rs689466位点TT基因型在病例组及对照组分布频率分别为47.6%和36.4%,CT基因型分布频率为38.7%和44.2%,CC型为13.8%和19.5%,两组比较差异有统计学意义(P<0.05)。等位基因频率T、C病例组为66.9%和33.1%,对照组为58.4%和41.6%,两组比较差异有统计学意义(P<0.05)。分层分析中,等位基因频率分布在病例组与对照组、年龄、病情严重程度中差异均有统计学意义(P均<0.05),见表2。
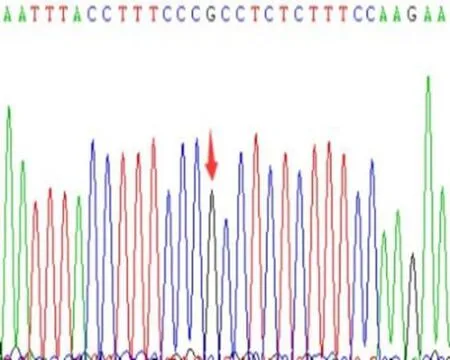
a:rs20417 GG型

b:rs20417 CG型

c:rs689466 TT型
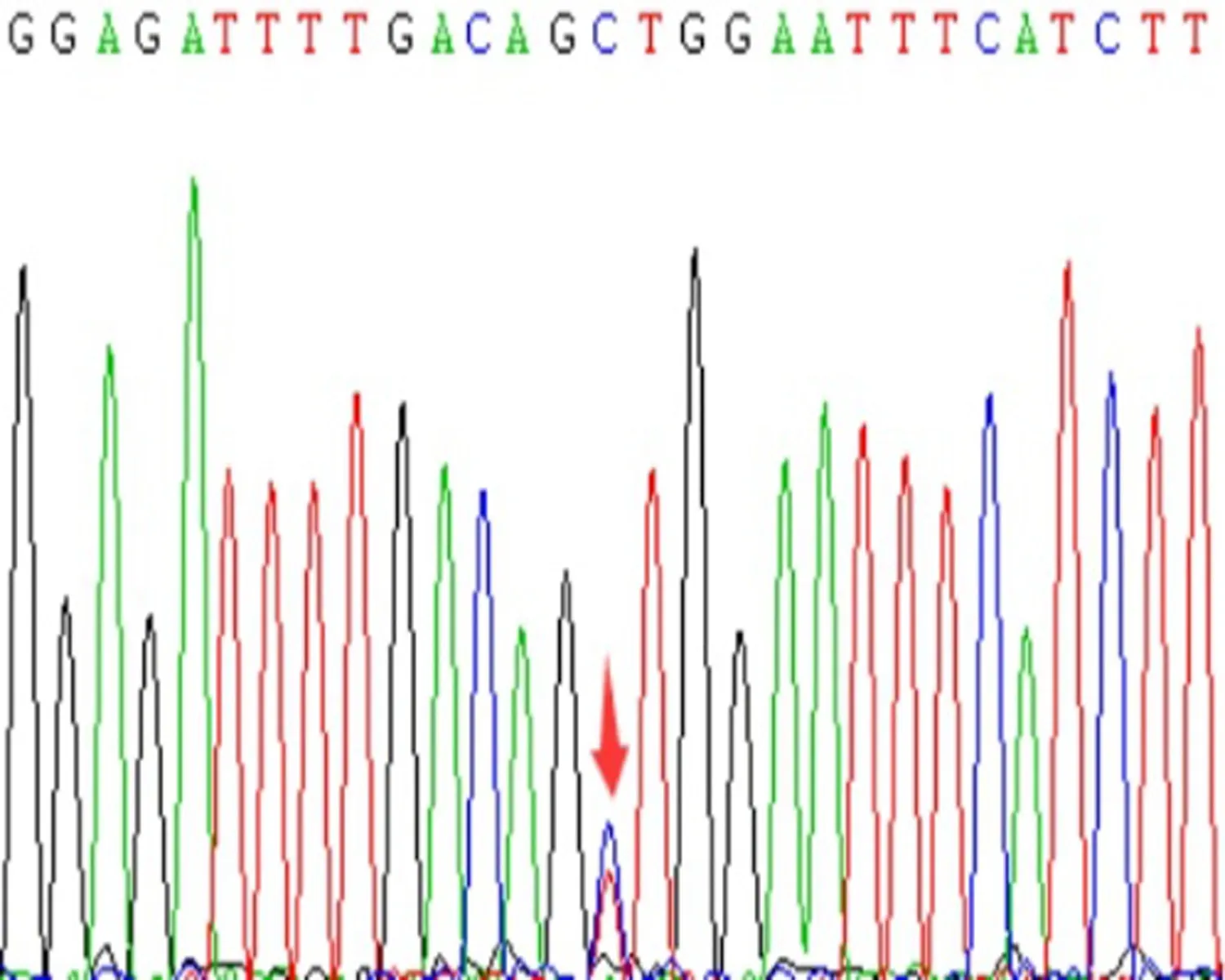
d:rs689466 CT型
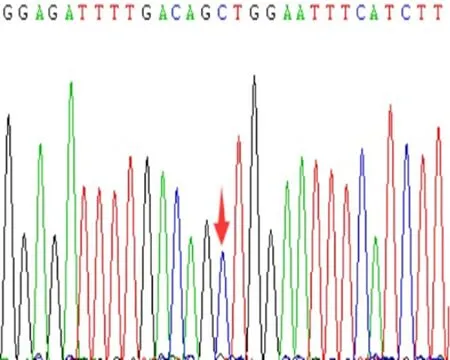
e:rs689466 CC型图3 COX-2基因rs20417、rs689466位点基因测序图

表1 COX-2基因rs20417位点在分组、性别、年龄及病情严重程度中的基因型及等位基因频率分布/例(%)

表2 COX-2基因rs689466位点在分组、性别、年龄及病情严重程度中的基因型及等位基因频率分布/例(%)
3 讨论
本课题组在前期研究中,发现了一些与PD相关的已知基因,如αsynuclein基因、LRRK2基因、Parkin基因、DJ1基因、UCHL1基因、GIGyF2基因、NURR1基因、PINK1基因、PLA2G6 基因、FBX07基因、GBA基因和ATP13A2基因等[10],据报道COX-2也参与PD的发生、发展。Dai等[11]结果表明,P38信号通路调节的COX-2酶的表达对黑质中1-甲基-4-苯基-1、2、3、6-四氢吡啶(MPTP)诱导的PD产生了影响。Teismann[12]的研究得出结论,COX-2基因会影响神经退行性过程,并在PD的发病机理中发挥重要作用。在2014年,Rakel等[13]发现LRRK2通过调节COX-2酶的表达也影响PD患者的炎症反应。2018年,毕早安等[14]发现,rs20417、rs689466位点基因型分布可能与PD易感性相关。在本文中,测定了启动子区域中COX-2基因的两个位点的多态性(rs20417、rs689466)对PD发生、发展的作用。COX-2基因启动子区的调控位点与转录因子相结合,可以调控COX-2基因的转录[15]。且COX-2基因启动子区有多个调控原件及大量c-Myb转录因子结合位点,转录因子Sp1的结合位点是rs20417。rs20417位点的G>C突变,可以使Sp1无法与之相结合,进而可以抑制COX-2基因的表达,转录因子c-Myb的结合位点是rs689466,该位点A等位基因可以促进转录因子c-Myb与启动子区调控位点的结合,从而可以上调COX-2基因的表达[16]。本研究使用基因测序和聚合酶链反应(PCR)相结合的方法,对PD患者及对照者的rs20417、rs689466基因进行多态性分析。结果显示,rs20417位点有GG型、CG型、CC型3种基因型,但本次研究未发现有CC型变异,COX-2基因rs20417位点GG基因型在病例组及对照组分布频率分别为87.1%和89.6%,CG基因型分布频率为12.9%和10.4%。等位基因频率C、G在PD组为6.4%和93.6%,对照组为5.2%和94.8%,PD组与对照组在基因型及等位基因频率分布差异无统计学意义。分层分析中,PD组与对照组中年龄、性别、病情严重程度亚组间rs20417位点基因型以及等位基因频率差异均无统计学意义。COX-2基因rs689466位点TT基因型在病例组及对照组分布频率分别为47.6%和36.4%,CT基因型分布频率为38.7%和44.2%,CC型为13.8%和19.5%,两组比较差异有统计学意义。等位基因频率T、C病例组为66.9%和33.1%,对照组为58.4%和41.6%,两组比较差异有统计学意义。分层分析中,等位基因频率分布在病例组与对照组、年龄、病情严重程度中差异均有统计学意义。提示携带T等位基因可能与帕金森病的发生、发展相关,研究结果与前人研究结果大致相同。目前发现COX-2基因近年来对帕金森病的实验和临床研究指出炎症在神经退行性变发病机制的关键作用,以及非甾体类抗炎药物治疗可能产生积极作用[8]。但COX-2基因多态性影响PD的确切机制尚不清楚。本研究推测可能 rs689466 位点等位基因T的携带者通过引起前列腺素水平的升高,从而通过神经炎症反应增加PD的发病风险。但考虑基因-基因,基因多态性甚至基因-环境之间的相互作用[17],还需扩大样本量和精心设计,并有待进一步深入研究分析。

