DNA特殊二级结构及其应用进展
杜再慧,罗云波,朱龙佼,许文涛,2*
1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学,农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083;
核酸的碱基序列、拓扑结构对于生命遗传和生理功能都起着至关重要的作用。天然存在的核酸包括DNA和RNA。核酸是由核苷酸通过磷酸二酯键组成,而核苷酸是由含氮碱基、戊糖和磷酸构成。其中,碱基又分为嘧啶和嘌呤;构成DNA的戊糖是D-2-脱氧核糖,构成RNA的戊糖一般为D-核糖,某些RNA中的戊糖还有D-2-O-甲基核糖。因此,核酸的排列顺序和结构是多种多样的。1953年Watson和Crick[1]首次提出了DNA双螺旋结构模型,标志着分子生物学时代的到来,也使得核酸成为领域内的研究热点。对于核酸结构的定义,狭义上可分为3类:DNA的一级结构是指分子中脱氧核糖核苷酸的排列顺序,即单个核苷酸通过磷酸二酯键连接起来(图1)[2];DNA的二级结构是指脱氧核糖核苷酸链通过氢键与其他核苷酸链配对或分子内周期性折叠形成的螺旋结构,即双螺旋结构和本文介绍的DNA特殊二级结构;DNA的三级结构是指双螺旋的扭曲。最为常见的DNA二级结构为平行双螺旋,它是由2条反向平行的DNA链构成,中间由A-T、C-G碱基通过氢键进行互补配对,并形成2个沟槽[1]。
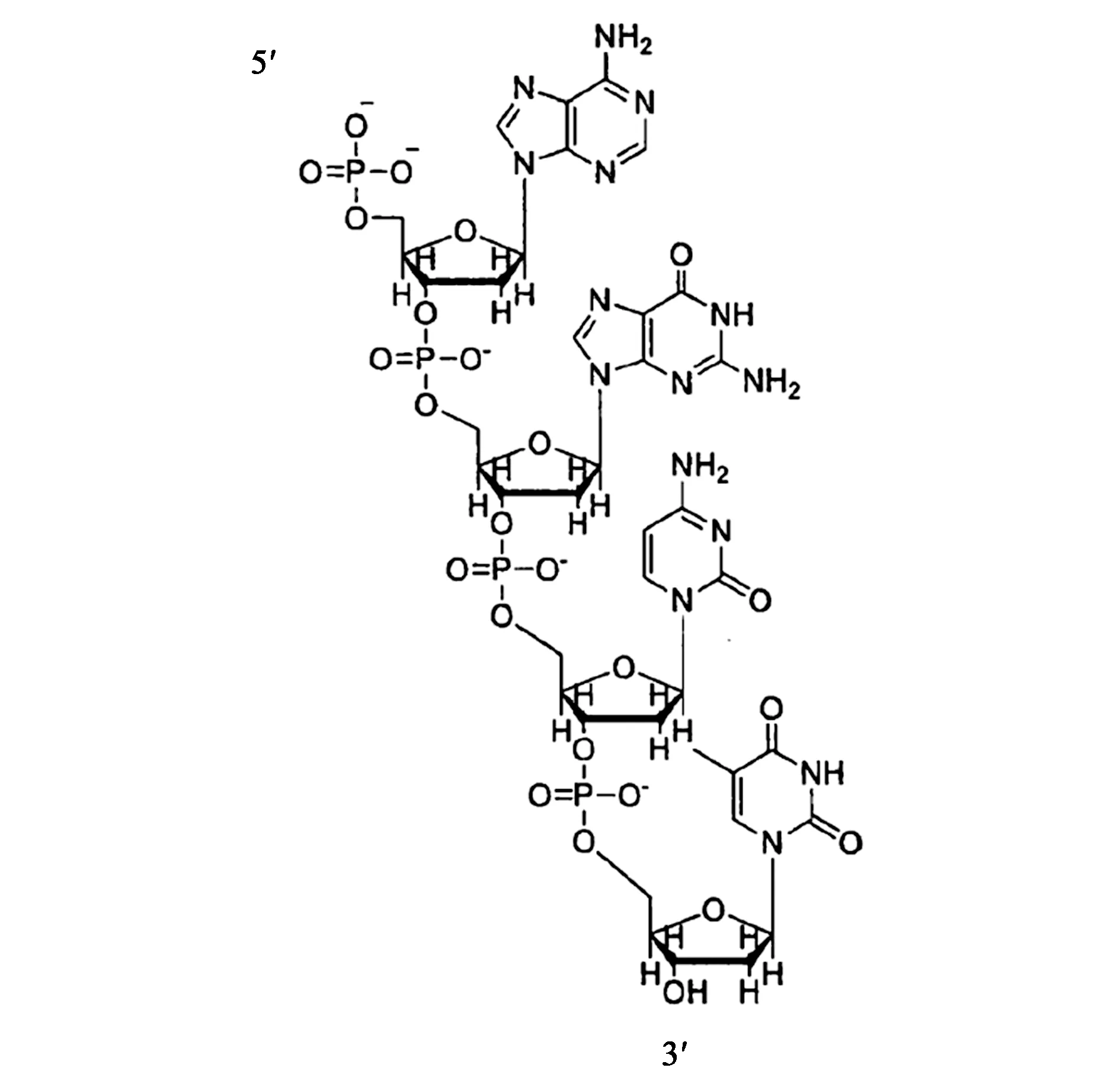
图1 DNA的一级结构[2]Fig.1 Primary structure of DNA[2]
目前已发现的DNA特殊二级结构包括发卡(hairpin)、十字形(cruciform)、双螺旋(double helix)、三螺旋(triplex)、G-四联体(G-quadruplex)、G-三联体(G-triplex)和i-motif等[3-5]。这些DNA特殊二级结构在细胞进化过程中起着重要的作用,它们分布在人类基因组的各个位置,时常与细胞的生长周期、功能和人类疾病等相关。Mergny和Hélène[6]在1998年首次提出了G-quadruplex与小分子化合物作用后具有抑制端粒酶的作用,由此也引发了研究人员对DNA特殊二级结构及其功能的关注,重点研究其机理并将其应用到疾病的诊断与治疗以及纳米智能材料、纳米分子机器、生物传感器等的研发中。本文主要介绍了G-quadruplex、G-triplex和i-motif 这3种DNA特殊二级结构,包括其发展史、结构组成、特殊功能以及在生物传感、纳米材料、体内检测等方面的应用。最后剖析了目前在DNA特殊二级结构的研究中存在的问题与不足,并对其今后的研究方向做出了展望,以期为DNA特殊二级结构在生物传感、分子医学等领域的应用提供理论支持。
1 G-quadruplex
1.1 G-quadruplex的发展史
G-quadruplex的研究进程与端粒是密不可分的,这是由于端粒的本质也是富含鸟嘌呤(G)的核酸序列。1962年Gellert等[7]通过X射线证明了4个鸟嘌呤(G)可以形成1个共平面的四聚体G-quartet,鸟嘌呤之间通过Hoogsteen氢键相互作用。又有研究人员通过X-射线衍射进一步证明了poly(G)形成的G-quartet中每个鸟嘌呤之间是通过2个Hoogsteen氢键结合,并且作用位点分别在碱基的O6和N7之间[8]。而环状平面G-quartet之间通过π-π堆积可以形成G-quadruplex结构。20世纪80年代,Blackburn所在团队证明端粒是真核细胞里线性染色体末端的一小段DNA重复序列,并与蛋白质复合为非转录DNA提供缓冲物,保护染色体免于融合和退化[9]。同时期,Henderson等[10]证明G-quadruplex在生物体中也具有重要作用。随后,2009年,Cheng等[11]发现了G-quadruplex与氯高铁血红素(hemin)结合具有类过氧化物酶活性,可以催化H2O2和底物发生颜色反应,这又扩展了G-quadruplex的应用。2017年,Guo等[12]发现了一种耐高温的G-quadruplex结构,它可以与hemin在高温条件下结合,复合物具有过氧化物酶活性。这对于生物酶大多不耐高温的已知规律是一个完善与补充。
1.2 G-quadruplex的结构
G-quadruplex核酸序列的排列多种多样,而且相同的核酸序列在不同的条件下也可以形成不同的拓扑结构,这决定了G-quadruplex结构的多态性和特异性。G-quadruplex的折叠方式有分子内折叠和分子间折叠(图2),分子内折叠是由1条链形成的四重折叠,分子间折叠是由2条链或4条链的聚合形成的四重折叠[13]。当G-quadruplex形成分子内折叠时,由于核酸浓度的不同,G-quadruplex结构也可以在分子间折叠和分子内折叠相互转换。根据G-quadruplex中链的走向还可以将其分成平行和反平行。圆二色谱显示平行的G-quadruplex核苷酸键都是反式的,会在265 nm处出现阳性峰,在240 nm处出现阴性峰;反平行的G-quadruplex核苷酸键既有顺式又有反式,会在295 nm处出现阳性峰,在260 nm处出现阴性峰[13]。
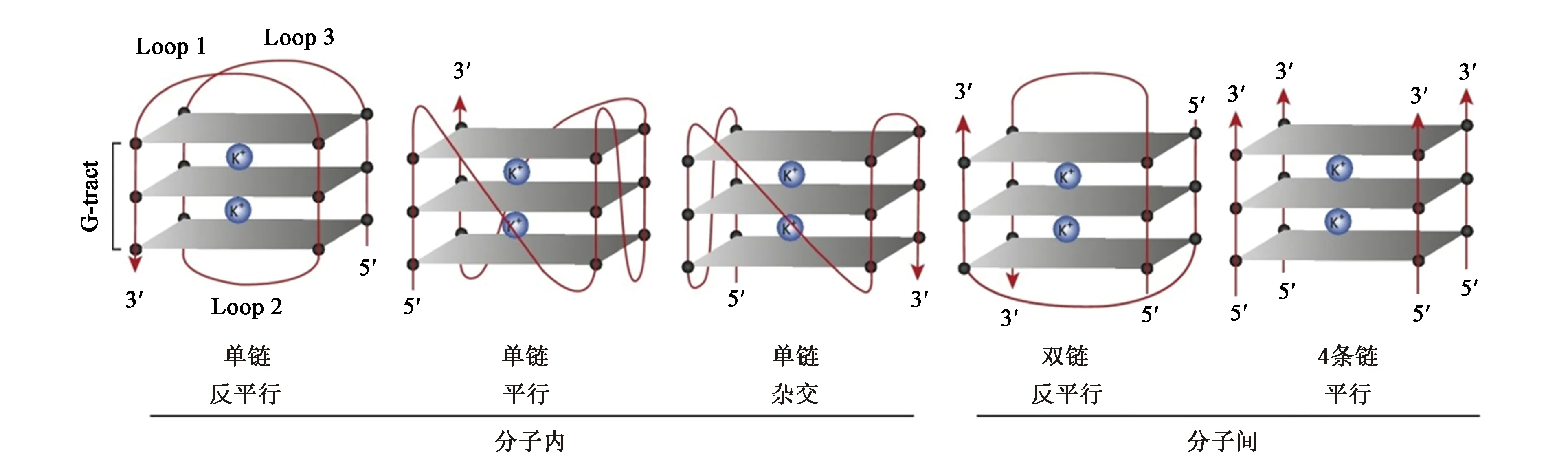
图2 G-quadruplex的典型拓扑结构[13]Fig.2 Representative topologies of G-quadruplex structures[13]
1.3 G-quadruplex在生物传感器中的应用
G-quadruplex在生物传感器中最主要的应用是作为输出信号:①由于G-quadruplex具有类过氧化物酶活性,可以催化H2O2和底物发生颜色反应,因此可用作比色输出信号;②较为常见的是G-quadruplex与一些小分子物质结合,作为荧光输出信号;③G-quadruplex还可以和电化学分子结合,通过自身构象变化引起电化学分子的变化,进而作为电化学输出信号。
G-quadruplex与氯高铁血红素(hemin)共孵育后具有类过氧化物酶活性,可以催化2,2′-联氮-双(3-乙基-苯并噻唑琳-6-磺酸)二胺盐[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS2-]、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethyl benzidine,TMB)等物质发生颜色变化,进而完成比色信号的输出。如2018年Zhang等[17]采用等温比色的方法对转基因作物进行检测(图3),在转基因作物(genetically modified crops,GMC)的CaMV 35S存在时,可以与富含G-quadruplex的发卡结构结合激发核酸外切酶(exonuclease Ⅲ,Exo Ⅲ)的活性,促使富G序列暴露出来,折叠形成具有类过氧化物酶活性的结构,从而催化ABTS2-显色,在420 nm处会出现最大吸收峰。采用Cu2+介导的基于G-quadruplex的DNA核酶(DNAzymes)构建的无标记的L-组氨酸生物传感器,同样利用了G-四联体催化ABTS2-的原理[18]。
N-甲基吗啡啉(N-methylmorpholine,NMM)、四氢噻吩(tetrahydrothiophene,ThT)、噻唑橙(thiazole orange,TO)等小分子物质都可以与G-quadruplex结合发出荧光,进而完成荧光信号的输出。如2013年Tong等[19]基于ThT与特定G-quadruplex的构象变化设计了一个无标记“turn-on”生物传感器,用于检测生物硫醇的含量。这主要基于ThT与G-quadruplex结合的激发波长为440 nm,发射波长为485 nm,而其他小分子物质与G-quadruplex结合的激发和发射各不相同。
此外,G-quadruplex还可以通过自身构象变化引起电化学分子的变化,进而完成电化学信号的输出。2017年,Wang等[20]基于Cu2+-G-quadruplex DNAzyme的过氧化物酶活性完成了对焦磷酸酶(pyrophosphatase,PPase)的电化学检测。由于焦磷酸酶可以催化Cu2+与焦磷酸盐的复合物,使Cu2+可以完全游离出来,并与电极上的G-quadruplex折叠形成具有类过氧化物酶活性的物质,催化TMB显色,并且可以根据H2O2反应产生的定量的电流信号,来完成对焦磷酸酶的检测(图4)。
1.4 G-quadruplex在体内检测中的应用
端粒是DNA和蛋白质结合的混合物,其中端粒DNA结构是互补配对的双螺旋DNA,但是在3′端有一段G单链悬垂区(G-overhang),这段单链在适宜条件下可以形成G-quadruplex。通过计算机预测,人类基因组中有300 000个序列单元(G≥3N1-7G≥3N1-7G≥3N1-7)有形成G-quadruplex结构的可能,但要进一步对体内G-quadruplex结构及位置进行表征则需要一些特异性探针。细胞可视化方法是一种使特定DNA结构可视化的方法,主要利用结构选择探针进行实验。由于抗体蛋白具有识别特定分子结构的精准特异性,常被用作选择探针。G-quadruplex的第一个抗体是由Schaffitzel等[21]于2001年发现的,命名为scFV,接下来又相继发现了BG4[22]、1H6[23]等抗体。利用G-quadruplex的抗体即可完成体内G-quadruplex结构和位置的表征。
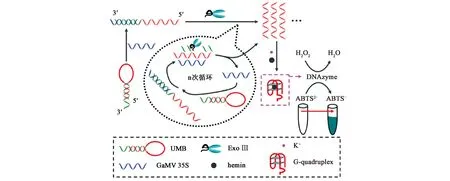
注:UMB:无标记分子信标,unlabeled molecular beacon。图3 G-quadruplex催化ABTS2-显色检测GMC的原理图[17]Fig.3 Schematic of G-quadruplex catalyzed ABTS2- for detection GMC[17]
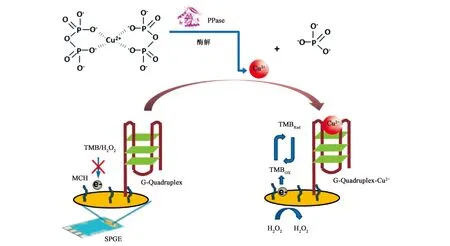
注:MCH:巯基乙醇,mercaptohexanol;SPGE:丝网印刷金电极,screen-printed gold electrode。图4 G-quadruplex催化TMB显色检测焦磷酸酶电化学生物传感器[20]Fig.4 Electrochemical biosensor based on G-quadruplex catalytic TMB for detection pyrophosphatase[20]
有研究表明,细胞每分裂一次,染色体末端的端粒就会缩短一部分,当端粒缩短到临界长度,细胞开始凋亡[24]。但在癌细胞中存在一种特殊的DNA聚合酶,即端粒酶,它可以稳定端粒长度使癌细胞永生化。而当端粒末端的G-overhang形成G-quadruplex时就可以抑制端粒酶的活性,甚至可以杀死癌细胞。因此,G-quadruplex可以作为抗癌药物的靶点。为了促进G-quadruplex的形成,研究集中于可以与G-quadruplex稳定结合的小分子,进而对癌症的诊断治疗起作用。Liu等[25]在单细胞水平上,利用末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)激活G-quadruplex的合成,对凋亡细胞进行没有标记的原位生物成像(图5)。TdT是一种特殊的DNA聚合酶,在没有模板存在的情况下,可以催化脱氧核糖的3’-OH端延伸。以凋亡细胞内的片段DNA作为TdT延伸的起始位点,形成大量的G-quadruplex,与特异性染料ThT结合,荧光信号增强,对凋亡细胞进行“turn-on”检测。这种TdT激活G-quadruplex合成的实验(TdT-activateddenovoG-quadruplex synthesis,TAGS)具有高特异性、高敏感性,可灵活的应用于多水平的生物系统。并且这种“混合-读数”成像的方法避免了标记核酸以及清洗的步骤。更重要的是,G-quadruplex靶向荧光探针具有多样性和功能性,具有较大的应用潜力。
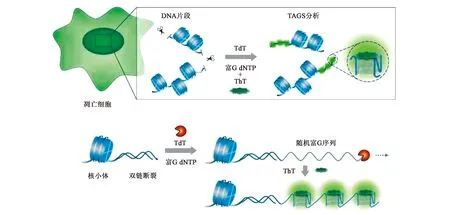
图5 利用TAGS分析进行细胞凋亡原位检测的原理图[25]Fig.5 Schematic presentation of in situ cell apoptosis detection utilizing TAGS assay[25]
2 G-triplex
2.1 G-triplex的发展史
2013年,Limongelli等[26]在探究结合金属离子形成四螺旋体结构的凝血酶适体DNA[d(GGTTGGTGTGGTTGG),TBA]时,首次发现了一种不同于已发现的DNA二级结构,这种结构是TBA序列后面的“TTGG”核酸去掉形成的一种类似于G-quadruplex的G-triplex结构。G-triplex也有类似于G-quartet的共平面三聚体,是由3个鸟嘌呤碱基之间通过Hoogsteen氢键相连形成的G-triad,2个G-triad相互堆积形成G-triplex(图6)。但G-triad需要在较为苛刻的条件(70 mmol/L KCl)下形成[28],一般没有G-quadruplex稳定。除了结构相似,G-triplex与G-quadruplex一样都具有类过氧化物酶活性[29],这拓展了G-triplex的应用范围。并且,2016年,Xu等[30]首次发现G-triplex与Cu2+结合可以催化Diels-Alder反应,进一步扩大了其应用范围。
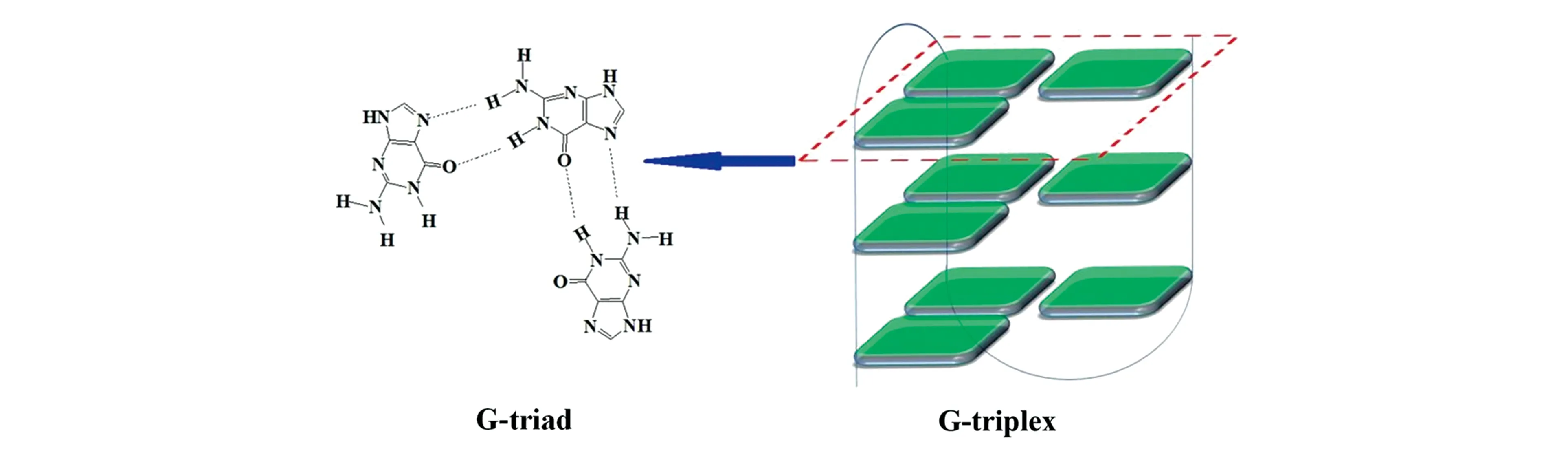
图6 G-triad和G-triplex的结构[27]Fig.6 Structure of G-triad and G-triplex[27]
2.2 G-triplex的结构
G-triplex结构受核酸分子拥挤程度、金属离子浓度等的影响。金属离子对G-triplex的稳定能力的顺序为Ca2+>K+>Mg2+>Na+[27]。Ca2+无论在稀溶液中还是在核酸分子拥挤溶液中,都会促使平行的G-triplex的形成。即便G-triplex在分子拥挤和Ca2+同时存在的情况下,它由2个G-triad形成的结构熔解温度也比生理温度低;而由3个G-triad形成的结构熔解温度是非常高的,尤其是在K+或Ca2+和分子拥挤同时存在的情况下,这也暗示着G-triplex可以在生理条件下存在。K+和G-triplex结合是放热反应;Ca2+和G-triplex结合是吸热反应。值得特别注意的是,Ca2+对生理活动是非常重要的金属离子,它对G-triplex起到稳定作用,由此可以推测出G-triplex对人体的生命活动也发挥着重要作用。
2.3 G-triplex的应用
2014年,Ma等[31]人工合成了一种化合物Ir(III),它可以与G-triplex结合发冷光,通过这种方式无标记定量检测了绿豆芽核酸酶活性。最新的研究表明,假设G-triplex具有与G-quadruplex相似的化学结构及功能,则稳定的G-triplex可以结合ThT作为高效的荧光探针[32]。与传统的G-quadruplex相比,G-triplex探针更易控制和激发活性,所以可以将这个探针应用于生物传感器,以提高检测效率。
3 I-motif
3.1 I-motif的发展史
生物体内基因富含鸟嘌呤(G),根据碱基互补配对原则,其互补序列中必然富含胞嘧啶(C)。1993年,Gehring等[33]在研究DNA序列d(TCCCCC)在弱酸条件下的二级结构时,利用核磁共振首次提出了i-motif四联体结构。它是一种插层结构,即2条胞嘧啶链利用C∶C+配对形成1个平行双螺旋结构,和另外2条双螺旋链头尾交插。1994年,Manzini等[34]利用圆二色谱法证明(C3AT2)C3T形成了i-motif结构。由于i-motif结构需要在pH比较低的情况下形成,所以大部分关于i-motif结构的研究都只是在体外进行。2000年,Phan和Leroy[35]得到了人端粒DNA序列在溶液中形成的i-motif结构的晶体结构。
3.2 I-motif的结构
I-motif结构与G-quadruplex结构分类类似,通过i-motif形成的核酸链可以分为单体i-motif [d(CCCTAACCCTAACCCTAACCC)]、双聚体i-motif [d(CCCTAACCC)]、四聚体i-motif [d(CCCTAA)],结构如图7所示[36]。如果由1条链经分子间折叠构成单体i-motif结构时,会存在2种构型:5′E和3′E。当闭合的C∶C+碱基对在5′端时形成的结构叫做5′E,而在3′端时叫做3′E。而四聚体i-motif有S型、R型和T型之分,当温度在15~50 ℃时,R型最稳定,S型次之,T型最不稳定。富C序列在pH 5的条件下折叠成i-motif结构,而在pH 8的条件下去折叠,在这种折叠和去折叠过程的时间尺度约在100 ms。RNA i-motif的结构不稳定,是由于它比DNA i-motif结构缺少了1对2’-OH/2-’OH的排斥作用。i-motif结构通常受到温度、pH、磷酸骨架结构、连续胞嘧啶的序列、loop区、分子拥挤环境以及羧基修饰的碳纳米管或石墨烯量子点等条件的影响。

图7 i-motif的结构[36]Fig.7 The structure of i-motif[36]
3.3 I-motif在纳米材料中的应用
DNA分子被广泛用作纳米材料(2D/3D结构和连锁组件)的原料,DNA纳米结构可以通过DNA的可编程性进行功能化。其中多个的DNA单元,如G-quadruplex、i-motif被广泛用于DNA纳米技术,这些四联体具有共同的特点,即根据核酸序列和外界条件的变化,它们的折叠类型也会发生相应的改变,这使得它们可以作为通用的DNA纳米结构使用。Li和Famulok[37]通过调控pH控制i-motif结构的收缩和扩张,使得纳米环自身收缩、两两相互作用或形成三聚环等,进而构建了不同的DNA纳米环。这开辟了一种纳米结构形成的新方式,后续也可应用于生物传感器的构建。
3.4 I-motif在体内检测中的应用
虽然i-motif在体外形成插层结构已被证实,但是在人类基因组内,这种四联体的DNA结构一直存在争议。因此,Daniel Christ所在团队通过筛选得到了1个i-motif结构的特异性抗体iMab,该抗体对i-motif结构具有高选择性和高亲和力,利用该抗体第一次直接可视化的证明了人类细胞核中存在i-motif结构,并论证了i-motif结构依赖于细胞循环周期和pH,i-motif插层结构可以在体内形成,这为i-motif结构在人类基因组的调控区域的形成提供了证据[38]。
4 展望
目前,G-quadruplex、G-triplex、i-motif这3种DNA特殊二级结构不仅在体外适宜条件下得到了较为深入的研究,在体内的作用也经过了初步验证。尤其是在端粒末端、原癌基因启动子区域中G-quadruplex和i-motif的普遍存在,间接说明这些特殊的二级结构具有调控基因翻译、转录以及作为抗癌药物靶点等的功能。目前,对于这些DNA特殊二级结构的研究也主要集中在调节机制、体外检测(如生物传感器)、体内基因调控和癌症的预防和治疗上。虽然研究人员已经对它们的结构进行了全面的表征,并且证明了其具有在正常生理代谢中潜在的调控功能,但是由于碱基种类繁多,排列方式多样,目前发现的具有特殊结构及功能的核酸序列也仅仅是众多核酸中的一小部分,还有很多的具有功能的核酸序列及其特殊的二级结构有待开发利用。同时,随着科技的进步、技术的创新,基于G-quadruplex、G-triplex、i-motif结构对相关基因进行调节与药物的研发和递送,特别是它们在生物传感器中的应用,也会受到各相关研究领域的重视。

