SNP array技术与染色体核型分析在高危孕妇产前诊断的应用
曾书红,江矞颖,王元白,庄建龙
染色体核型分析技术是应用最广泛的细胞遗传学检测方法,目前仍是细胞遗传学产前诊断的“金标准”。但其分辨率较低,仅可检测5~10 Mb的遗传物质改变,且细胞培养耗时长。染色体微阵列(chromosome microarray analysis,CMA)技术包括基于微阵列的比较基因组杂交技术和单核苷酸多态性微阵列(single nucleotide polymorphism array,SNP array)技术,该技术能够检出染色体微小缺失、重复及不平衡重排。目前,该技术已成为儿童复杂罕见病、自然流产及染色体无法确定异常片段来源的推荐遗传学检测方法[1]。近年CMA技术在产前诊断领域中的应用越来越广泛,但尚缺乏基于人群的大规模应用研究结果。已有研究报道对于产前超声异常而染色体核型分析正常时,CMA技术可作为首选检测方法[2-3]。同时,2013年美国妇产科医师协会(ACOG)发布了染色体微阵列分析在产前诊断中应用的实践指南,建议在产前超声发现胎儿有一个或多个结构异常的孕妇行介入性产前诊断时,推荐使用染色体微阵列分析,可取代核型分析[4]。国内对于CMA技术在超声异常胎儿的产前诊断应用已有研究[5-7],但是在不同高危因素间检出差异的研究很少。本研究旨在探讨传统染色体核型分析与SNP array技术在高危孕妇中染色体致病性核型检出的差异,同时了解SNP array技术在不同高危因素间致病性拷贝数变异检出情况,探讨其在不同高危孕妇中的临床应用价值。
1 对象与方法
1.1 研究对象 收集2016年1月—2018年6月至我院产前诊断中心就诊且同时行染色体核型分析及SNP array检测的高危孕妇共356例。所有研究对象检测前均签署知情同意书。孕妇年龄21~47岁,孕周18~23+6周。符合以下任何一项视为高危孕妇:①超声异常;②高龄(≥35岁);③有不良孕史;④血清学筛查高风险(唐氏筛查高风险或无创产前筛查高风险);⑤父母至少一方染色体异常;⑥其他因素,如孕早期接触过可致胎儿先天缺陷的物质等。拷贝数变异(copy number variants,CNVs)的判读:按照CNVs临床意义界定的指南[8]对>100 kb的CNVs 进 行 分 类:①致 病 性CNVs (pathogenic CNVs,pCNVs);②良性CNV(benign CNVs,bCNVs);③临床意义不明确的CNVs(variants of unknown significance,VOUS):包括可能致病VOUS、可能良性VOUS和未分类VOUS。本研究致病性核型定义为染色体数目异常、染色体不平衡重组。本研究经泉州市妇幼保健院·儿童医院伦理委员会批准(2019No.13)。
1.2 羊水细胞培养和染色体核型分析 将羊膜腔穿刺获得的20 mL羊水离心后弃上清,接种于羊水培养基中,置37 ℃、5%CO2培养7~10 d。用胰酶消化法收获羊水细胞,由自动染色体收获系统Sinochrome ChromprepⅡ(上海乐晨生物科技有限公司)进行染色体制备,将染色体制备后悬液进行滴片、烤片,经吉姆萨染液染色后进行核型分析。每例计数30个核型,分析5个核型。
1.3 DNA提取及SNP array检测 使用QIAamp DNA Blood Kit(QIAGEN)试剂盒进行羊水DNA抽提,抽提方法参照QIAamp DNA Blood Kit Handbook(www.qiagen.com)。使用Affymetrix CytoScanTM750K芯片、扩增试剂盒(ClonTECHTMDNA扩增试剂盒)、纯化杂交试剂盒(Affymetrix),参照Affymetrix CytoScan Assay USER GUIDE(http://www.thermofisher.com)进行酶切、连接、扩增、纯化、片段化标记、杂交以及扫描和分析,3 d得到所有实验结果。结果判读参照DGV(http://dgv.tcag.ca/dgv),OMIM(https://omim.org/),DECIPHER(https://decipher.sanger.ac.uk),Pubmed(https://www.ncbi.nlm.nih.gov/pubmed/)等数据库。
1.4 统计学方法 采用SPSS 19.0软件进行数据分析。定性资料用率表示,组间比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 染色体核型分析及SNP array检测结果 356例行羊水穿刺的高危孕妇中,2例羊水培养失败,4例SNP array检测失败。染色体核型分析及SNP array均成功检测的高危孕妇共余350例。染色体核型分析结果显示,检出染色体变异46例,包括非整倍体14例,染色体结构异常18例(10例平衡重组和8例不平衡重组),染色体多态变异12例和marker染色体2例,见表1。SNP array检测结果显示,共检出86例CNVs,包括37例pCNVs,46例VOUS及3例bCNVs,见表2。
2.2 两种方法检测结果比较 350例高危孕妇染色体核型分析致病性核型检出率6.29%(22/350),SNP array pCNVs检出率10.57%(37/350)。两种方法致病性核型检出率差异有统计学意义(χ2=10.316,P=0.001),见表3。264例SNP array检测未检出拷贝数变异的高危孕妇染色体核型检出异常16例,包括3例倒位、4例平衡易位和9例染色体多态变异。304例染色体核型分析未见异常高危孕妇中SNP array检出56例CNVs,其中pCNVs 14例,VOUS 40例,bCNVs 2例。见表1。
2.3 不同高危因素间SNP array检出结果比较 在350例高危孕妇中,对不同高危因素间SNP array检出结果进行分析发现,不同高危因素间pCNVs检出率差异有统计学意义(χ2=13.238,P=0.021)。本研究还发现在合并两项及以上高危因素时,pCNVs检出率均最高,并且两项及以上高危因素中SNP array pCNVs检出率(19.79%)明显高于传统染色体核型致病 性 核 型 检 出 率13.54%(13/96)(χ2=4.167,P=0.031)。见表4、表5。
2.4 妊娠结局随访 所有研究对象均进行电话或门诊随访,随访妊娠结局为90%(315/350)。其中,37例携带pCNVs的胎儿孕妇选择终止妊娠21例,继续妊娠7例(6例体健,1例神经肌肉发育异常),失访9例;46例携带VOUS的胎儿中孕妇选择终止妊娠23例,继续妊娠15例(14例体健,1例听力障碍),失访8例。3例携带良性CNVs胎儿孕妇选择继续妊娠2例(体健),失访1例。

表1 染色体核型分析及SNP array检测结果
3 讨论
近年CMA发展迅速已成为检测染色体微缺失微重复的有力工具。SNP array检测技术除了能够检测染色体CNVs,还能够检出大多数单亲二倍体和三倍体,并可检出一定水平嵌合体。传统染色体核型分析分辨率低且细胞培养耗时长,但是对平衡易位及倒位等有互补检出作用。本研究通过对高危孕妇行染色体核型分析及SNP array技术检测,探讨传统染色体核型分析与SNP array技术在高危孕妇中致病性核型检出差异,分析SNP array技术在不同高危因素间检出情况。
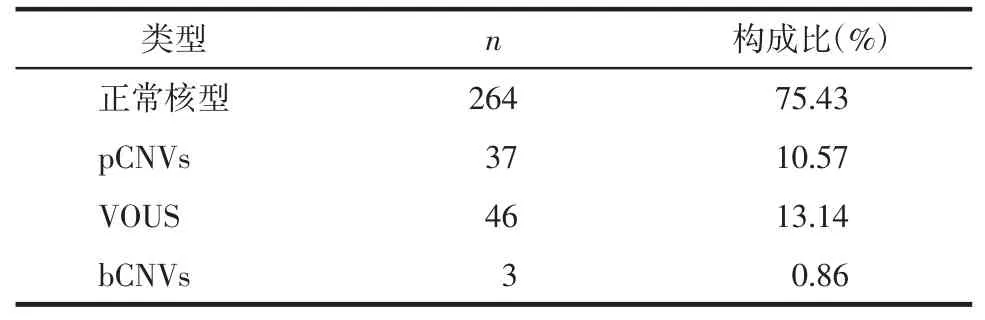
表2 SNP array检出类型
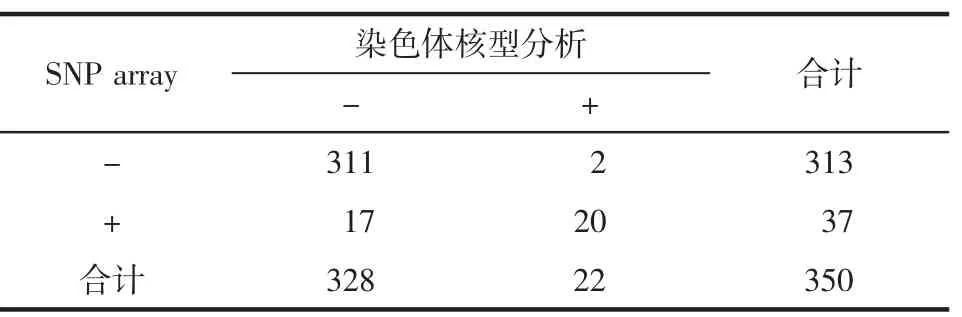
表3 两种方法致病性核型检出率比较

表4 不同高危因素SNP array检出情况 (例)
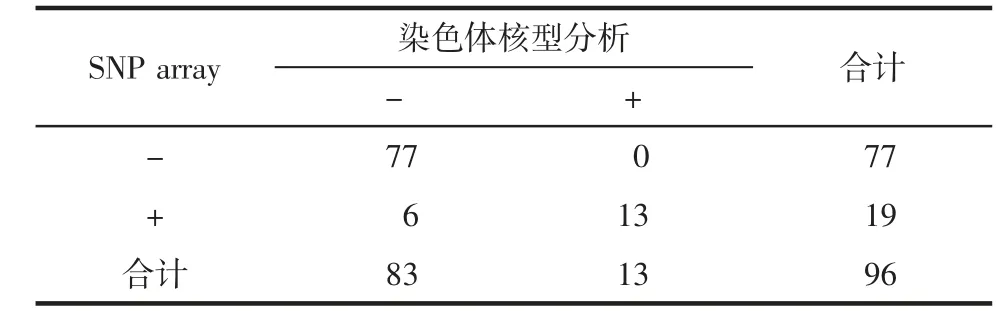
表5 两项及以上高危因素中两种方法致病性核型检出率比较 (例)
本研究中,传统染色体核型分析致病性核型检出率为6.29%,SNP array pCNVs检出率为10.57%,两种检测方法致病性核型检出率差异有统计学意义(P=0.001)。李闪闪等[9]的研究发现,高危孕妇产前诊断中CMA及染色体核型分析的染色体异常检出率分别为10.95%和9.22%,两者染色体异常检出率差异无统计学意义(P=0.362)。而常亮等[10]的研究发现,SNP array技术在高危孕妇的检出率(11.3%)高于染色体核型分析(6.4%),差异有统计学意义(P=0.039)。本研究结果与李闪闪等[9]的研究不一致,但与其他相关研究一致[10-11]。分析可能与本研究仅分析比较致病性核型检出率有关。另外,传统染色体核型分析检出14例非整倍体,与SNP array检出结果一致。SNP array对非整倍体的检出率为100%。染色体核型分析检出染色体结构异常18例,其中平衡重组10例。在平衡重组中SNP能够检出平衡重组中伴随的拷贝数变异3例,包括1例pCNVs、1例VOUS及1例bCNVs。SNP array能够检出平衡重组核型中伴随的其他微小变异,约30%(3/10)。在8例不平衡重组的染色体结构异常中,SNP array均能检出拷贝数变异,SNP array对不平衡重组检出率为100%。染色体核型分析检出染色体多态性12例,SNP能够检出3例拷贝数变异,均为VOUS。同时,本研究共发现2例marker染色体,SNP array检测结果均提示为pCNVs。SNP array能够帮助明确marker染色体的来源。同时,染色体核型分析对平衡易位及倒位等有互补检出作用。
在临床咨询工作中,临床医生应明确CMA与核型分析的优缺点,尽量动员高危孕妇行有创产前诊断,以提高胎儿染色体异常检出。同时,行CMA检测前应充分告知该技术的优缺点,检测敏感度增加的同时也会提高VOUS的检出率,对一些VOUS的致病性尚无定论,需结合超声检查进一步观察胎儿生长发育情况。VOUS是临床咨询的难点,这种无法对VOUS给出确切的临床性质判读,往往导致孕妇及家属焦虑,甚至是错误地终止妊娠[1]。本研究中检出46例VOUS,最终选择终止妊娠23例。国外关于VOUS的检出率通常小于5%[12-15],而本研究中VOUS检出率为13.14%,远高于国外的研究报道,但与国内报道的VOUS检出率类似[16-17]。另外,该研究中检出VOUS经双亲验证8例,其中6例遗传自父母,判读为偏良性VOUS,选择继续妊娠4例,体健;2例为新发突变,判读为VOUS或偏致病性,均选择终止妊娠。本研究中VOUS检出率较高,分析原因可能为SNP array检测较昂贵,双亲验证比例不高,本地化数据库不完善等。
本研究还发现,不同高危因素间pCNVs检出率差异有统计学意义。当合并两项及以上高危因素时SNP array pCNVs检出率最高,且均显著高于传统核型致病性核型检出率。另外,在单项危险因素中,夫妇染色体异常组pCNVs检出率最高,为15.38%(2/13),其次为超声异常组7.83%(9/115)。分析原因可能为夫妇染色体异常增加了胎儿出现pCNVs的风险,应引起重视,但不排除与夫妇染色体异常组样本量不足有关。
综上所述,SNP array技术在高危孕妇产前诊断中pCNVs检出率高于染色体核型分析致病性核型检出率。但传统染色体核型分析又能够发现SNP array不能解决的染色体平衡重组。因此,SNP array联合染色体核型分析能够有效提高产前诊断遗传病检出率。同时,不同高危因素间pCNVs检出率有明显差异,当合并两项及以上高危因素时,SNP array技术可作为产前诊断的首选检测方法。

