喉鳞状细胞癌患者术前淋巴细胞和单核细胞比值与预后的相关性
庞振文,何东生,杨爱芳,黄愉峰,曾先捷
0 引 言
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)作为最常见的头颈部恶性肿瘤之一,2015年中国LSCC新发病例26300例,死亡14500例;2019年美国预计LSCC 新增12410 例,死亡3760 例[1-2];其具有浸润性较强、颈部淋巴结易转移、预后差等临床特征[3]。近年来,LSCC 5 年的生存率仍存在下降的趋势[4]。因此,寻找敏感的预后评估指标,尽早干预,对提高患者的生存率有重要的临床意义。近年来,研究发现外周血淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)与各种癌症预后相关。治疗前外周血LMR 的升高水平与未分化型甲状腺癌[5]、卵巢癌[6]的良好预后相关。外周血LMR的降低水平与舌癌[7]、食管癌[8-9]、鼻咽癌[10]、阴茎癌[11]等实体肿瘤预后相关。最近有研究报道LMR在头颈部恶性肿瘤预后评估中有重要价值[12]。然而,目前关于LMR对LSCC患者的预后尚未确切,本研究旨在评估术前LMR与LSCC患者预后的关系。
1 资料与方法
1.1 一般资料回顾性分析2008 年1 月至2017 年12月广西医科大学附属肿瘤医院147例头颈外科行LSCC 手术治疗患者的临床资料。其中男141 例(95.9%),女6例(4.1%),年龄40~84岁,中位年龄59岁,平均年龄60.3 岁。颈部淋巴转移38 例,无转移109 例;其中单侧转移30 例,双侧转移8 例。纳入标准:①首次病理确诊的LSCC患者;②无其他恶性肿瘤病史;③术前无辅助化疗/放疗、无输血史;④实验室检查、影像学检查等临床资料齐全。排除标准:①活动性炎性疾病或者近期伴随感染的;②自身免疫性疾病或服用类固醇药物治疗;③术前有血液病或接受该疾病治疗的;④伴随严重心、肺、脑疾病者。
1.2 治疗方式术后放疗或放、化疗的指征及治疗方式根据国家癌症综合网络指南[13]。
1.3 随访及评估指标随访开始时间2008年4月,前2 年3~6 个月随访1 次,之后6 个月~1 年随访1次,随访截止至2018 年1 月,随访时间为2~120 个月。失访6例。随访方式包括定期通过病例跟踪或电话随访、门诊复查、住院治疗。以总生存期(overall survival,OS)作为评估指标,OS 为手术日至死亡日或最近1次随访;以月为单位。
1.4 统计学分析采用SPSS 22.0 统计软件进行分析。率的比较使用χ2检验或Fisher 精确检验;采用Kaplan-Meier 绘制生存曲线,差异性分析进行Logrank检验。单因素和多因素Cox比例风险模型分析影响OS 的影响因素。以P≤0.05为差异有统计学意义。
2 结 果
2.1 最佳LMR 截断值ROC 曲线曲线下面积为0.723(P <0.001),见图1。该指数的最大值(约登指数)为最佳临界值,即LMR=3.24,分为高LMR 者(n=81,LMR≥3.24)和低LMR者(n=66,LMR<3.24)。
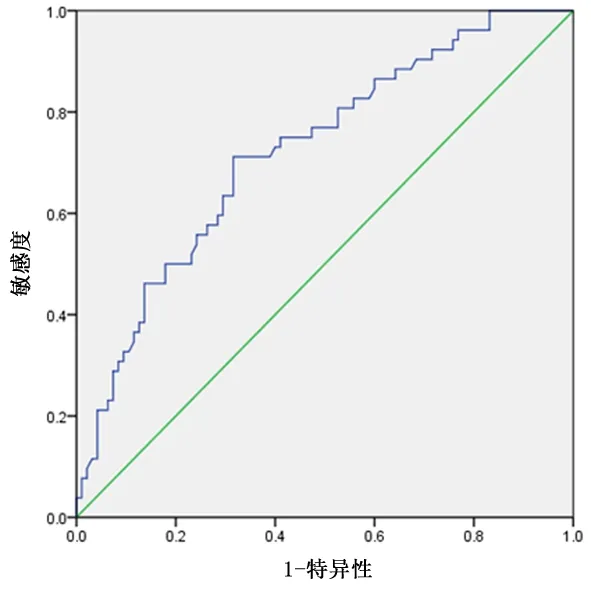
图1 LSCC患者LMR的ROC曲线分析Figure 1 ROC curve analysis of the LMR of the LSCC patients
2.2 LMR 与LSCC 患者临床特征的关系高LMR者和低LMR者不同肿瘤部位分型、T分期、N分期、临床分期比较差异有统计学意义(P<0.05)。见表1。
2.3 LMR与LSCC患者的生存关系所有患者中位随访时间为64个月,高LMR者1、3、5年的总生存率(98.76%、92.59%、85.18%)明显高于低LMR者(87.88%、69.70%、60.60%),差异有统计学意义(P<0.001),见图2。
2.4 LSCC 患者总生存期的影响因素分析单因素Cox 比例风险模型分析结果显示,吸烟、T 分期(T3~T4)、临床分期(Ⅲ~Ⅳ)、淋巴结转移(N+)、术前低LMR 是影响OS 的预后危险因素(P<0.05),见表2。多因素Cox 比例风险模型分析结果显示,淋巴结转移(N+)、术前低LMR 是影响患者OS 的危险因素(P<0.05),见表3。
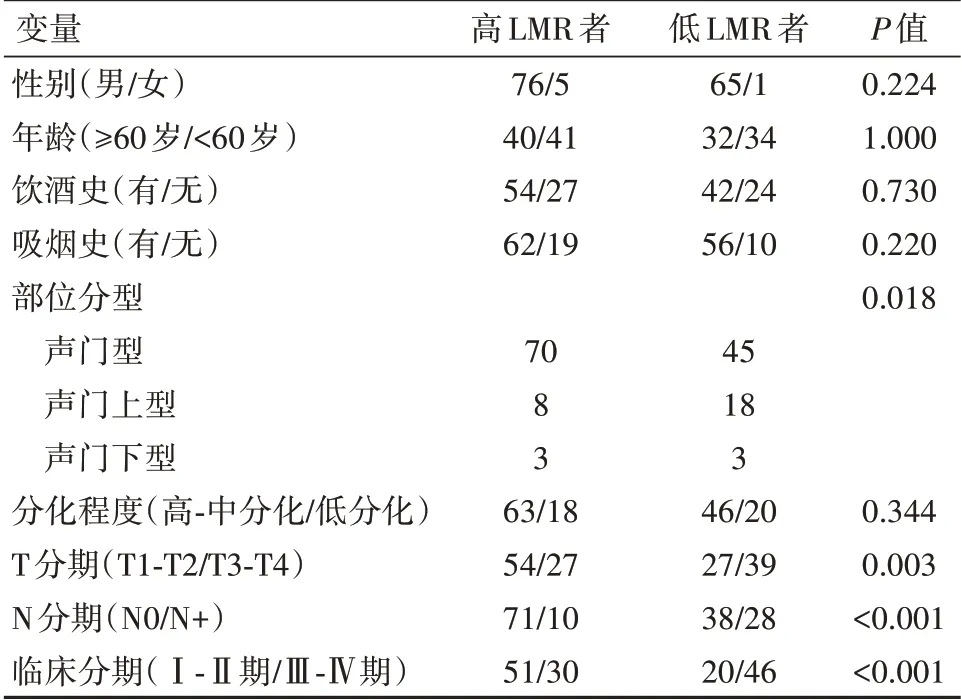
表1 LMR与LSCC患者临床特征关系(n)Table 1 Relationship between LMR and the clinicopathological features of the LSCC patients(n)
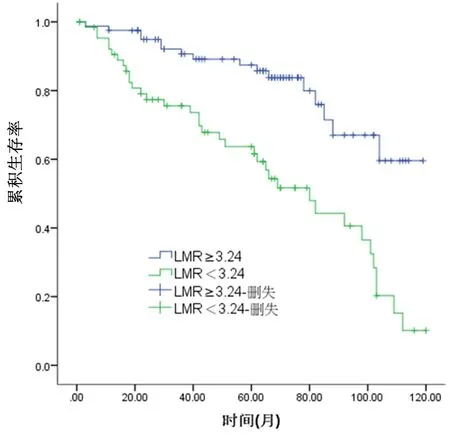
图2 LMR与LSCC患者的总生存曲线Figure 2 Overall survival curve for the LSCC patients in different LMR groups
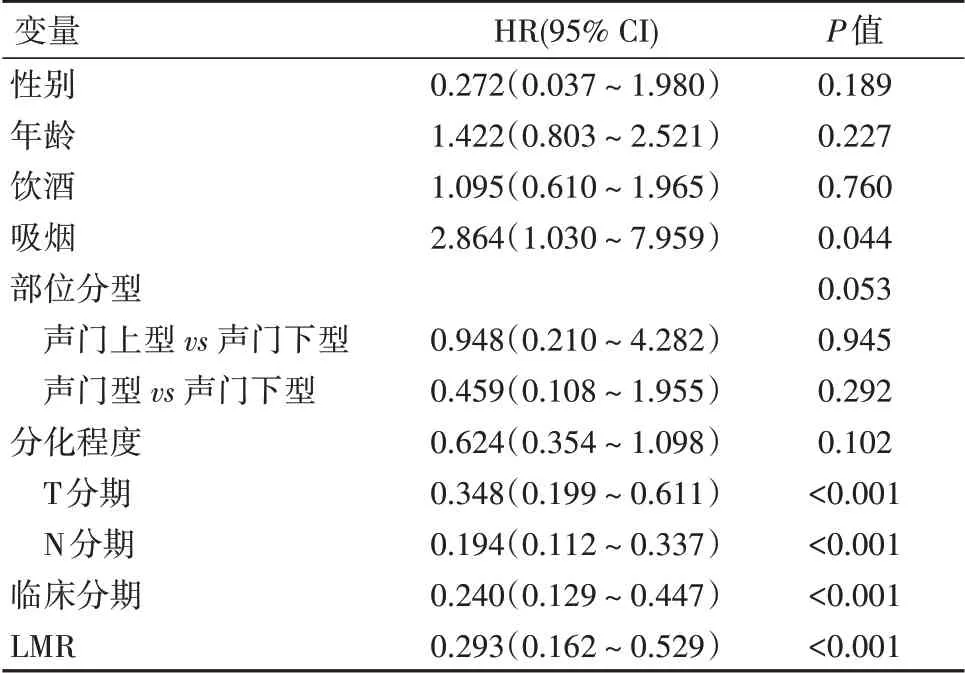
表2 LSCC 患者OS 的单因素Cox 比例风险回归模型影响因素分析Table 2 Factors influencing the overall survival of the LSCC patients: Results of univariate analysis with the Cox proportional hazard model
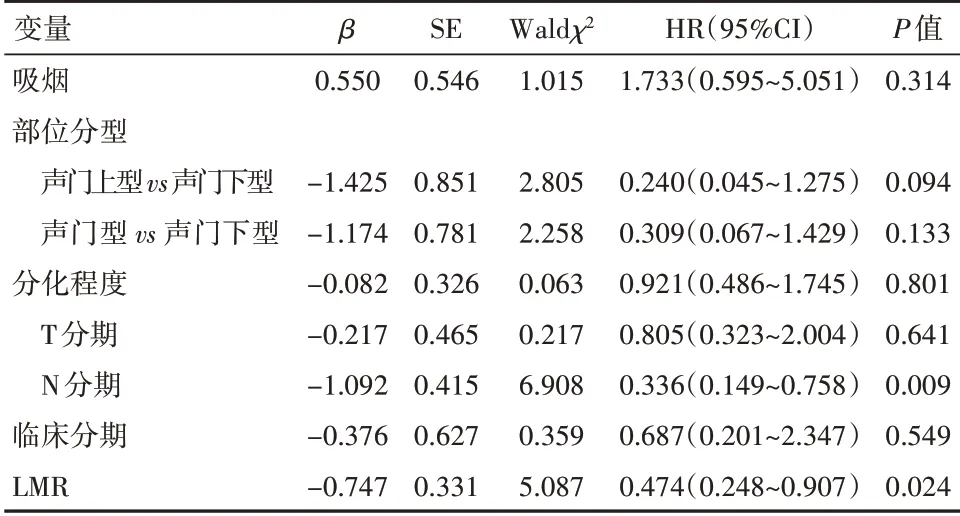
表3 LSCC 患者OS 的多因素Cox 比例风险回归模型影响因素分析Table 3 Factors influencing the overall survival of the LSCC patients: Results of multivariate analysis with the Cox proportional hazard model
3 讨 论
目前,以手术治疗为主,结合全身化疗、放射治疗及靶向治疗的综合治疗为LSCC 最有效的治疗方式[14-15]。寻找预测预后的危险因素,可为患者精准治疗提供依据,改善患者的预后,是研究探索的重点。目前恶性肿瘤的预后与宿主全身免疫反应的相关性已经被大量研究证实,治疗前的免疫相关指标往往能反映恶性肿瘤患者的预后;研究表明,肿瘤发展过程中,微环境的免疫应答、免疫细胞浸润与肿瘤进展密切相关,而肿瘤的进展会影响其预后;通过减少宿主的炎症细胞介质或通路能抑制肿瘤的进展,能改善预后[16-17]。所以,寻找敏感的预后指标,尽早干预,分析喉癌的临床特征及提高患者的生存率,具有极其重要的意义。
LMR 可作为评价机体整体状态及免疫反应的指标,在头颈部恶性肿瘤预后评估中有重要的参考价值。LMR 降低反映了相对低淋巴细胞和高单核细胞水平的失衡状态,共同形成肿瘤微环境。微环境中肿瘤浸润单核细胞主要通过促进肿瘤细胞形成、增殖和肿瘤血管新生,从而促进肿瘤进展、转移,而肿瘤浸润淋巴细胞如CD8+T 细胞在肿瘤患者能发挥免疫作用,具有较强的抗肿瘤能力[18-19]。然而,肿瘤细胞增殖过程中引起的组织破坏和细胞崩解可引起体内广泛肿瘤相关的免疫反应,这一过程可伴随着淋巴细胞计数的降低。淋巴细胞数量的减少导致机体免疫应答功能减弱,抗肿瘤能力的下降[20]。有研究表明,单核细胞计数升高与生存时间短有关,原因是单核细胞可分泌多种炎性细胞分子,促进肿瘤形成、血管生成和远处转移[11]。本研究显示,LMR下降与更差的T分期、N分期、临床分期相关。同时,本研究高LMR 者与低LMR 者的生存时间比较,后者的1、3、5年总生存率较低,且差异均有统计学意义,表明低LMR 值有较差的预后,与上述相关研究一致。说明了术前LMR 在LSCC 预后评估方面有一定的参考价值。
LSCC 的预后与多种因素有关,本研究Cox 风险模型单因素分析显示吸烟、淋巴结转移(N+)、术前低LMR、更差的T 分期及临床分期是影响患者总生存期的危险因素,与相关文献报道[11,13]基本一致。但本研究发病年龄不是影响预后的相关危险因素,推测原因可能为发病年龄比较集中、区域差异等因素。多因素分析显示术前低LMR、淋巴结转移是影响患者总生存期的危险因素,表明淋巴结转移及术前低LMR在LSCC预后评估中有极其重要的意义。
而术前LMR 可作为癌症预后的一个独特指标,具有特异性及敏感性、重复性强、检测简便、经济实用等优点,对评估LSCC 的预后有一定的参考价值。研究证实LMR 是影响头颈部恶性肿瘤预后的独立危险因素[11],Furukawa 等[7]报道术前LMR 是影响舌癌预后的独立危险因素,LMR 降低提示预后不良。本研究分析其临床特征及影响预后的相关因素,表明LSCC 与术前LMR 有一定的相关性;进一步分析显示术前低LMR 是影响LSCC 预后的危险因素,结合其总生存期的关系,说明术前LMR 与LSCC 术后的预后密切相关,术前LMR降低,预后会较差。
综上所述,LSCC 预后与术前LMR 有一定的相关性,术前高LMR 值LSCC 患者有着更好的总生存期,表明术前LMR 值在LSCC 患者预后评估中有一定的临床参考价值。

