温石棉和陶瓷纤维致大鼠炎症及氧化应激的毒性效应
黄柳雯,崔 琰,查雨欣,柏 ●,董发勤,邓建军,张青碧,王国俊
(1. 西南医科大学 药学院, 四川 泸州 646000; 2. 西南医科大学 公共卫生学院, 四川 泸州 646000; 3. 四川省疾病预防控制中心, 四川 成都 610041; 4. 西南科技大学, 四川 绵阳 621010; 5. 绵阳四〇四医院, 四川 绵阳 621000; 6. 西南医科大学附属医院药学部, 四川 泸州 646000)
温石棉是性能优异、储量丰富、价格低廉的矿物纤维材料,由于具有耐腐蚀、耐高温、绝缘性好、抗张力强等优良性能,被广泛应用于防火、隔热、防腐、隔音和绝缘等方面(樊晶光等, 2016)。中国石棉资源绝大部分为温石棉矿,占石棉总产量的95%以上。温石棉能以纤维的形式在环境中扩散沉积,造成污染。石棉纤维的环境暴露会导致多种人类疾病,包括石棉沉滞症、胸膜斑、肺癌、间皮瘤和非呼吸系统疾病(Huangetal., 2011)。国际上对温石棉的安全性存在争议(Yarborough, 2007; Vanchugovaetal., 2008),一些非石棉生产国,特别是西方发达国家提倡使用温石棉的人工代用纤维,如陶瓷纤维、玻璃纤维和岩棉纤维等。人们往往认为只要无石棉化了,其代用纤维及其制品就是安全的。然而在2002年,国际癌症研究机构(IARC)将陶瓷纤维归类为人类可疑致癌物的2B组,将玻璃纤维和岩棉纤维归类为现有证据不能对人类致癌性进行分类的第3组(Andersenetal., 2002)。有研究发现,陶瓷纤维可诱导工人产生胸膜斑(Lockeyetal., 2012),表明其可能仍具有生物活性和致病性,因此,开展温石棉人工代用纤维的安全性研究同等重要。目前对温石棉和陶瓷纤维致机体炎症及氧化应激的毒性机制研究尚不清楚,有学者提出细胞内ROS(活性氧簇)可以引起细胞凋亡和炎症反应(Funahashietal., 2015),而温石棉能够诱导细胞产生大量活性氧而致氧化损伤和细胞凋亡(Nagaietal., 2011),陶瓷纤维可通过潜在产生的自由基活性表现出细胞毒性(Eliasetal., 2002)。
目前有较多温石棉和陶瓷纤维的体外毒性研究,而体内动物研究较少。因此本研究拟采用陶瓷纤维和我国青海茫崖矿区的天然温石棉对Wistar大鼠进行多次非暴露式气管滴注染毒,分别于染毒1、6和12个月时,观察大鼠肺部的病理变化,支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中白细胞总数及类型的变化,肺组织中相关炎性细胞因子白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和核因子-κB(nuclear factor-κB, NF-κB)含量的变化,以及活性氧簇(reactive oxygen species, ROS)、脂质过氧化产物丙二醛(malondiadehyde, MDA)浓度和超氧化物歧化酶(superoxide dismutase, SOD)活力的变化,为探讨和比较温石棉和陶瓷纤维毒性提供依据。
1 材料与方法
1.1 主要试剂与仪器
实验主要仪器包括:7200型分光光度计(优尼柯上海仪器公司),Multiskan Spectrum酶标仪(美国Thermo公司),5810R冷冻离心机(德国Eppendorf公司),HS-800D恒温水浴箱(华利达实验设备公司),Ultra55场发射扫描电子显微镜(德国蔡司仪器公司),Mastersizer2000马尔文激光粒度分析仪(英国马尔文仪器公司),X’Pert PRO荧光衍射分析仪(荷兰帕纳科公司);主要试剂包括:IL-6、TNF-α酶联免疫检测试剂盒(美国R&D公司),NF-κB酶联免疫检测试剂盒(武汉华美生物工程有限公司),ROS、MDA和SOD检测试剂盒(南京建成生物制品研究所)。
1. 2 方法
1.2.1 样品的制备
采自我国青海茫崖矿区的天然温石棉(西南科技大学惠赠)和购买的陶瓷纤维(购于淄博民烨耐火纤维有限公司)作为受试物。用高速粉碎机初步粉碎2~3 min,然后用星球磨机分别湿磨18 h和5 h,收集矿浆,置于150 ℃烘箱内烘烤2 h,磨碎备用。
1.2.2 理化特性分析
采用扫描电镜分析温石棉和陶瓷纤维粉体形貌结构,激光粒度分析仪测定粒径,X射线荧光光谱仪分析主要化学组分。
1.2.3 实验动物与分组
选择健康初断乳SPF级(specific pathogen free动物,即无特定病原体动物,是指除清洁动物应排除的病原外,不携带主要潜在感染或条件致病和对科学实验干扰大的病原的实验动物)Wistar雄性大鼠54只,4~6 周龄,体重为180~220 g,由西南医科大学实验动物中心提供(经西南医科大学动物伦理审查委员会同意,合格证号:201601011),随机分为3组,即温石棉染毒组、陶瓷纤维染毒组和阴性对照组(生理盐水),每组18只,分笼喂养。
1.2.4 实验动物染毒及样品采集
称取质量为0.02 g充分消毒杀菌的粉体,加入生理盐水,制备成浓度为2.0 mg/mL的粉尘悬液,每次临用前超声震荡30 min。采用非暴露式气管滴注法染毒质量浓度为2.0 mg/mL粉尘悬液0.5 mL,染毒频率1次/月。阴性对照组使用生理盐水,滴注后自由饮水、进食。分别在滴注1、6和12个月时各取材6只。将大鼠麻醉后仰卧固定,迅速取出右肺组织并称量,分装于EP管,置 80℃冰箱保存备用。用37℃生理盐水灌洗大鼠左肺3~5次收集BALF,每次回收率需达到80%。回收的灌洗液以2 000 r/min离心15 min,弃上清液,细胞沉淀制成细胞悬液涂于细胞计数板,Giemsa染色,光镜下进行白细胞总数统计及其细胞分类计数。
1.2.5 大鼠肺组织病理学检测
选取主支气管周围肺组织,经生理盐水反复冲洗后,置10%甲醛水溶液中固定,常规脱水,石蜡包埋,切片,经苏木素-伊红(HE)染色后光学显微镜下观察肺组织的病理变化。
1.2.6 大鼠肺组织中IL-6、TNF-α和NF-κB的含量测定
白介素-6(IL-6)是由活化的T细胞和成纤维细胞产生的淋巴因子,其失调的持续产生会导致各种自身免疫性和慢性炎性疾病的发生和发展;肿瘤坏死因子α(TNF-α)是主要由单核细胞和巨噬细胞产生的一种单核因子,具有强大的促炎和免疫调节作用;核因子κB(NF-κB)蛋白选择性的结合在B细胞κ-轻链增强子上调控许多基因的表达,参与细胞对外界刺激的响应,如细胞因子、重金属、病毒等,在细胞的炎症反应、免疫应答等过程中起到关键性作用。IL-6、TNF-α和NF-κB的含量测定采用酶联免疫吸附试验(ELISA),具体操作步骤严格按照试剂盒说明书进行。
1.2.7 大鼠肺组织中ROS、MDA浓度及SOD活力的测定
ROS、MDA浓度及SOD活力的测定分别采用ELISA双抗体夹心法、硫代巴比妥酸(TBA)比色法和黄嘌呤氧化酶法测定,具体操作步骤严格按照试剂盒说明书进行。
1. 3 统计学方法
采用SPSS21.0统计软件进行数据的统计分析。定量资料若服从正态分布、方差齐,组间比较采用单因素方差分析,两两比较采用SNK-q法检验,若方差不齐则采用Kruskal-Wallis检验,检验水准α=0.05。
2 结果
2.1 温石棉和陶瓷纤维的形貌分析
由图1可见,温石棉纤维呈较硬直的纤维状或针状,排列成平行或倾斜的束状结构;陶瓷纤维多呈柱状或块状,纤维状颗粒的长径比更小,纤维直径分布较广。
2.2 温石棉和陶瓷纤维的粒径分布
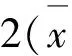
2.3 温石棉和陶瓷纤维的主要化学组分
由表1可见,温石棉的主要化学成分为SiO2(40.82%)和MgO(39.20%),还含少量的Fe2O3(4.97%)和Al2O3(2.12%);陶瓷纤维的主要化学成分为SiO2(54.44%)和Al2O3(43.63%)。
2.4 大鼠肺组织的病理变化
阴性对照组在染毒12个月时才出现少量炎性细胞浸润。温石棉和陶瓷纤维染毒组在染毒1个月时,炎性细胞增多、肺间隔轻微增宽、少许淋巴细胞聚集、肺泡结构遭到破坏(如图3b、3f箭头所示);染毒6个月时,上述现象进一步加重并出现少许纤维化、肺间隔断裂、肺泡融合(如图3c、3g箭头所示);染毒12个月时,陶瓷纤维染毒组病理特征与染毒6个月时比较无明显变化(如图3h、3g箭头所示),而温石棉染毒组与染毒6个月时比较病理损害加重,肺泡结构破坏严重、出现较多肺大泡和大面积的纤维化(如图3d、3c箭头所示)。

图 1 温石棉(a)和陶瓷纤维(b)的扫描电镜图像 Fig. 1 Scanning electron microscopy image of chrysotile asbestos (a) and ceramic fibers (b)
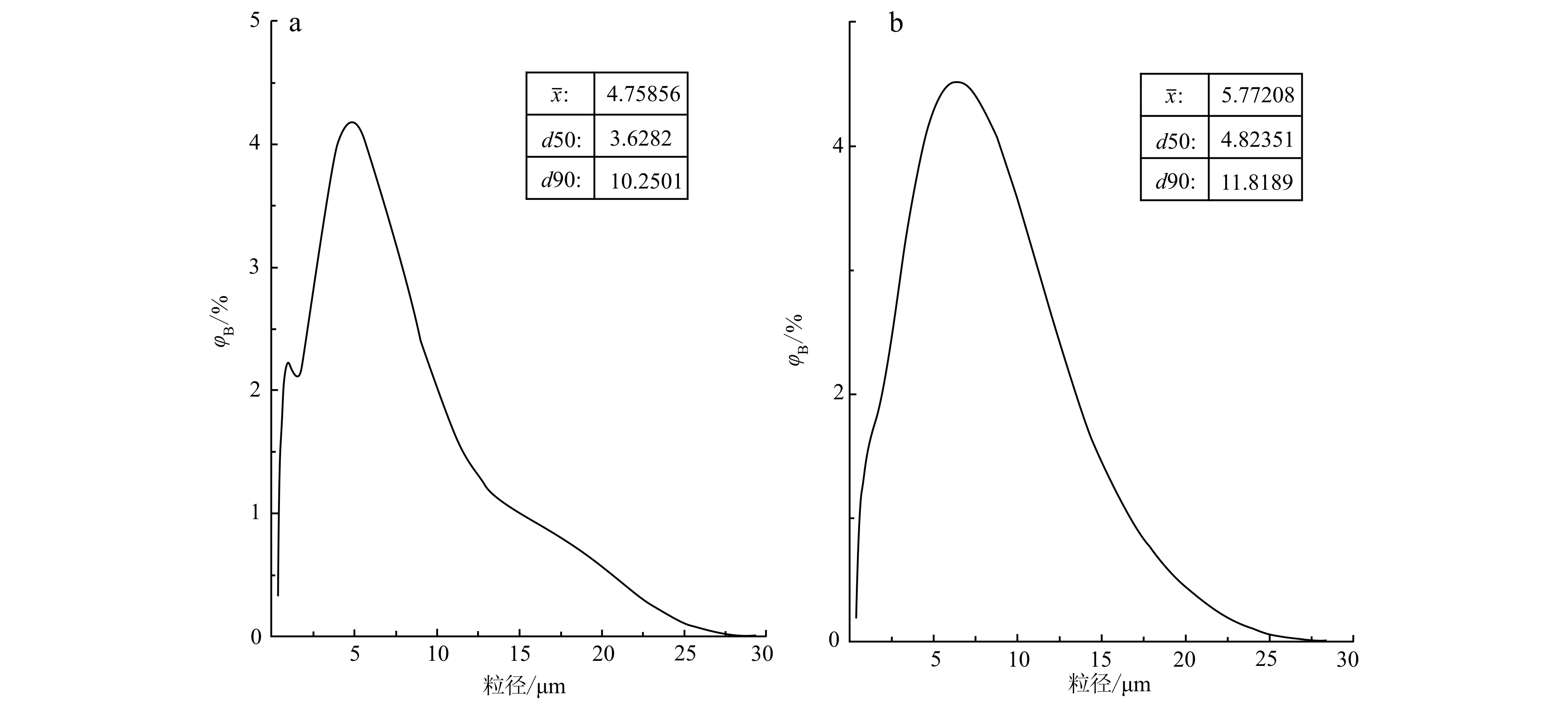
图 2 温石棉(a)和陶瓷纤维(b)的粒径分布图Fig. 2 Particle size distribution of chrysotile asbestos (a) and ceramic fibers (b)
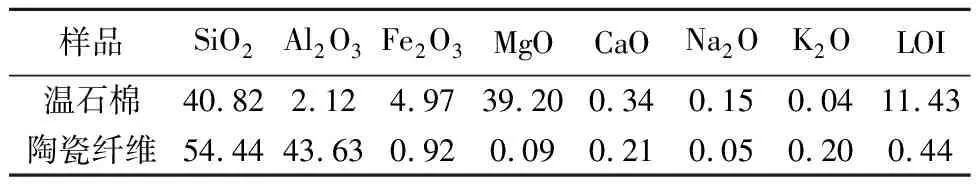
表 1 温石棉和陶瓷纤维的主要化学组分分析 wB/%Table 1 Analyses of main chemical composition of chrysotile asbestos and ceramic fibers
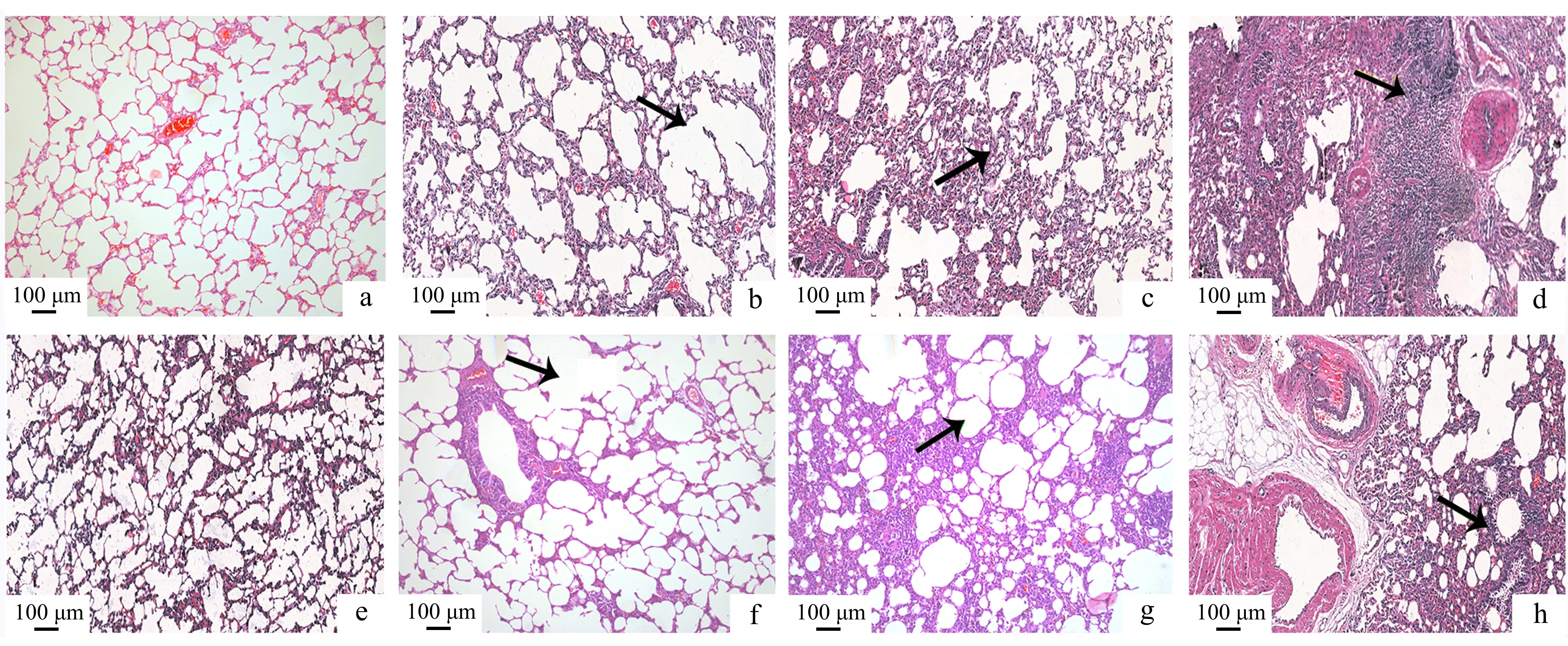
图 3 温石棉和陶瓷纤维染毒大鼠肺组织的病理学改变Fig. 3 Pathological changes in lung tissues of rats exposed to chrysotile asbestos and ceramic fibersa、e—1个月和12个月阴性对照组; b~d—1、6和12个月温石棉染毒组; f~h—1、6和12个月陶瓷纤维染毒组a, e—1 month and 12 months control groups; b~d—1, 6 and 12 months chrysotile asbestos exposure groups; f~h—1, 6 and 12 months ceramic fibers exposure groups
2.5 大鼠BALF中白细胞总数及分类
本文用SPSS统计软件进行假设检验得到p值,为原假设为真时所得到的样本观察结果或更极端结果出现的概率。如p值很小,说明原假设情况发生的概率很小,根据小概率原理,则拒绝原假设。统计学根据显著性检验方法所得到的p值一般以<0.05 为有统计学差异。表2显示,在染毒的各个时间点,两个染毒组BALF中白细胞总数均高于阴性对照组(p<0.05);两个染毒组BALF中,白细胞总数、中性粒细胞和淋巴细胞的百分比均随染毒时间延长而升高(p<0.05),巨噬细胞百分比均随染毒时间延长而下降(p<0.05),均呈现时间-效应关系(p<0.05)。
2.6 大鼠肺组织中细胞因子IL-6、TNF-α和NF-κB含量的变化
表3显示,在染毒的各个时间点,两个染毒组肺组织中IL-6、TNF-α和NF-κB的含量均高于阴性对照组(p<0.05);两个染毒组肺组织中IL-6、TNF-α和NF-κB的含量随染毒时间延长而升高(p<0.05),均呈现时间-效应关系(p<0.05);在染毒的各个时间点,温石棉染毒组肺组织中IL-6、TNF-α和NF-κB的含量均高于陶瓷纤维染毒组(p<0.05)。
2.7 大鼠肺组织中ROS、MDA浓度及SOD活力的变化
表4显示,在染毒的各个时间点,两个染毒组肺组织中ROS和MDA浓度均高于阴性对照组(p<0.05);两个染毒组肺组织中SOD活力在染毒一个月时与阴性对照组比较无差异(p>0.05),在染毒6个月和12个月时均低于阴性对照组(p<0.05);两个染毒组肺组织中ROS和MDA浓度随染毒时间延长而升高(p<0.05),SOD活力随染毒时间延长而下降(p<0.05),均呈现时间-效应关系(p<0.05);温石棉染毒组肺组织中ROS和MDA浓度在染毒的各个时间点均高于陶瓷纤维染毒组(p<0.05),SOD活力在染毒一个月时与陶瓷纤维染毒组比较无差异(p>0.05),在染毒6个月和12个月时均低于陶瓷纤维染毒组(p<0.05)。
3 讨论
温石棉是一种用途极广的纤维状硅酸盐矿物质,陶瓷纤维为温石棉的常用代用纤维,也得到了广泛应用。
本研究病理结果显示,温石棉和陶瓷纤维染毒组都有不同程度的炎性细胞聚集、肺泡结构破坏和纤维化,温石棉染毒组损伤随染毒时间延长加重。Kamp(2009)指出颗粒物可刺激ROS在肺部生成,引起肺部损伤和纤维化。Maxim等(2018)研究发现吸入陶瓷纤维引起肺组织纤维化。本实验结果与以上研究结果基本一致,由此可见,温石棉和陶瓷纤维可以引起大鼠肺部不同程度的病理损伤。
与其他类型石棉类似,温石棉纤维进入肺部后也会被巨噬细胞吞噬或破坏上皮细胞滞留在肺间质,引发炎症反应和氧化应激,巨噬细胞的进一步崩解可导致肺部纤维化和炎性反应的加重,这被认为是温石棉致肺部损伤非常重要的机制(Li and Fukagawa, 2010)。Kim等(2001)研究表明,陶瓷纤维被肺泡巨噬细胞吞噬后,导致细胞活力下降,细胞生长受阻,表现出一定程度的细胞毒性作用。本研究结果显示,两个染毒组BALF中白细胞总数与阴性对照组比较在染毒各时间点均升高;随着时间延长,两个染毒组BALF中白细胞总数、中性粒细胞和淋巴细胞的百分比升高,巨噬细胞的百分比呈现下降趋势,可能是温石棉和陶瓷纤维在进入大鼠肺部后,引发巨噬细胞对异物清除和吞噬的防御反应,破坏巨噬细胞并导致其大量崩解,进一步加重肺部炎性损伤,并随着染毒时间的延长而加重。
炎性细胞因子在维持慢性炎症、促进肿瘤细胞的进展、抑制免疫系统对肿瘤的监视等方面具有重要作用(宾流等,2014)。本研究结果显示,在染毒的各个时间点,两个染毒组肺组织中IL-6、TNF-α和NF-κB含量均高于阴性对照组,且随染毒时间延长均呈逐渐升高的趋势。NF-κB可参与石棉介导的慢性炎症反应(Liuetal., 2013),细胞暴露于不同类型的石棉后,NF-κB含量随染毒时间延长和染毒剂量的增加而升高,呈现明显的时间-效应关系和剂量-效应关系(Manningetal., 2002)。此外,NF-κB活化也是细胞暴露于石棉纤维后各种促炎细胞因子和趋化因子表达的核心,其中包括IL-6和TNF-α(Chew and Toyokuni, 2015)。Kumagai-Takei等(2018)在石棉致T细胞长期炎症研究中发现,胸膜斑块和恶性胸膜间皮瘤患者组培养上清液中的IL-6水平较高。Sun等(2012)在纳米颗粒引起小鼠肺毒性的研究中发现,纳米颗粒升高了活性氧的积累和脂质过氧化水平,并降低抗氧化能力;同时激活NF-κB,升高TNF-α和IL-6的表达水平。本实验结果与以上有关文献报道一致,提示IL-6、TNF-α和NF-κB三种炎症因子在温石棉和陶瓷纤维致大鼠肺组织损伤中起重要作用,使组织出现延续炎症反应。
炎症反应伴随着活性氧的生成(Valavanidisetal., 2013)。ROS可通过细胞氧化应激反应导致细胞凋亡和坏死;氧自由基作用于脂质发生过氧化反应生成MDA,其含量可以代表机体细胞受自由基攻击的程度。本研究显示,两个染毒组肺组织中ROS和MDA的浓度与阴性对照组比较在染毒各时间点均升高,且随染毒时间的延长均呈上升趋势。有研究报道温石棉和陶瓷纤维作用于仓鼠肺细胞(V79)可观察到细胞内ROS的水平的升高(Huoetal., 2018)。邓建军等(2009)发现温石棉使受损后的巨噬细胞脂质过氧化的主要产物MDA增高,自由基清除剂SOD被消耗。本实验结果与以上有关文献报道一致,提示温石棉和陶瓷纤维进入大鼠肺部后,机体氧化应激程度随时间延长持续加深,ROS积累并产生脂质过氧化物,使MDA水平增高,导致组织氧化损伤。SOD是生物体内重要的抗氧化酶,可清除氧自由基从而降低脂质过氧化作用。本研究发现,与阴性对照组比较,两个染毒组肺组织中SOD活力在染毒中晚期降低,且随时间延长呈下降的趋势。有研究表明A549细胞暴露于石英粉体后,细胞内SOD酶活力被激活,酶活力随染毒时间延长而降低(霍婷婷, 2013)。本实验结果与以上有关文献报道一致,提示过量的ROS使体内抗氧化酶SOD耗竭或失代偿,清除自由基的能力降低,导致机体氧化平衡体系被打破,造成组织氧化损伤。
造成温石棉和陶瓷纤维毒性差异的原因,可能与形态、粒径大小和化学组成相关。本研究中,温石棉纤维多为尖锐的纤维状,陶瓷纤维粒径变化范围更广,块状较多;温石棉染毒组肺组织中三种炎症因子的含量在染毒的各个时间点均高于陶瓷纤维染毒组。有学者推测长纤维更容易引起纤维化或癌症,但长的人造矿物纤维并不然,它们会横向断裂,从而降低了残留纤维的毒性(Eastesetal., 2007),这可能是进入肺组织的陶瓷纤维引起较弱炎症反应的原因之一。本研究中,温石棉和陶瓷纤维化学构成均以SiO2为主,温石棉含较多Fe和Mg元素,而陶瓷纤维含较多的Al元素;温石棉染毒组肺组织中ROS和MDA浓度在染毒的各个时间点均高于陶瓷纤维染毒组,SOD活力在染毒中晚期均低于陶瓷纤维染毒组。Park和Park(2009)研究发现纳米SiO2能够导致鼠源性巨噬细胞系发生氧化应激反应和促炎症反应。Huo等(2018)推测Mg元素可降低温石棉对V79细胞的死亡率,Al2O3可增强陶瓷纤维的毒性。颗粒物的铁元素可通过芬顿反应诱导羟自由基生成,并影响A549细胞内的氧化还原平衡(Dengetal., 2013)。以上相关文献提示这些元素含量不同可能导致两者毒性存在差异,含有较多活性强的Fe元素可能对诱导ROS的生成起关键作用,这可能是在不同染毒时间点,温石棉氧化损伤作用较陶瓷纤维强的原因之一。
目前关于温石棉和陶瓷纤维炎症和氧化应激损伤作用的研究主要采用体外实验,而长期染毒实验较少,本研究探讨温石棉和陶瓷纤维毒性差异的因素是否与纤维形态、粒径大小、化学组成有关,提示陶瓷纤维可能会导致与温石棉类似的健康影响。但非暴露式气管滴注法可能与现有关于石棉生物持久性及毒性的结果缺少可比性。在以后的研究中,本课题组考虑加入吸入染毒方式,并进行方法上的比较,着重探讨氧化应激产生的通路及氧化应激效应是否最终会致肺部肿瘤的发生,为继续深入开展温石棉及人造矿物纤维毒性及其作用机制的研究提供实验数据。
4 结论
(1) 温石棉和陶瓷纤维可导致大鼠病理表现为肺泡结构破坏、肺间隔增宽、纤维化等。
(2) 温石棉和陶瓷纤维使大鼠肺组织中相关炎性因子IL-6、TNF-α和NF-κB的含量升高;诱导细胞产生过量ROS、MDA,同时体内SOD活力降低,使机体处于氧化应激状态,氧化和抗氧化平衡被打破,最终造成大鼠的肺部氧化损伤。
(3) 青海茫崖矿区天然温石棉致大鼠肺部炎症和氧化损伤的能力较陶瓷纤维强,这可能与纤维形态、粒径大小和化学组成有关。

