番茄光合荧光特性及其镉吸收对土壤镉污染的响应
赖秋羽,魏树和,代惠萍**,贾根良
番茄光合荧光特性及其镉吸收对土壤镉污染的响应
赖秋羽1,魏树和2*,代惠萍1**,贾根良3
(1.陕西理工大学生物科学与工程学院,陕西 汉中 723001;2.中国科学院沈阳应用生态研究所污染生态与环境工程重点实验室,辽宁 沈阳 110016;3.西北农林科技大学理学院,陕西 杨陵 712100)
为探究番茄(Mill.)对镉污染的修复潜力,采用土壤盆栽试验方法,研究了在土壤镉施加含量为2,4,8,16,24,48mg/kg条件下,番茄生长、光合荧光特性及其镉吸收响应特点.结果表明,在土壤中施加镉含量大于8mg/kg时,番茄叶片叶绿素含量、光合性能和荧光参数,以及生物量显著低于没有施加镉的对照(0.05),表现出较强的Cd敏感性.同时,在所有镉处理中,番茄叶片对镉的富集系数(2.48~6.60)和转移系数(1.21~3.90)均大于1,表现出较强的富集能力,但经计算其土壤Cd去除率较低.因此,供试番茄品种是Cd的敏感作物,对土壤镉污染修复的潜力较小.
镉;番茄;光合特性;荧光参数
镉是生物毒性较强的重金属之一,工业“三废”的排放、不合理的农业管理措施等都可能导致农田土壤镉污染[1].全国土壤污染状况调查公报[2]表明,我国耕地土壤重金属问题中,镉的污染最为突出.镉是植物非必需元素,具有较强的移动性,易被植物吸收[3].土壤镉污染对作物产生两方面负面作用:一是作物生长没有受到抑制,但其可食部分镉含量超标,严重影响人体健康;二是作物的生长受到严重抑制甚至无法生长[4].因此,镉污染土壤的修复或安全利用刻不容缓.
利用超富集植物去除污染土壤中镉的植物提取修复是一种很有前景的方法[4].龙葵(L.)是目前已知的镉超富集植物之一.在广西环江县酸性镉污染土壤大田修复试验中,龙葵的镉提取率达6%[5].按6%的提取率计算,该土壤的修复需要10年时间,耗时太长.超富集植物具有一定的科属亲缘特征,番茄(Mill.)与龙葵同属茄科植物,其生物量远大于龙葵,溶液培育下苗期番茄对Cd很敏感[6-7],赵首萍[8]等研究表明,在15~30mg/kgCd胁迫下,影响抑制2种基因型番茄幼苗生物量的积累,及抗氧化酶(POD、SOD和CAT)活性积累.谭小琪等[9]研究指出,2.0mg/kg Cd胁迫下,29种番茄可食部位镉显著增加,超标率为100%.为研究番茄对镉的耐镉和富集镉能力,本试验以完整生育期的番茄植株为试材,通过设置不同的土壤Cd污染水平,测定番茄光合荧光特性、生物量和镉含量,探索番茄对土壤Cd的耐受性、响应机理及富集潜力.
1 材料与方法
1.1 土壤盆栽试验
供试番茄(Mill.)品种为“群兴粉娜”,由西北农林科技大学园艺学院提供.试验在陕西理工大学试验地网室进行.供试土壤为黄褐土,采自试验地的耕层土壤(0~20cm).土壤pH值为6.5,全氮含量1.71g/kg,有机质含量26.8g/kg,有效钾含量为17.3mg/kg,有效磷含量16.8mg/kg.土壤镉含量为0.18mg/kg,与国家土壤环境质量标准农用地土壤污染风险管控标准(试行)(GB15618-2018)[10]相比,是清洁土壤.将供试土壤风干后过2mm筛备用.
试验共设6个处理,分别为:对照(未投加镉处理, CK),外加Cd浓度分别为2(T1),4 (T2),8(T3),16 (T4),24(T5),48mg/kg(T6).投加镉为CdCl2×2.5H2O(分析纯试剂,山东西亚化学股份有限公司),称取对应的CdCl2×2.5H2O溶于水,与土壤充分混匀,装盆并平衡2个月后待用.每盆土壤风干,干重为2.5kg.2018年7月6日,选饱满、无病虫害番茄种子,用0.1%的HgCl2消毒10min.每盆播种10粒,在自然光照条件下培养,无遮光设施出芽15d后间苗,每盆留4株长势均匀的幼苗.根据盆栽土壤缺水情况,不定期浇自来水(水中未检出Cd),使土壤含水量经常保持在田间持水量的75%左右.每处理重复3次,没有喷农药,偶见小杂草人为拔除,于2018年11月26日收获.
1.2 测定项目及方法
光合色素含量作为番茄的重要功能性状指标可以较好地反映其对镉胁迫的生理响应.采用紫外分光光度计法进行测定.取长势一致的完全展开的第6叶,0.2g新鲜叶片研磨后加入80%(/)的丙酮定容,3000r/min离心5min后于665nm、649nm和470nm处分别测定吸光度并计算叶绿素a、叶绿素b和类胡罗卜素(Car)的含量[10].
光合气体交换采用美国CID公司生产的CI-340便携式光合仪进行测定.于早8:00~10:00测定番茄第6~8完全展开叶片的净光合速率(P)、蒸腾速率()、气孔导度()、胞间CO2浓度(C).测定时,叶室配备LED光源,设定红蓝光源叶室,测定番茄叶片气体交换参数,每次测定重复3~4次,辐射强度设定为1000μmol/(m2×s),测定条件CO2浓度为400μmol/mol,叶室温度设为27℃,相对湿度设为65%[11-12].
叶片荧光参数是叶片光系统Ⅱ(PSⅡ)对镉胁迫的快速响应,并通过PSⅡ功能参数对番茄耐镉性进行了综合评价.选择成熟功能叶采用美国OPTI- sciences公司脉冲调制式叶绿素荧光仪(OS-30p, USA)进行荧光参数测定.测量前,对第6片展开叶进行20min暗适应,记录番茄叶片暗适应下的初始荧光值(o)和最大荧光值(m),并据此计算可变荧光值(v=m–0)和光系统Ⅱ(PSⅡ)的最大光化学效率(v/m)[12-13].
叶面积采用便捷式叶面积仪(型号CI420,CID公司)测定.
生物量测定.将收获的植物分别按根、茎、叶、果实收集.105℃杀青后,70℃烘干至恒重,称量[9].
镉含量采用原子吸收分光光度计(Hitachi180- 80)法进行测定[14].转移系数为地上部(茎、叶)镉含量与根的镉含量的比值.富集系数为地上部(茎、叶)镉含量与土壤中实测镉含量的比值.去除率(%)为每盆番茄镉积累量与土壤中镉总量的百分比.其它的土壤理化性质指标采用常规方法测定[11].
1.3 数据处理与统计分析
所有数据用EXCEL计算3次重复的平均值和标准差,用统计软件SPSS12通过LSD法进行差异显著性分析(差异显著性水平为<0.05)和相关性分析.
2 结果与分析
2.1 番茄叶绿素含量
表1可见,与CK相比,处理T1、T2和T3番茄叶片中叶绿素a、b含量没有显著差异,而T4、T5、T6的叶绿素a、b含量显著降低(<0.05);处理T1、T2、T3、T4叶片中类胡萝卜素含量没有显著差异,处理T5、T6的类胡萝卜素含量显著降低(<0.05).经相关性分析表明,叶绿素a、叶绿素b、类胡萝卜素与土壤Cd含量之间没有显著的正相关关系(<0.05).土壤Cd施加含量大于8mg/kg时,番茄叶绿素含量显著降低.而类胡萝卜素在土壤Cd施加含量大于16mg/kg时显著降低.表明番茄叶绿素和类胡萝卜素对土壤Cd含量不是很敏感.

表1 番茄叶绿素a、叶绿素b和类胡萝卜素含量
注:同一列数字后不同字母表示差异显著(<0.05),下同.
2.2 番茄的光合性能
净光合速率、蒸腾速率、气孔导度和胞间CO2浓度是反应叶片光合性能的重要指标.当土壤中施加的镉含量没有超过8mg/kg (T1, T2, T3)时,上述指标与对照(CK)相比均没有显著下降(<0.05).但当土壤中施加的镉含量大于8mg/kg(T4, T5, T6)时,番茄叶片净光合速率、蒸腾速率和气孔导度分别比对照降低了41.4%~83.7%、27.2%~72.7%和32.0%~72.5%,而胞间CO2浓度则显著增加32.0%~72.5%(<0.05).
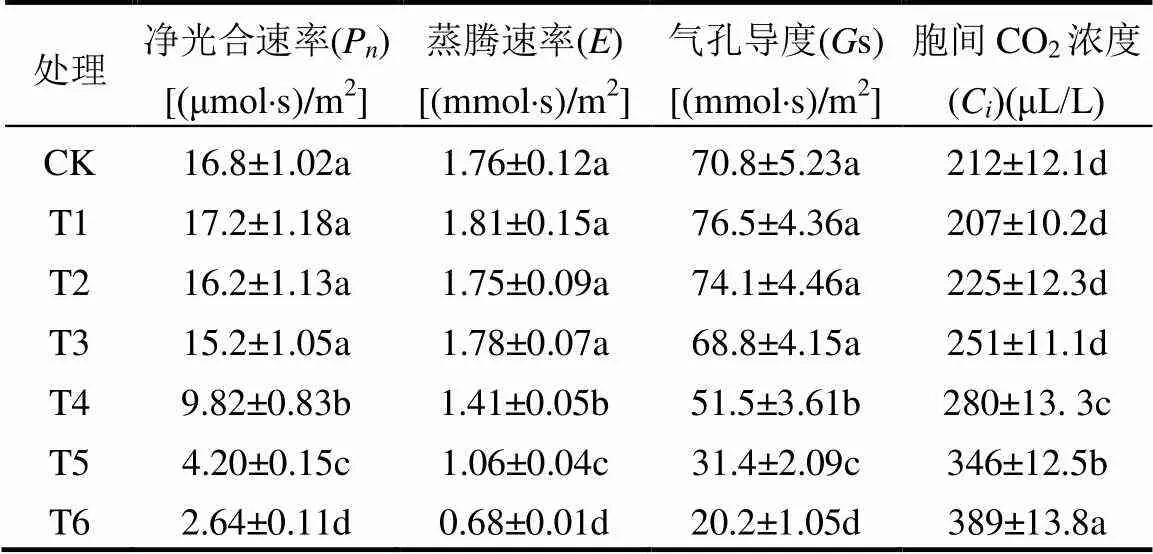
表2 镉对番茄净光合速率、蒸腾速率、气孔导度和胞间CO2浓度的影响
2.3 番茄叶片荧光参数
不同浓度镉胁迫对番茄叶片PSII最大光化学效率(v/m)、初始荧光值(o)、最大荧光值(m)和可变荧光(v)也产生明显的影响.由表3可以看出,这些指标与叶绿素含量(表1)和叶片光合性能指标(表2)具有大体一致的变化.表明高浓度镉胁迫降低了番茄叶片PSⅡ光化学活性及能量转化效率,这可能是镉抑制了PSⅡ反应中心QA到QB的电子传递,使非还原性QB积累较多,从而降低PSⅡ反应中心放氧活性.但番茄叶片荧光参数在土壤镉施加量小于8mg/kg (T1,T2,T3)时,变化并不显著(<0.05).
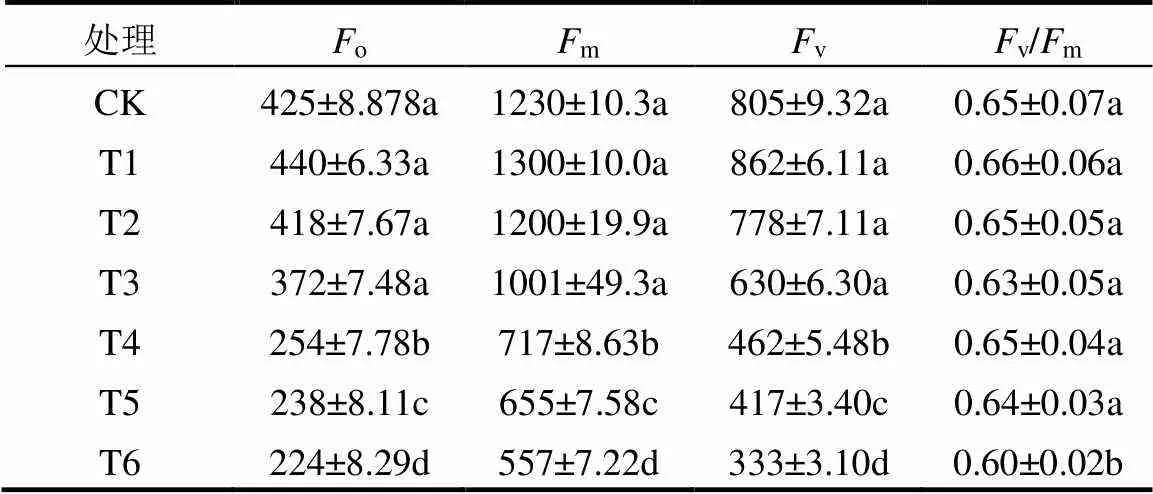
表3 番茄叶片Fo、Fm、Fv和Fv/Fm
2.4 番茄生物量
植物的叶面积和根,茎,叶,果实的生物量是植物叶绿素含量与光合性能的最终反应.由表4可知,与CK相比, 处理T1, T2和T3的上述指标均没有显著下降(<0.05),而T4, T5和T6的相应指标均不同程度的显著下降(<0.05).这一结果与土壤中不同含量镉对植物叶绿素含量与光合性能的影响的结果基本一致(表1, 2, 3).
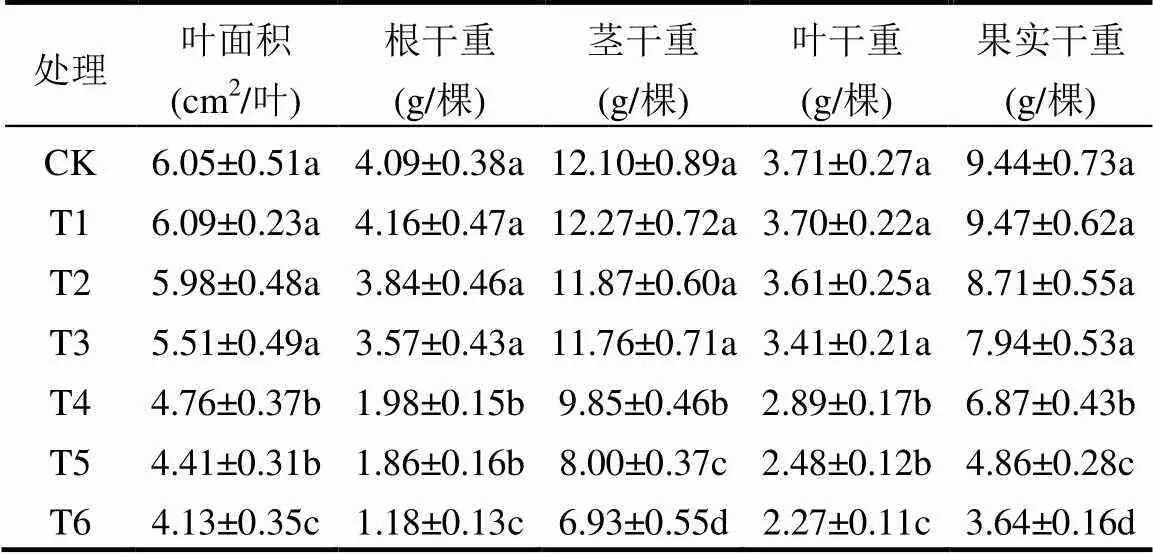
表4 番茄叶面积及生物量
2.5 番茄富集镉的特点
如表5所示,番茄根或茎、叶片和果实镉含量均随土壤镉含量的增加而显著提高,均呈现显著的正相关关系(根系茎,叶片,果实相关系数2分别为0.5755,0.8231,0.8367,0.8198,<0.05);番茄叶片(计算地上部的转移系数、富集系数较好,因为叶片生物量占地上部的比值较低,代表性不强)吸收镉的转移系数均大于1,叶片富集系数也均大于1,为2.48~6.60,在T1~T4胁迫下,茎吸收镉的转移系数均大于1,而在T1~T5胁迫下,茎富集系数也分别大于1,为1.432~2.512;不同浓度镉胁迫下,地上部Cd的提取量、地上部分Cd去除量及Cd去除率均显著高于对照,均呈现显著的正相关关系(地上部Cd的提取量相关系数,地上部分Cd去除量相关系数,Cd去除率相关系数,<0.05).表明番茄对土壤中镉具有较大的富集潜力.
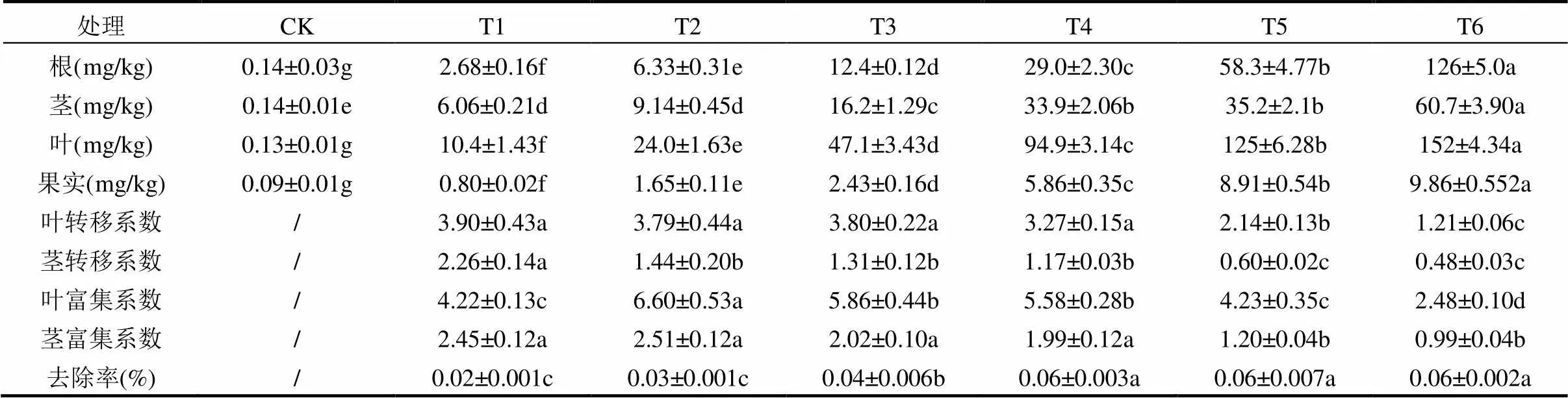
表5 番茄不同部位镉含量、转移系数、富集系数和去除率
3 讨论
3.1 番茄光合系统对镉胁迫敏感反应
番茄在土壤Cd超过8mg/kg时其叶片的叶绿素a、叶绿素b、净光合速率蒸腾速率、气孔导度、胞间CO2浓度、各种荧光值都发生显著变化,与An[14]报道的4种作物中仅高粱对40mg/kg的土壤Cd才产生敏感相比,番茄是土壤镉的敏感作物,其耐受性较低.其在16~48mg/kg镉胁迫下,番茄的生长受到了显著抑制,原因可能是镉影响番茄的正常生理代谢,造成番茄叶片光合色素含量降低,光合速率下降,产生光抑制现象,使番茄生物量下降.
光合作用是植物体内重要的代谢过程.重金属胁迫能抑制植物的光合作用,主要表现在破坏叶绿素结构、降低光合色素积累等方面,最终导致植物的生长受阻,生物量降低[14].重金属胁迫引起叶片变黄或出现黄褐色斑点已被诸多研究所证实[15].本研究中,在T4~T6高浓度镉胁迫对番茄叶绿素a、叶绿素b、类胡萝卜素含量显著降低,叶片变黄,这说明镉离子进入植物体内细胞,镉离子可能与叶绿体蛋白的巯基结合,从而取代Fe2+、Zn2+、Mg2+,破坏叶绿体的合成[19-20].类胡萝卜素不仅参与光合作用,还具有清除活性氧的能力.高浓度镉胁迫下,番茄叶片可能通过类胡萝卜素对叶绿素的保护作用和对植物体内活性氧的清除作用,可以维持番茄在镉胁迫环境下正常生长[19-20].
重金属对植物光合作用的毒害还反映在气孔因素和非气孔因素方面,评价依据是胞间CO2浓度值的大小.在叶片净光合速率的降低时,主要原因是气孔因素,而伴随着胞间CO2浓度增加,则说明净光合速率的限制因素是非气孔因素,其可能是RuBP羧化、光化学活性和无机磷等限制引起的[12-14].
叶绿荧光与光合作用中的各种反应过程密切相关,在受到胁迫时,对光合作用的影响通过叶片叶绿素荧光动力学反应出来[21-27].在T4~T6处理中,番茄净光合速率下降是因为非气孔因素.m、v的变化与v/m的变化趋势一致,镉胁迫明显降低番茄叶片的v/m,表明高浓度镉胁迫下番茄叶片光系统Ⅱ原初光化学活性受到抑制,光系统Ⅱ活性中心遭到破坏,同时,镉胁迫导致番茄v/m比值的降低主要是由于m的减少可变荧光v(v=m-o)的降低所引起.v显著下降,可能是由于热耗散增加所致.与叶绿素含量降低幅度相比,处理T4~T6对番茄净光合速率的抑制更严重,表明叶绿素含量的降低不是导致番茄净光合速率下降的唯一因素.本研究进一步证明Krause等[28]的观点.同时叶片净光合速率的下降也伴随着蒸腾速率和气孔导度的下降,且伴随着胞间CO2浓度的升高,表明镉胁迫对番茄叶片光合作用的限制可能是由非气孔因素引起的;由此推测光合限制部位主要发生在叶肉细胞内,不是由于气孔导度的上升影响CO2供应,也可能与叶绿体ATP合酶和硝酸还原酶活性的降低有关影响光合作用[13-14,29],且净光合速率降低是随着镉浓度增加而加剧,说明镉对番茄叶片光合作用的影响具有浓度效应.本研究结果与Wang等[30]和Li等[31]在莴苣()和玉米()的研究结果相一致.
3.2 番茄对土壤中镉的富集潜力
已有学者利用镉超富集植物龙葵开展了污染土壤的修复潜力研究.在酸性污染土壤上,当土壤中镉含量为0.71mg/kg时,龙葵中镉含量最高可达16.83mg/kg,对镉的富集系数和转移系数均大于1.若按当地正常种植模式计算,龙葵对土壤中镉的去除率可达6%以上[5].然而,本研究中,当土壤中镉施加量为16mg/kg(T4)时,番茄对土壤中镉的去除率仅0.06%.虽然番茄对镉的富集系数和转移系数均大于1,与龙葵对镉的富集特点相似,表现出较强的富集能力,但其土壤Cd去除率较低.因此,供试番茄品种是Cd的敏感作物,对土壤镉污染修复的潜力较小.研究发现,不同烤烟品种[15-16]与黄瓜[17-18]对镉的敏感性不同.本研究与前人在烤烟[15-16]中研究报道相一致,可能与同是茄科植物有关.
4 结论
4.1 番茄是Cd的敏感作物,其敏感含量约为8mg/kg,对Cd的耐受性较差.
4.2 镉主要富集在番茄的地上部分,且富集系数和转移系数在不同镉污染条件下均大于1,表现出较强的镉富集潜力.但是其对镉的去除率与龙葵相比仍然很低.说明这个番茄品种对镉的敏感性较高但修复能力有限.
[1] 李 元,祖艳群.重金属污染生态与生态修复[M]. 北京:科学出版社, 2016. Li Y, Zu Y Q. Heavy metal pollution ecology and ecological remediation [M]. Beijing: Science Press, 2016.
[2] 环境保护部,国土资源部.全国土壤污染状况调查公报[R]. 北京:环境保护部,国土资源部, 2014. Ministry of environmental protection, Ministry of land and resources. National investigation bulletin on soil pollution [R]. Beijing: Ministry of environmental protection, Ministry of land and resources, 2014.
[3] Li J T, Liang Z W, Jia P, et al. Effects of a bacterial consortium from acid mine drainage on cadmium phytoextraction and indigenous soil microbial community [J]. Plant and Soil, 2017,415:347-358.
[4] Li T Q, Han X, Liang C F, et al. Sorption of sulphamethoxazole by the biochars derived from rice straw and alligator flag [J]. Environmental Technology, 2015,36(2):245-253.
[5] 赵雪梅,谢 华,吴开庆,等.酸与Cd污染农田的植物修复及健康风险评价 [J]. 农业环境科学学报, 2016,34(4):702-708. Zhao X M, Xie H, Wu K Q, et al. Phytoremediation and health risk assessment of acidified and cadmium contaminated farmland [J].Journal of Agro-Environment Science, 2016,34(4):702-708.
[6] 万延慧,齐乃敏,朱为民,等.重金属(Cd2+、Zn2+)胁迫对番茄幼苗抗氧化酶系统的影响 [J].上海农业学报, 2004,20(4):79-82. Wai Y H, Qi N M, Zhu W M, et al. ffects of Cd2+and Zn2+on antioxidant enzymes system of soluble protein of tomato seedlings [J]. Acta Agriculturae Shanghai, 2004,20(4):79-82.
[7] 崔秀敏,吴小宾,李晓云,等.铜、镉毒害对番茄生长和膜功能蛋白酶活性的影响及外源NO的缓解效应 [J]. 植物营养与肥料学报, 2011,17(2):349-357. Cui X M, Wu X B, Li X Y, et al. Responses of growth, functional enzyme activity in bio membrane of tomato seedling stoexcessive copper, cadmium and the alleviating effect of exogenous nitric oxide [J]. Plant Nutritionand Fertilizer Science, 2011,17(2):349-357.
[8] 赵首萍,张永志,于国光,等.Cd胁迫对2种基因型番茄幼苗活性氧清除系统的影响 [J].中国农学通报, 2011,27(19):166-171. Zhao S P, Zhang Y Z, Yu G G, et al. The effect of cadmium stress on two genotype tomato seedlings, 2011,27(19):166-171.
[9] 谭小琪,李取生,何宝燕,等.番茄对镉吸收累积的品种差异 [J]. 暨南大学学报(自然科学与医学版), 2014,35(3):215-220. Tan X Q, Li Q S, He B Y, et al. Differences in cadmium absorption and accumulation of tomato () varieties on Cd-polluted soil [J]. Journal of Jinan University(Natural Science & Medicine Edition), 2014,35(3):215-220.
[10] GB15618-2018 国家土壤环境质量标准农用地土壤污染风险管控标准(试行) [S]. 2018. GB15618-2018 National standard for soil environmental quality and risk control of soil pollution in agricultural land (Trial implementation) [S]. 2018.
[11] Dai, H P, Wei S H, Skuza L. et al. Selenium spiked in soil promoted zinc accumulation of Chinese cabbage and improved its antioxidant system and lipid peroxidation [J]. Ecotoxicology and Environmental Safety, 2019,180:179-184.
[12] 祁金洋,牛 喆,张 静,等.重金属铅对绢毛委陵菜光合特性及荧光参数的影响[J]. 草地学报, 2018,26(2):447-452.Qi JY, Niu Z, Zhang J,et al.Effects of heavy metal lead on photosynthetic characteristics and fluorescence parameters ofL. Acta Agrestia Sinica,2018,26(2):447-452.
[13] 简敏菲,张乖乖,史雅甜,等.土壤镉、铅及其复合污染胁迫对丁香蓼()生长和光合荧光特性的影响 [J]. 应用与环境生物学报, 2017,23(5):837-844.Jian M F, Zhang G G, Shi Y T et al.Effects of single and combined pollution stress of cadmium and lead in soil on the growth and photosynthetic fluorescence characteristics of[J].Chin J Appl Environ Biol, 2017,23(5):837-844.
[14] An Y J. Soil ecotoxicity assessment using cadmium sensitive plants [J]. Environmental Pollution, 2004,127(1):21-26.
[15] 王浩浩,刘海伟,石 屹,等.烤烟品种对镉吸收累积敏感性差异研究[J]. 中国烟草科学, 2013,34(6):64-68,76.Wang H H, Liu H W, Shi Y, et al. Sensibility variation of cadmium uptake and accumulation among flue-cured tobacco varieties [J]. Chinese Tobacco Science, 2013,34(6):64-68,76.
[16] 刘传娟,刘凤枝,蔡彦明,等.不同种类蔬菜苗期对镉的敏感性研究[J]. 农业环境科学学报, 2009,28(9):1789-1794. Liu F Z, Cai Y M, Wang L, et al. Sensitivity of different vegetable seedlings to cadmium [J]. Journal of Agro-Environment Science, 2009,28(9):1789-1794.
[17] 丁枫华,刘术新,罗 丹,等.23种常见作物对镉毒害的敏感性差异[J]. 环境科学, 2011,32(1):277-283.Ding F H, Liu S X, Luo D, et al. Different sensitivity of 23 common crop species to cadmium toxicity [J]. Environmental Science, 2011, 32(1):277-283.
[18] 唐明灯,艾绍英,李盟军,等.紫云英对污染土壤上叶菜生长及其镉和铅含量的影响[J]. 中国环境科学, 2011,31(3):461-465. Effect ofon the growth, Cd and Pb concentration of leafy vegetables [J].China Environmental Science, 2011,31(3):461- 465.
[19] 魏树和,周启星,王 新,等.一种新发现的镉超积累植物龙葵(L) [J]. 科学通报, 2004,49(24):2568-2573.Wei S H, Zhuo Q X, Wang Xin, et al. A newly discovered cadmium superaccumulator plant[J]. Chinese Science Bulletin, 2004,49(24):2568-2573.
[20] 贺国强,刘 茜,郭振楠,等.镉胁迫对烤烟叶片光合和叶绿素荧光特性的影响[J]. 华北农学报, 2016,31:388-393. He G Q, Liu Q, Guo Z N, et al. Effects of cadmium stress on photosynthetic and characteristics, chlorophyll fluorescence in leaves of flue-cured tobacco [J]. Acta Agriculturae Boreali-sinica, 2016,31: 388-393.
[21] 崔 振,李昌晓,贺燕燕,等.中华金叶榆和银水牛果苗木的生长和光合作用对土壤锌污染的响应[J]. 林业科学, 2017,53(3):114-122. Cui Z, Li C X, He Y Y, et al. Responses of growth, photosynthesis of‘Jinye’andto soil Zinc contamination [J]. Scientia Silvae Sinicae, 2017,53(3):114-122.
[22] 杨 斌,张文辉.竹柳对Pb2+胁迫的响应及其Pb富集能力[J]. 西北林学院学报, 2016,31(1):36-41.Yang B, Zhang W H. Responses ofKoidz cv.zhuliu to Pb2+stress and its accumulation ability [J]. Journal of Northwest Forestry University, 2016,31(1):36-41.
[23] 曲丹阳,张立国,顾万荣,等.壳聚糖对镉胁迫下玉米幼苗根系生长及叶片光合的影响[J]. 生态学杂志, 2017,36(5):1300-1309. Qu D Y, Zhang L G, Gu W R, et al. Effects of chitosan on root growth and leaf photosynthesis of maize seedlings under cadmi-um stress [J]. 2017,36(5):1300-1309.
[24] 王 峰,单睿阳,陈玉真,等.闽中某矿区县茶园土壤和茶叶重金属含量及健康风险 [J]. 中国环境科学, 2018,38(3):1064-1072. Wang F, Shang R Y, Chen Y Z, et al.Concentrations and health risk assessment of heavy metals in tea garden soil and tea-leaf from a mine county in central Fujian province [J].China Environmental Science, 2018,38(3):1064-1072.
[25] 宋雪梅,夏 超,廖 洋,等.外源稀土Ce3+对凤眼莲钙相关光合作用的影响 [J]. 中国环境科学, 2014,34(9):2362-2367. Song X M, Xia C, Liao Y, et al.nfluences of rare earths (Ce3+) on calcium-regulated photosynthesis in[J]. China Environmental Science, 2014,34(9):2362-2367.
[26] 高夕彤,李 硕,贾 娟,等.不同番茄品种对镉胁迫的耐抗性差异研究[J]. 华北农学报, 2018,33(2):169-176.GAO XT, Li S, Jia J, et al.Study on resistance of different tomato varieties to cadmium stress [J]. Acta Agriculturae Boreali-sinica, 2018,33(2):169-176.
[27] 张传玲,江红生,李长江,等.纳米银与镉的复合毒性对拟南芥根系形态及叶片生理指标的影响[J]. 中国环境科学, 2018,38(5):1951- 1960.Zhang C L, Jiang H S, Li C J, et al. Effects of Ag NPs and cadmium on root morphology and leaves physiological indexes of Arabidopsis thaliana [J].China Environmental Science, 2018,38(5):1951-1960.
[28] Krause G H, Winter K. Photoinhibition of photosynthesis in plants growing in natural tropical forest gaps: a chlorophyll fluorescence study [J]. Plant Biology, 2015,109(6):456-462.
[29] 王世玉,吴文勇,刘 菲,等.典型污灌区土壤与作物中重金属健康风险评估[J]. 中国环境科学, 2018,38(4):1550-1560.Wang S Y, Wu W Y, Liu F, et al. Assessment of human health risks of heavy metals in the typical sewage irrigation areas [J]. China Environmental Science, 2018,38(4):1550-1560.
[30] Wang Y M, Yang R X, Zheng J Y, et tal. Exogenous foliar application of fulvic acid alleviate cadmium toxicity in lettuce (L.) [J]. Ecotoxicology and Environmental Safety, 2019,167:10-19.
[31] Li M, Zhang L J, Tao L, et al. Ecophysiological responses ofto cadmium exposure [J]. Aquatic Botany, 2008, 88(4):347-352.
Response of photosynthetic characteristics and fluorescence parameters of tomato to Cd in soil.
LAI Qiu-yu1, WEI Shu-he2*, DAI Hui-ping1**, JIA Gen-liang3
(1.College of Biological Science & Engineering, Shaanxi University of Technology, Hanzhong 723001, China;2.Key Laboratory of Pollution Ecology and Environment Engineering, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;3.College of Science, Northwest A & F University, Yangling 712100, China)., 2019,39(11):4737~4742
In order to explore the potential of tomato (Mill.) for remediation of Cd contaminated soil, the response characteristics of tomato growth, photosynthetic fluorescence and Cd uptake were studied under the conditions of 2, 4, 8, 16, 24 and 48mg/kg Cd added in soil by pot experiment. The results showed that the chlorophyll content, photosynthetic performance, fluorescence parameters and biomass of tomato were significantly lower (0.05) than the control when Cd concentration was more than 8mg/kg added in soil, indicating a strong Cd sensitivity. At the same time, in all Cd treatments, the enrichment factor (2.48~6.60) and translocation factor (1.21~3.90) of tomato leaves were greater than 1, showing strong enrichment ability, but the soil Cd removal rate was low. Therefore, the tested tomato variety was sensitive to Cd and had little potential for remediation of Cd contaminated soil.
Cd;tomato;photosynthetic characteristic;fluorescence parameter
X171
A
1000-6923(2019)11-4737-06
赖秋羽(1985-),女,广西桂平人,陕西理工大学硕士研究生,研究方向为植物逆境生理学.
2019-05-24
陕西省自然科学基金(2019JM-413);国家自然科学基金资助项目(41571300,31870488);国家高端外国专家项目(GDT20186100430B, G20190241001);陕西省教育厅重点实验室科研计划项目(17JS023);陕西省科技厅后补助项目(2018SZS-27-07)
* 责任作者, 研究员, shuhewei@iae.ac.cn; ** 教授,daihp72@aliyun.com

