GhACT1启动子驱动Lc基因在棉花幼胚纤维中特异表达
范小平,范博红,马冬菊,卫武宵
(山西省农业科学院棉花研究所,山西运城044000)
彩色棉因拥有天然彩色纤维的环保优势一直以来受到广大消费者的喜爱,因而多年来彩色棉选育是棉花研究领域的热点之一。目前运用生物学技术进行棉花遗传分析[1]以及彩棉纤维发育规律[2]等研究的报道层出不穷,而利用转基因把色素基因导入棉花也是棉花纤维颜色改良研究的重要手段之一。最早的色素基因研究是对玉米色素合成通路基因的遗传分析[3],在此基础上,经过20 多年的探索与研究,陆续从玉米中发现了花青素合成所必需的2 组基因:一组是编码参与花青素合成及生化反应酶的结构基因,另一组编码调控色素沉积时空分布的蛋白。这些基因的编码产物分别属于MYB 类的C1 家族和MYC 类的R 家族[4]。Lc基因则属于花青素合成必需的MYC 类的R 家族基因,编码1 个基本的螺旋-环-螺旋转录活性因子,在花青素生物合成通路中起作用,具有调控植物体中花青素的时空分布功能[5]。近年来,Lc基因被成功导入多种植物中,并且成功整合与表达,例如矮牵牛[6-7]、烟草[8]、番茄[9-10]、苹果[11]等。在棉花中,2016 年 Fan 等[12]将35S 驱动的Lc基因转入棉花,转基因棉花的茎、叶等营养器官、花及纤维中均呈现红色;然而由于营养体、 生殖体中花青素的过量合成与积累,严重影响了转基因棉花再生苗的生长与发育,最终仅获得2 个可育株系。GhACT1 是2005 年Li等[13]通过筛选cDNA 文库得到的15 个肌动蛋白cDNA 序列中,在棉花纤维中特异表达最强的1个序列。因此,本研究以纤维特异表达的GhACT1 启动子替换35S,构建植物表达载体GhACT1-Lc-pBI121 转化棉花,减少不利于转基因棉苗正常生长发育的因素,为纤维中花青素合成机理研究及彩色纤维育种研究提供品系资源。
1 材料与方法
1.1 载体构建
将PBI121 中的GUS 酶切替换为Lc基因;将35S 启动子经酶切替换为GhACT1 启动子,构建 GhACT1-Lc-pBI121 载体(GhACT1-Lc)。
1.2 植物材料
珂字棉312(C312)无菌苗的下胚轴作为外植体,无菌苗的处理与操作方法同参考文献[10]所叙。
1.3 农杆菌的转化
将构建好的载体通过热激法转化农杆菌AGL1。随机选择3 个独立的单菌落作为模板,以非转化的菌落为阴性对照,以质粒作为阳性对照,进行nptⅡ、Lc和GhACT1 的聚合酶链式反应(Polymerase chain reaction,PCR)检测,验证载体构建及转化成功与否。经PCR 扩增检测单菌落为阳性的克隆,接入含有利福平和羧苄青霉素的 LB 液体培养基中,在 28 ℃、250 r·min-1的摇床上过夜,OD600为0.8 左右,即可保留菌种或用于转化棉花。
1.4 转化植物
将培养的菌液离心,倒掉上清液,重悬于Murashige&Skoog(MS)培养基中[14],加入乙酰丁香酮 (Acetosyringone,AS)。浸染无菌苗下胚轴10 min。然后将其放入无筛选剂的MS 培养基,共培养2 d 后,在筛选培养基中培养2~3 个月,每月继代1 次。挑取筛选到的阳性愈伤进行组织培养,通过诱导胚胎发生,获得再生棉苗方法同参考文献[12]所述。所获得的转基因再生棉幼苗在三角瓶中长至5~7 叶,根系健壮时,经过温室炼苗,移栽至营养土中,缓苗后移到网室,即在正常的日光条件下生长。
1.5 转基因再生苗的DNA提取及PCR检测
在试管苗移栽前,采集棉花再生苗的1 片嫩叶粗提DNA,以Lc片段设计引物进行PCR 检测。
Lc引物:Lc-L:5'-GGGGGATCCATGGCGCTTTCAGCTTCCCCGAG-3',Lc-R:5'-GGGGATATCACCGCTTCCCTATAGCTTTGC-3'。片段长度为 1.4 kbp。扩增程序为 94 ℃ 4 min,94 ℃ 45 s,58 ℃ 45 s,72 ℃ 2 min,35 个循环,72 ℃ 10 mim,然后4 ℃保存。
GhACT1 引物:GhACT1-L:5'-GGTCGACGGCCCGGGCTGGT-3',GhACT1-R:5'-CTTTTACAATACTGAAAATAAGAT-3'。片段长度为 0.8 kbp。PCR 扩增程序为 94 ℃ 5 min,94 ℃ 45 s,58℃ 45 s,72 ℃ 45 s,35 个循环,72 ℃ 10 min,最后4 ℃保存。
1.6 转基因再生苗的Southern blot杂交
移栽后的棉株长到5 片展开叶时,摘取顶端2 片叶,采用 CTAB 法提取棉花总 DNA[15],进行分子生物学检测Southern blot 杂交。吸取10 μg DNA,经 20 个酶活力单位(U,active unit)的限制性内切酶BamHⅠ37 ℃过夜酶切后,于10 g·L-1的琼脂糖凝胶中电泳过夜,分离酶切后的DNA片段,在碱性条件下通过毛细管吸附作用将片段DNA 转移到尼龙膜上用于杂交。根据产品说明制作地高辛标记的Lc探针,然后在42 ℃杂交箱中杂交过夜。杂交后的杂交膜在柠檬酸钠(Saline sodium citrate,SSC) 与十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)的混合缓冲液中冲洗,最后按照地高辛发光检测试剂盒(ROCHE 公司)的说明,加入标记抗地高辛抗体(Anti-digoxigenin AP-conjungate,AP)使抗体与地高辛结合,清洗后加入显色液显色。
1.7 RNA的抽提与表达量检测
采用改良的热酚法抽提不同发育阶段纤维的RNA,方法同Li 等[13]所述。首先在热酚中加入等体积的酚- 氯仿,置于65 ℃的水浴锅里温浴15 min;再取棉花幼胚置于液氮中研磨至粉末,并及时将其转入提取缓冲液中,剧烈震荡混匀;然后在 4 ℃离心机上 12 000 r·min-1离心 20 min,吸取上清,再加入等体积酚- 氯仿重复处理数次,最终用 4 mol·L-1氯化锂沉淀,溶于无菌的焦碳酸二乙酯 (Diethy-pyrocarbonate,DEPC)水中备用。表达量检测采用逆转录 (Reverse transcription,RT)PCR 检测法,同 2016 年 Fan 等[12]的报道。
1.8 未成熟胚的离体培养
取开花后2 d 的幼铃,在体积分数为70%的酒精溶液中浸泡1 min 后,在超净工作台上切开,挑出已经长出短绒凸起的幼胚放入改良的液体培养基[16]。其中每一幼铃中的幼胚对半分为2 个部分,一部分进行正常的光照培养(光周期为16 h/8 h,光照强度为3 000 lx);另一部分完全暗培养;剥取10 个转基因棉花株系的幼胚重复3 次,同时取未转化的C312 棉铃未成熟胚作为对照,同样分2 个部分分别培养。具体方法同2016 年Fan 等[12]的报道。
2 结果与分析
2.1 载体转化农杆菌单菌落的PCR验证结果
从图1 的PCR 检测结果发现,筛选获得的质粒与单菌落都携带有标记基因nptⅡ、 目的基因Lc和GhACT1 启动子,而非转化菌落N 未出现条带(图1),说明植物表达载体构建正确并成功转化农杆菌,这些单菌落将继续用于外植体转化及此后的试验工作。
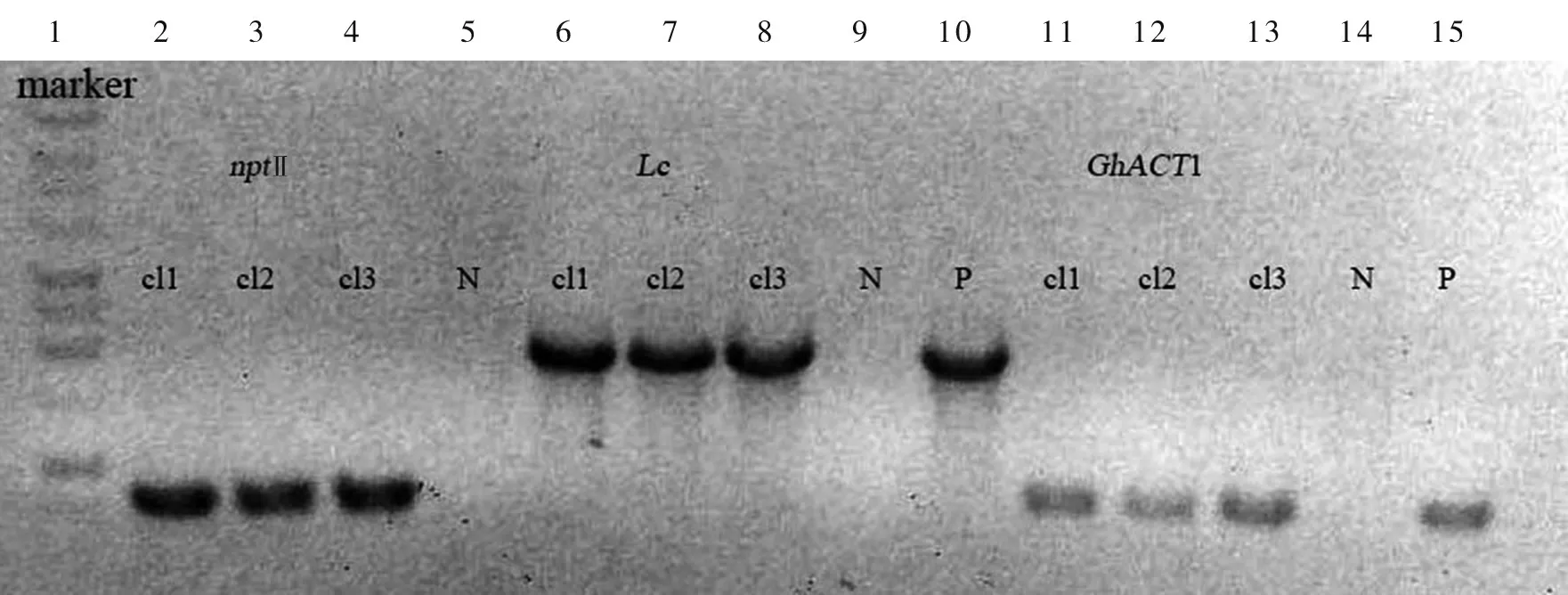
图1 质粒及单菌落PCR 验证结果Fig.1 PCR test result of single colony and plasmid
2.2 转基因再生株系的PCR检测结果
经过体细胞胚胎发生获得转基因棉花再生苗 (图2)。移栽前,对瓶中36 株再生株系进行PCR 检测,结果有25 个株系为PCR 阳性,其中部分转Lc基因的棉花株系PCR 检测结果见图3。
2.3 Southern blot杂交检测结果
Southern blot 杂交检测结果确认25 个转基因棉花株系均为阳性。图4 显示了其中10 个株系的Southern blot 杂交结果,10 个泳道均出现明显杂交条带。其中:株系 La89、La83 和 La105 为多拷贝插入; 其余7 个株系均显示为1 条杂交带,这7 个株系是否为单拷贝遗传,还要对其T1植株基因分离情况进行统计分析才能确定。通过观察发现,这些再生苗在成长过程中没有明显颜色变化,植株的生长发育及后代育性也基本正常。
2.4 转基因株系中Lc基因的表达检测(RTPCR)结果
在GhACT1-Lc 转基因再生株系的生长过程中,茎叶以及花果均没有明显的颜色变化。RT-PCR 检测结果发现,在转基因棉花株系的营养组织如叶、 叶柄和茎中均没有看到Lc基因的表达信号,如图5。

图2 转基因棉花再生苗Fig.2 Transgenic regenerants of cotton
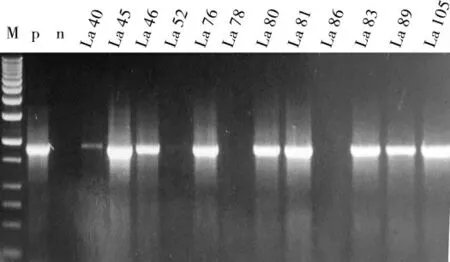
图3 部分转基因棉花再生株系的PCR 检测结果Fig.3 PCR test results of part of transgenic lines
RT-PCR 检测结果发现,转基因棉花幼胚及新生纤维,即棉花纤维发育初期如起始期及伸长期早期有较明显转录水平的表达(图6),并且表达水平基本一致,而在幼胚发育12 d 时表达信号明显减弱,而在后来的伸长期及增厚期没有出现表达信号(图片未显示)。

图4 10 个转基因棉花株系的Southern 杂交结果Fig.4 The test result of southern blot of 10 transgenic lines
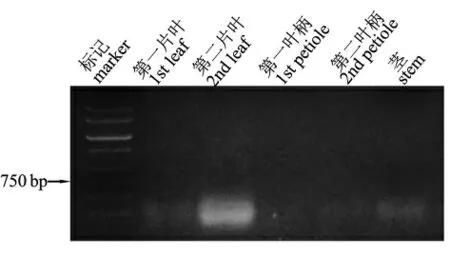
图5 转基因株系营养体中Lc 基因表达的检测结果(RT-PCR)Fig.5 Test of Lc expression in vegetative tissues of transgenic cotton plants by RT-PCR

图6 转基因株系不同生长期(开花后1、2、3、5、7、9、12 d)幼胚和纤维中Lc 基因的表达情况Fig.6 The Lc gene expression levels in ovules and fibers at the indicated stages (at 1, 2, 3, 5, 7, 9, 12 days post anthesis)
2.5 幼胚离体培养试验结果
根据Fan 等[12]的报道,在35S-Lc 转基因株系中,需要光照条件下才可以看到纤维颜色的变化,因此进行了棉花幼胚的离体培养试验。结果表明,同35S-Lc 转基因棉花一样[12],在光照条件下培养1 周后10 个GhACT1-Lc 转基因株系的幼胚表皮毛均呈现红色,3 次重复表型一致;而另外一组在完全黑暗培养条件下,GhACT1-Lc 转基因株系幼胚的表皮与纤维都保持全白色 (图7)。在同样培养条件下,2 组非转基因棉花幼胚均未出现红色纤维。在10 倍显微镜下观察红色纤维发现,与35S-Lc 转基因再生株一样花青素红色油状物积累在幼嫩纤维细胞的中央大液泡中[12]。GhACT1-Lc 转基因株系后代 T1、T2的幼胚离体光照培养试验结果显示,幼胚纤维同样出现红色,说明整合在这些转基因株系中的Lc基因是可遗传并持续表达的。

图7 转基因株系幼胚在离体培养条件下光照和暗培养的对照试验结果Fig.7 Comparison of test results of transgenic immature ovules cultured under light or in dark for 1 week
3 讨论
本研究转基因过程中,通过卡那霉素筛选获得36 个转基因棉花再生株系,以Lc为引物经PCR、Southern blot 检测有 25 个阳性转基因株系,其他11 个株系通过了卡那霉素的筛选却不含有Lc基因。因而推测,在外源目的基因整合棉花时,产生报告基因nptⅡ整合入棉花体内,而目的基因Lc缺失的现象。这一现象在以往的转基因试验中也时有发生,这可能是转基因过程中常常产生假阳性的原因。而这一现象的分子生物学原理及理论解释,还有待深入研究。
据文献[12]报道,35S-Lc 转基因棉花再生株系中最终仅获得2 个可遗传后代,原因是过量的花青素在棉花植株的营养体与生殖体细胞中合成与积累,具有毒害细胞作用,导致细胞停滞生长发育,严重时甚至导致细胞死亡[17-18]。在35S-Lc转基因过程中,组织培养时棉花愈伤组织呈现红色甚至紫色,会影响愈伤细胞的繁殖与分化;体细胞胚呈现红色或紫色,会影响胚的正常萌发,导致仅有少数胚可以长成试管苗。此外,试管再生苗的幼叶、茎秆及幼根呈现红色,使得再生苗移栽成活率较低;再生苗的花药、柱头变红色,花粉量少,明显影响了转基因棉花再生苗的获得。而GhACT1-Lc 的转基因棉花试验结果表明,转基因棉花再生株系在整个转基因过程中均没有出现明显的颜色变化,最终获得较多转基因棉花再生株系。另外,GhACT1-Lc 的转基因棉花再生苗的生长发育与外源基因导入的拷贝数也没有明显关系。无论是单拷贝或多拷贝插入,都没有颜色变化,没有影响到棉花的正常生长与发育。结果证明,用特异表达的GhACT1 启动子替换组成型35S 启动子转化Lc基因,是获得彩色棉材料的有效途径。
RT-PCR 表达检测结果表明,Lc基因仅在转基因棉花幼胚纤维中表达,在营养体各器官组织中没有表达,这与转基因棉花的外在颜色变化相一致。从而可以推测Lc基因的存在,决定了转基因株系的颜色变化。由于棉花种皮中没有色素腺体[19],在自然生长情况下,由种皮细胞伸长形成的纤维没有颜色的变化。而Lc基因在转基因株系幼胚纤维中有较强的表达,在光照条件下可催化花青素合成出现红色纤维。本研究中光照与黑暗对比试验结果验证了这一观点。幼胚的光照与黑暗离体培养试验结果表明,在转基因棉花幼胚表皮毛的初始及伸长期早期,纤维细胞中出现红色液体,经显微镜观察,同35S-Lc 转基因棉花纤维一样,花青素红色油状物积累在幼嫩纤维细胞的中央大液泡中。这是因为色素在细胞质中合成后,经ATP 连接的H+泵作用,被压入液泡中[20]。在试验过程中发现,变红的棉纤维继续培养1 周后,新伸长纤维不再继续变红,而是变为粉色甚至褪色为白色。这一现象表明在后来的生长过程中,纤维没有产生新的花青素,而已经产生的花青素也因为条件的变化而褪色,推测是由于GhACT1 启动子在棉纤维伸长期及次生壁增厚期不再具有功能,不能够驱动目的基因Lc表达而调控花青素的合成与积累。这一现象验证了2008 年范小平等的GhACT1 反义功能研究结果,即GhACT1 仅在棉花纤维发育初始阶段表达,在伸长期及次生壁增厚期表达微弱甚至没有[21]。而 2005 年,Li 等的报道也说明GhACT1 在幼胚纤维伸长期开花后10 d 之前有较强表达,而在营养体组织如叶、 根等及生殖体组织如花药、花瓣、苞片里没有或仅有很弱的表达,在纤维成熟期几乎没有表达[13]。因而这也是今后改良棉花纤维颜色研究需要改进的地方。
4 结论
通过农杆菌介导法将GhACT1-Lc 转入棉花,获得25 个转基因棉花再生株系。通过试验证明GhACT1-Lc 成功整合到棉花基因组,并且在幼胚纤维中具有一定的功能,促进了花青素在棉花纤维中的合成积累,使转基因棉花幼胚纤维在离体光照条件下呈现红色,为今后改良棉花纤维颜色研究奠定了基础。

