陆地棉基因GhMYB52的克隆及特征分析
杜静静,田岳,冯昊,郭梦兰,杨琴莉,丁林云,李洁,胡艳,*,张天真,
(1.南京农业大学作物遗传与种质创新国家重点实验室,南京210095;2.浙江大学农业与生物技术学院农学系,杭州310058)
自然界中植物通过基因的激活、沉默以及时空特异性的表达来调控细胞的分化、组织器官的形成以及植株的生长发育过程,这一系列的调控过程需要各种各样的酶和调节蛋白共同协作完成。转录因子(Transcription factor,TFs)就是这样1 类调节蛋白。MYB 转录因子是目前在植物体内发现的数量最多、 种类最丰富的1 类转录因子,因其N 端高度保守的DNA 结合域——MYB(v-myb avian myeloblastosis viral oncogene homolog,MYB)结构域而得名,该结构域由1 个或数个51~52 个氨基酸串联而成的R 结构域组成[1-3]。R 结构域的主要作用是参与空间结构中疏水核心的形成,其数量是区分不同种类MYB 基因的主要依据[4]。根据 R 结构域的数量,MYB 基因家族分为 4 大类:(1) 含有 1 个 R 结构域的为1R-MYB;(2)含 2 个 R 结构域的为 R2R3-MYB;(3)含有 3 个 R 结构域的为 3R-MYB;(4)含有 4个R 结构域的MYB 类转录因子,称为4R-MYB类转录因子[5]。研究表明,MYB 转录因子在植物的次生壁(Secondary cell wall,SCW)发育过程中发挥重要的作用[6]。高等植物尤其是拟南芥次生壁的加厚过程受到基于NAC-MYB 转录因子形成的三级调控网络的调控:NAC 类转录因子作为转录开关调控位于下游的第二级MYB 类转录因子,从而影响第三级的主要以MYB 转录因子为主的转录因子,进而调控纤维素、半纤维素等的合成[7]。
棉花成熟纤维细胞壁含有90%以上的纤维素[8]。在棉花纤维细胞壁次生壁加厚期开花后16~40 d(Days post anthesis,DPA),纤维素大量合成和沉积[9]。目前,有关纤维素合成和代谢的主要调控因子纤维素合酶的研究已有不少报道[10],其他糖代谢基因如蔗糖合酶、 几丁质酶、β-1, 3-内葡聚糖酶等也与纤维次生壁加厚密切相关[11-15]。除此之外,一些转录因子也参与棉花纤维细胞次生壁加厚过程。棉纤维细胞次生壁加厚期优势表达的NAC 类转录因子 GhFSN1 在纤维SCW 加厚期起正向调控作用。转基因试验证明,在棉花中过表达GhFSN1 基因能够促进棉纤维SCW 厚度的增加,但纤维长度变短。转录组数据表明GhFSN1 能够通过激活其下游SCW 相关基因来促进棉纤维SCW 的生长发育,其中MYB 在调控网络中发挥重要的作用。但是,GhFSN1 基因是通过调控哪些MYB基因参与棉纤维次生壁的发育过程尚不清楚[16]。
次生壁加厚期纤维素的合成影响纤维的强度与马克隆值等,该时期是决定棉纤维品质的关键时期。因此,挖掘参与棉纤维次生壁加厚期的基因,研究次生壁发育的分子机制和调控网络具有重要的意义。本研究从陆地棉中筛选到1 个在棉花纤维次生壁加厚期优势表达的MYB 转录因子基因GhMYB52,对其进行组织表达、转录激活鉴定、亚细胞定位和酵母互作分析,初步探究该基因的表达模式和分子功能,为今后深入研究该基因的分子生物学特性及遗传进化等奠定基础。
1 材料与方法
1.1 植物材料与处理
用于棉花组织表达分析的陆地棉(Gossypium hirsutumL.) 材料 TM-1 和海岛棉 (G.barbadenseL.) 材料海7124 均种植于南京农业大学当涂试验基地(安徽省马鞍山市当涂县),采用常规大田管理。
用于瞬时转化的烟草材料为本氏烟,种植于浙江大学人工气候室,温室条件:温度22 ℃;光照16 h、黑暗8 h;相对湿度75%~80%。
以上所用植物材料均由南京农业大学作物遗传与种质创新国家实验室提供。
1.2 载体与试剂
使用的转基因载体 pBINGFP4、pGBKT7、pGADT7 载体以及Y2H 菌株保存于本实验室。大肠杆菌DH5α 感受态购于Vazyme 公司、 农杆菌(Agrobacterium tumefaciens)菌株 GV3101 感受态购于南京沃华生物科技有限公司。限制性内切酶BamHⅠ、SmaⅠ、NdeⅠ、EcoRⅠ、KpnⅠ、NcoⅠ购于NEB 公司。胶回收试剂盒、质粒提取试剂盒购自 Axygene 公司。One Step Cloning Kit 重组酶、Phanta Super-Fidelity DNA Polymerase 高保真酶、HiScript Reverse Transcriptase 反转录试剂盒购买自 Vazyme 公司。YPDA、SD/-Trp、SD/-Trp-Leu、SD/-Trp-Leu-His 营养缺陷培养基、酵母双杂试剂盒(Cat.No.630489)购于 Takara 公司(中国,大连),X-Glu 试剂购于南京梅林雪海公司。乙酰丁香酮购于源叶生物。引物合成和测序由杭州擎科生物有限公司完成。RNA 快速提取试剂盒购于钟鼎生物(中国,南京)。本研究所用引物序列见表1。

表1 引物序列Table 1 Primers used in this study
1.3 RNA的提取及cDNA的合成
按照EASYspin Plus 植物RNA 快速提取试剂盒说明书,提取TM-1 和海7124 的花托、花瓣、雄蕊、 雌蕊、 花萼、-3 DPA、-1 DPA、1 DPA、3 DPA 的胚珠,以及 5 DPA、10 DPA、15 DPA、20 DPA、25 DPA、30 DPA 的棉花胚珠和纤维组织RNA。使用反转录试剂盒将各组织RNA 反转录,合成第一链cDNA。
1.4 GhMYB52基因的克隆
根据本课题组对MYB 转录因子家族分析结果,从陆地棉 TM-1 基因组(V1.1)中获得了 34 个位于A12 号染色体上的R2R3 类MYB 转录因子基因。结合陆地棉TM-1 的35 个不同组织表达谱数据[10],从中选出了1 个在棉花纤维发育次生壁加厚期优势表达的基因Gh_A12G2460。因其与拟南芥中AtMYB52 基因的相似度最高,将其命名为GhMYB52。进一步通过一步克隆法,设计带有XbaⅠ和SmaⅠ酶切位点的重组引物(Gh-MYB52F 和 GhMYB52R),以 TM-1 20 DPA 纤维组织的cDNA 为模板扩增目的基因。聚合酶链式反应(Polymerase chain reaction,PCR)产物经过凝胶电泳胶回收试剂盒纯化后,与使用相同酶切位点进行双酶切后的pBinGFP4 载体进行重组连接,并转化大肠杆菌。利用pBinGFP4 载体通用引物GFP4F 和GFP4R 进行阳性鉴定,并送至杭州擎科生物有限公司进行测序。
1.5 生物信息学分析
使用 DNAMAN 软件对 GhMYB52 氨基酸序列进行保守性分析。采用邻近连接法(Neighbor-joining,NJ) 使用 MEGA 构建系统进化树[17]。通过 ExPASy(https://www.expasy.org/)在线网站预测GhMYB52 蛋白序列的理化性质和蛋白结构模型。
1.6 实时定量PCR
实时荧光定量 PCR (Real-time quantitative PCR,RT-PCR)反应体系和反应程序按照AceQ®qPCR SYBR®Green Master Mix 试剂盒说明书进行。定量 PCR 仪型号为 Roche LightCycler 96 实时荧光定量PCR,操作方法参考分析仪说明书。定量引物为 GhMYB52-qF 和 GhMYB52-qR。棉花组成型表达的Histone3 基因(Gh_D03G0370)为内参基因。基因的相对表达量采用2-ΔΔCt方法分析,试验进行3 次技术重复。荧光定量的数据利用Excel 软件,通过最小显著差数法(Least significant difference,LSD)进行差异显著性分析。
1.7 酵母转化
设计带有NdeⅠ和EcoRⅠ酶切位点的PCR引物:GhMYB52-YF 和 GhMYB52-YR,GhFSN1-YF 和 GhFSN1-YR,分别扩增GhMYB52 和GhFSN1 基因的编码序列( Coding sequence,CDS)。按照一步克隆法,构建 GhMYB52-pGBKT7 和GhFSN1-pGADT7 载体。按照YeastmakerTMYeast Transformation System 2 试剂盒说明书操作方法,将 GhMYB52-pGBKT7 质粒转化 Y2H 菌株,涂布于含有 50 μg·L-1AbA(Aureobasidin A,金担子素)抑制剂的SD/-Trp 营养缺陷型培养基上,以进行转录激活/ 抑制功能的验证。另外,将Gh-MYB52-pGBKT7 和 GhFSN1-pGADT7 质粒共转化 Y2H 菌株,并设置阳性对照 (pGBKT7-53+pGADT7-T)、 阴 性 对 照 (pGBK-Lamin c +pGADT7-T),涂布于含有 450 μg·L-1AbA 抑制剂的三缺SD/-Trp/-Leu/-His 营养缺陷型培养基上,进行酵母互作分析。将培养基置于30 ℃恒温培养箱,培养2 d 左右,观察菌斑的生长情况。
1.8 亚细胞定位鉴定
采用农杆菌转化法,将构建好的过表达载体35S::GhMYB52::GFP 转化农杆菌菌株 GV3101。按照烟草瞬时转化法,选取培养25 d 的烟草,将准备好的农杆菌菌液,注射进完整且厚的烟草叶片中。注射后对侵染的烟草叶片进行避光处理,48 h 后在Zeiss 荧光共聚焦显微镜下观察注射过的烟草叶片中的GFP 信号[18]。
2 结果与分析
2.1 GhMYB52基因的克隆及序列特征分析
以陆地棉 TM-1 的 20 DPA 纤维 cDNA 为模板,用一步克隆法获得GhMYB52 基因的CDS。GhMYB52 基因全长为 672 bp,编码 223 个氨基酸残基。ExPASy 在线网站预测GhMYB52 基因编码产物的相对分子质量约为26.06 kDa,等电点为9.83,R2R3 结构域位于第 1~55 个氨基酸序列 (图1)。通过 BlastP 比对,在 TAIR 网站(https://www.arabidopsis.org/) 中筛选出 5 个与GhMYB52 蛋白序列相似度大于50%的拟南芥R2R3 类MYB 转录因子。氨基酸序列分析结果(图 2) 表明,GhMYB52 蛋白的 N 端含有 1 个高度保守的 R2R3 结构域。根据 R2R3 类 MYB 转录因子C 端的保守性的差异,进一步将其分成25 个亚族。我们提取了拟南芥中R2R3 类不同亚族的58 个转录因子,系统进化树的分析结果(图3)表明,GhMYB52 属于 R2R3 类 MYB 转录因子家族第21 亚族。
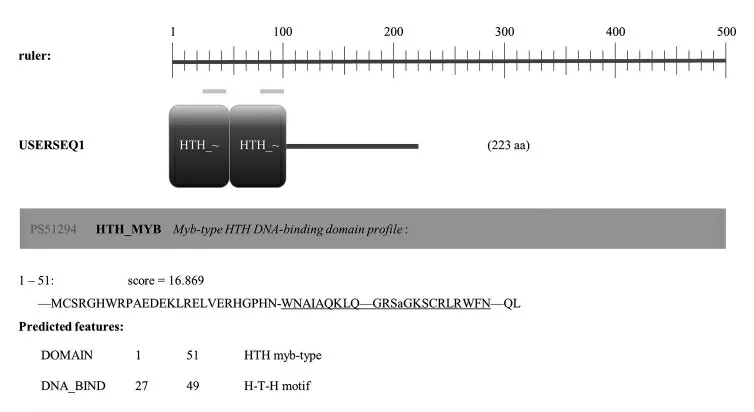
图1 GhMYB52 蛋白结构域分析示意图Fig.1 Structure analysis of GhMYB52 protein
2.2 GhMYB52基因的表达模式分析
陆地棉转录组数据显示,GhMYB52 基因在棉纤维次生壁加厚期优势表达,尤其是在15 DPA、20 DPA、25 DPA 的纤维中表达量很高。利用 qRT-PCR 方法分析了 TM-1 中GhMYB52 基因和海 7124 中同源基因GbMYB52 (GB_A12G3024)在花瓣、雌蕊、雄蕊、花托、-3~3 DPA 的胚珠、5~30 DPA 的胚珠以及纤维等不同组织中的表达情况。结果表明:在所检测的组织中,GhMYB52 与GbMYB52 的表达情况基本一致,均在 15 DPA 的胚珠、15~25 DPA 的纤维中优势表达(图4),与转录组数据的表达情况基本一致,推测GhMYB52 基因可能在棉花纤维发育次生壁加厚期发挥功能。

图2 GhMYB52 与拟南芥中MYB 转录因子保守域氨基酸序列比对分析Fig.2 The sequence alignment of MYB domain of GhMYB52 and related protein from A.thaliana
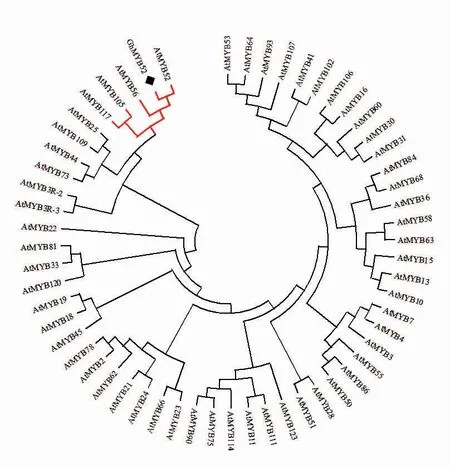
图3 棉花GhMYB52 蛋白与拟南芥中R2R3 类MYB 蛋白的系统进化树分析Fig.3 Phylogenetic analysis of the GhMYB52 protein and R2R3 MYB protein in A.thaliana
2.3 GhMYB52蛋白亚细胞定位
蛋白序列分析显示GhMYB52 蛋白包含核定位信号。为了验证GhMYB52 蛋白是否具有核定位特性,在本氏烟叶片细胞中瞬时表达Gh-MYB52,结果(图5)显示,绿色荧光信号聚集在细胞核区域,说明GhMYB52 蛋白是1 个核定位蛋白。
2.4 GhMYB52转录激活活性分析
将转化得到的含GhMYB52 基因的阳性单菌落涂在含有 50 μg·L-1AbA 抑制剂的 SD/-Trp培养基上继续培养,结果(图6)表明,菌落能够正常生长,证明了GhMYB52 具有转录激活活性,是1 个转录激活子。
2.5 GhMYB52能与NAC类转录因子GhFSN1发生互作

图4 GhMYB52 基因在棉花不同组织中的表达模式Fig.4 Expression profile of GhMYB52 gene in different tissues and different developmental stages

图5 GhMYB52 在本氏烟中的亚细胞定位Fig.5 Localization of GhMYB52 in leaf cells of N.benthamiana

图6 GhMYB52 转录因子的转录激活验证Fig.6 Assay of GhMYB52 transcriptional activation activity
对过表达GhFSN1 基因植株的转录组数据分析,发现GhMYB52 基因的表达呈现正相关的上调趋势[16]。为了进一步研究GhMYB52 参与棉花纤维次生壁加厚过程的机制,通过酵母双杂交试验的方法研究GhMYB52 蛋白与GhFSN1 蛋白之间的互作关系。酵母双杂交的结果(图7)显示,GhMYB52 与GhFSN1 之间能够发生较强的相互作用。
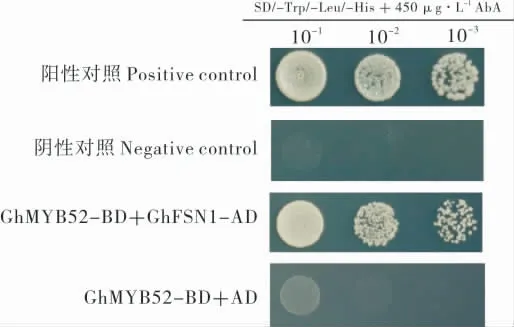
图7 酵母双杂交验证GhMYB52 与NAC 类转录因子GhFSN1 互作Fig.7 Interactions of GhMYB52 with the NAC transcription factor GhFSN by yeast-two hybridization assay
3 讨论
MYB 转录因子广泛存在于植物各类组织器官中。目前,关于MYB 类转录因子的研究,主要集中在拟南芥、棉花、水稻等作物中[19-24]。大量的MYB 转录因子在植物的生长发育、 细胞分化过程中发挥重要的作用[25-29]。其中,MYB 转录因子在拟南芥的木质部导管细胞以及木质部、厚壁细胞的纤维细胞发育过程中的作用已经比较清楚:以NAC 和MYB 类转录因子为核心成员的一系列转录因子形成分级调控网络,调节下游的一系列MYB 或者其他类转录因子参与次生壁中纤维素、半纤维素和木质素的合成过程[30-34]。
拟南芥中NAC 类转录因子基因SND1,主要在拟南芥的维管束间纤维及木质部纤维细胞中特异性表达,过表达SND1 能激活植物非厚壁组织细胞的次生壁合成,显性抑制SND1 则能够引起维管束间纤维和木质部纤维次生壁的厚度显著下降。同时,SND1 能够调控下游的一些MYB类 转 录 因 子 ,如MYB52、MYB54、MYB85、MYB103 等。在拟南芥中,抑制AtMYB52、At-MYB54 基因的表达使得拟南芥束间纤维细胞壁的厚度明显下降[35-36]。不同物种的同一亚族成员可能具有类似的功能。本研究从陆地棉TM-1 中得到了1 个R2R3 类MYB 转录因子 GhMYB52,氨基酸序列和进化树分析发现GhMYB52 含有1个R2R3 保守区和1 个核定位区,与AtMYB52进化关系最近,同属第21 亚族。在TM-1、海7124中,GhMYB52 和其同源基因GbMYB52 均在棉纤维次生壁加厚期优势表达,因此我们推测Gh-MYB52 基因可能参与棉纤维次生壁加厚期的发育过程。
目前已经基本掌握了双子叶植物中次生壁的发育调控网络,但是棉纤维次生壁的发育过程是否存在同样的调控网络,目前尚不清楚。2017年,李学宝团队发现棉花中的NAC 类转录因子基因GhFSN1 能够正向调控棉纤维次生壁厚度,过表达棉花植株的转录组数据表明,大量的MYB 类转录因子受到调控,其中GhMYB52 基因的表达受到GhFSN1 的正向调控[18]。我们通过酵母双杂交试验,在蛋白水平上验证了Gh-MYB52 与GhFSN1 之间能够发生较强的相互作用。这一结果进一步表明GhMYB52 基因在棉纤维次生壁发育过程中可能发挥重要的作用,为进一步研究棉花纤维次生壁加厚调控网络提供了依据。
4 结论
本研究在本实验室已有的研究基础上,通过一步克隆法,从陆地棉中克隆了1 个R2R3 类MYB 转录因子基因。氨基酸序列保守性分析显示,该基因编码产物N 端含有1 个高度保守的R2R3 结构域,且与拟南芥的AtMYB52 基因具有较高的相似性,因此,将其命名为GhMYB52。GhMYB52 基因的 cDNA 序列全长 672 bp,共编码223 个氨基酸残基,蛋白的相对分子质量为26.06 kDa,等电点为9.83。瞬时转化烟草结果表明,GhMYB52 定位于细胞核,且具有转录激活活性。TM-1 中的表达分析结果显示,GhMYB52 基因在棉纤维次生壁加厚期优势表达。酵母双杂交的结果显示GhMYB52 与正向调控棉纤维次生壁发育的NAC 类转录因子GhFSN1 发生较强的互作,表明GhMYB52 可能参与棉纤维细胞次生壁的形成,但它在棉纤维次生壁发育过程中的作用机制还有待于进一步研究。

