缺氧环境对宫颈腺癌细胞增殖和迁移的影响及其作用机制
刘艳,李月洁,黄小环,龚莉,周铁军
(1 西南医科大学附属医院,四川泸州646000;2 重庆三峡医药高等专科学校)
在全球范围内,宫颈癌的发病率和病死率均居女性恶性肿瘤的第四位,是严重威胁女性健康的常见恶性肿瘤之一[1]。宫颈癌的发病机制非常复杂,目前尚不完全清楚。缺氧是实体肿瘤微环境的基本特征之一,在肿瘤的生长、转移和治疗抵抗等方面发挥重要作用[2~4]。肿瘤的缺氧适应主要通过缺氧诱导因子(HIF)调节来实现。HIF主要有3种亚型,分别为HIF-1、HIF-2、HIF-3,其中参与调节细胞适应性缺氧的主要是HIF-1、HIF-2[5]。这3种HIF均是由一个α亚基和一个β亚基构成的异源二聚体蛋白复合物[6]。但迄今为止,关于HIF-2的研究较少。本课题组前期研究发现,在宫颈腺癌组织中HIF-2α表达明显升高,表明HIF-2α可能在宫颈腺癌的发生、发展中具有一定作用。血管内皮钙黏蛋白(VE-cadherin)是血管内皮细胞黏附连接的主要分子,是维持血管内皮细胞极性和完整性必不可少的内皮细胞特异性钙黏蛋白。有研究发现,HIF-2α可通过与VE-cadherin相互作用,促进肿瘤血管生成,继而促进胰腺癌进展[7]。但在缺氧环境中HIF-2α是否通过与VE-cadherin相互作用来促进宫颈腺癌进展尚不清楚。2014年9月~2015年4月,本研究通过氯化钴(CoCl2)干预建立宫颈腺癌细胞缺氧模型,观察了缺氧环境对宫颈腺癌细胞增殖和迁移的影响并初步探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 材料 人宫颈腺癌细胞株HeLa(以下称HeLa细胞),由西南医科大学医学基础研究中心惠赠。TC-512型PCR扩增仪,英国Techne公司。所有引物序列由上海生工生物工程股份有限公司设计合成。总RNA提取试剂盒、2×Taq PCR Master Mix,北京天根生化科技有限公司。逆转录试剂盒,成都博瑞克生物技术有限公司。兔源性HIF-2α、VE-cadherin多克隆抗体,英国Abcam公司;内参β-actin抗体、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗,北京博奥森生物技术有限公司。
1.2 细胞缺氧模型构建的CoCl2最佳浓度筛选 取HeLa细胞接种于含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖培养基中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞铺满瓶底75%左右时,胰蛋白酶消化后传代。取传3代、对数生长期、生长状态良好的HeLa细胞,以3 000个/孔接种于96孔板,随机将细胞分为观察组和对照组,然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞贴壁后,更换为含50、100、150、200、250 μmol/L CoCl2的细胞培养液继续培养。另设对照孔,不予CoCl2干预。培养24、48、72 h,每孔加入MTT溶液10 μL,37 ℃孵育4 h,小心吸弃孔内培养上清液,然后每孔加入DMSO 100 μL,室温振荡10 min,使结晶物充分溶解。酶标仪于490 nm波长处检测各孔的吸光度(OD)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-观察孔OD490值/对照孔OD490值)×100%。每个浓度设6个复孔,实验重复3次,取平均值。选取细胞增殖抑制率最低的CoCl2浓度作为细胞缺氧模型构建的最佳浓度。
1.3 细胞迁移能力检测 采用细胞划痕实验。取传3代、对数生长期、生长状态良好的HeLa细胞,以1×105个/孔接种于6孔板,随机分为观察组和对照组,然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。待细胞贴壁后,观察组加入含CoCl2、10% FBS的DMEM高糖培养基2 mL,对照组仅加入等量含10% FBS的DMEM高糖培养基,CoCl2浓度为细胞缺氧模型构建中筛选出的最佳浓度。然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养,当细胞融合70%~80%时,用10 μL枪头垂直于孔底划5条平行划痕,PBS冲洗去除悬浮细胞,加入无血清的DMEM高糖培养基继续培养。显微镜下观察继续培养0、48 h划痕距离,计算细胞迁移率。细胞迁移率=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×100%。每组设2个复孔。实验重复3次,取平均值。
1.4 HIF-2α、VE-cadherin表达检测 将HeLa细胞按3×105个/mL接种于6孔板中,每孔2 mL,待细胞融合70%~80%时,将其培养基更换为含CoCl2、10% FBS的DMEM高糖培养基3~4 mL,CoCl2浓度为细胞缺氧模型构建中筛选出的最佳浓度,继续培养0、24、48、72 h时,收集各孔细胞,检测HIF-2α、VE-cadherin表达。①HIF-2α、VE-cadherin mRNA表达:采用RT-PCR法。采用TRIzol法提取细胞总RNA,经紫外分光光度计鉴定提取的总RNA浓度和纯度合格。按PrimeScriptTMRT Reagent Kit with gDNA Eraser说明将总RNA逆转录为cDNA。以cDNA为模板,按2×Taq PCR Master Mix说明进行PCR扩增。引物序列:HIF-2α上游引物5′-AGCCTTGGAGGGTTTCATT-3′,下游引物5′-GGTGGCTGACTTGAGGTTGA-3′,扩增片段长度123 bp;VE-cadherin上游引物5′-TTTTCCAGCAGCCTTTCTAC-3′,下游引物5′-GTGTTATCGTGATTATCCGTGA-3′,扩增片段长度487 bp;β-actin上游引物5′-GCCAGTTGGACCTAACCTTAA-3′,下游引物5′-GGCCCACAGCACAGGTGAGTA-3′,扩增片段长度234 bp。PCR反应体系共20 μL:cDNA模板2 μL,上下游引物各1 μL,2×Taq PCR Master Mix 10 μL,0.1% DEPC水6 μL;反应条件:94 ℃预变性3 min,94 ℃变性30 s、57 ℃退火30 s、72 ℃延伸1 min共30个循环,最后72 ℃延伸5 min。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。②HIF-2α、VE-cadherin蛋白表达:采用Western blotting法。采用含PMSF的RIPA裂解液提取细胞总蛋白,经紫外分光光度计鉴定蛋白浓度合格。然后加入5×SDS上样缓冲液,煮沸变性。取变性蛋白10 μg,SDS-PAGE分离蛋白(5%浓缩胶、10%分离胶),电泳结束,采用湿转法将蛋白电泳产物转印至PVDF膜上。加入含5%脱脂牛奶、3%BSA的封闭液,37 ℃封闭2 h,然后加入HIF-2α、VE-cadherin、β-actin特异性一抗,4 ℃孵育过夜,次日加入HRP标记的羊抗兔IgG二抗,室温孵育45 min,ECL发光,暗室中曝光、显影,采用Quality One软件分析各蛋白电泳条带灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。
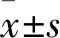
2 结果
2.1 细胞缺氧模型构建的CoCl2最佳浓度确定 各浓度CoCl2干预不同时间HeLa细胞增殖抑制率比较见表1。50、100 μmol/L CoCl2干预24 h时能够促进HeLa细胞增殖,且以100 μmol/L时效果更强。因此,以100 μmol/L CoCl2进行后续实验。
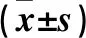
表1 各浓度CoCl2干预不同时间HeLa细胞增殖抑制率比较
注:与50 μmol/L CoCl2同时间比较,*P<0.05;与100 μmol/L CoCl2同时间比较,#P<0.05;与150 μmol/L CoCl2同时间比较,△P<0.05;与200 μmol/L CoCl2同时间比较,▲P<0.05;与同浓度CoCl2培养24 h比较,▽P<0.05;与同浓度CoCl2培养48 h比较,▼P<0.05。
2.2 两组细胞迁移能力比较 观察组与对照组细胞迁移率分别为(61.4±4.8)%、(37.9±3.6)%,两组比较P<0.01。
2.3 缺氧环境下HeLa细胞HIF-2α表达与VE-cadherin表达的关系 CoCl2干预不同时间HeLa细胞HIF-2α、VE-cadherin mRNA和蛋白相对表达量比较见表2。Pearson直线相关分析显示,缺氧环境下HeLa细胞HIF-2α mRNA相对表达量与VE-cadherin mRNA相对表达量呈正相关关系(r=0.987,P<0.05),HIF-2α蛋白相对表达量与VE-cadherin蛋白相对表达量亦呈正相关关系(r=0.869,P<0.05)。
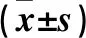
表2 CoCl2干预不同时间HeLa细胞HIF-2α、VE-cadherin mRNA和蛋白相对表达量比较
注:与干预0 h比较,*P<0.05;与干预24 h比较,#P<0.05;与干预48 h比较,△P<0.05。
3 讨论
宫颈癌是女性常见的恶性肿瘤之一。据世界卫生组织统计,2018年全球宫颈癌新发病例约57万例,死亡约31.1万例[1]。近年来,由于宫颈细胞学检查的推广和普及,很多宫颈癌得以早发现、早治疗,其发病率和病死率已有明显下降。但年轻妇女宫颈癌的发病率却呈上升趋势,尤其是宫颈腺癌。宫颈腺癌较宫颈鳞癌发病隐匿,对放化疗的敏感性较低,故患者预后也相对较差。因此,宫颈腺癌的防治已经成为保护年轻女性健康全球共同关注的话题。
缺氧是实体肿瘤微环境的基本特征之一,在肿瘤的生长、转移和治疗抵抗等方面发挥重要作用[2~4]。有研究表明,在缺氧环境中,HIF可通过多种途径促进肿瘤细胞增殖、侵袭和迁移[8,9]。HIF-2是HIF家族中重要的一员,也是调节细胞适应性缺氧的重要因子,由功能性α亚基及组成性β亚基构成。HIF-2α又称内皮PAS结构域蛋白,缺氧环境可影响其稳定性,从而调节肿瘤细胞生长、增殖过程。有研究证实,在宫颈癌、乳腺癌、肺癌等肿瘤细胞中HIF-2α异常高表达[6,10~12],降低HIF-2α表达可逆转肿瘤细胞耐药并抑制其侵袭和迁移[13,14]。VE-cadherin是维系血管内皮细胞间黏附的主要蛋白,可提供细胞骨架的物理连接,能够调节血管通透性[15]。有研究表明,VE-cadherin在高侵袭性黑色素瘤和乳腺癌中高表达,且其高表达与肿瘤高侵袭和迁移能力有关[16]。在急性淋巴细胞白血病中发现,VE-cadherin还能增强肿瘤细胞对化疗药物的耐受性[17,18]。而缺氧能够影响肝癌、喉癌、胶质母细胞瘤等肿瘤细胞内多种基因的表达,从而促进肿瘤细胞的增殖、迁移和耐药。该过程受多种因子的精确调控,如HIF、VE-cadherin、MMPs、PI3K等,但他们之间具体的调控机制仍不十分清楚。
Co2+可导致亚铁螯合酶失活,阻碍氧和血红蛋白结合,从而诱发缺氧[19],故本研究采用CoCl2处理宫颈腺癌细胞模拟缺氧环境。本研究观察了50、100、150、200、250 μmol/L CoCl2分别干预24、48、72 h时HeLa细胞增殖抑制率,结果发现50、100 μmol/L CoCl2干预24 h能够促进HeLa细胞增殖,且以100 μmol/L时效果更强,故后续选择100 μmol/L CoCl2构建细胞缺氧模型。本研究还发现,150、200、250 μmol/L CoCl2干预24 h即可表现出对HeLa细胞增殖的抑制作用,且随着干预时间延长,细胞增殖抑制作用越来越明显。表明一定程度缺氧可促进HeLa细胞增殖,但肿瘤细胞对缺氧的耐受有限,当缺氧超过肿瘤细胞的耐受程度时,则会抑制肿瘤细胞增殖。
细胞迁移是活细胞普遍存在的一种运动形式。肿瘤细胞的迁移能力在血管生成和肿瘤的侵袭、转移等方面具有重要作用。本研究观察了缺氧环境对肿瘤细胞迁移能力的影响,结果发现100 μmol/L CoCl2干预的HeLa细胞迁移率明显增加,表明缺氧环境可促进HeLa细胞迁移能力。
肿瘤新生血管形成途径是一种不依赖于内皮细胞的全新肿瘤血管模式,即管壁没有血管内皮细胞,肿瘤细胞排列在管壁外表面,管腔内可见红细胞存在,又称之为血管生成拟态。血管生成拟态是肿瘤生长过程的一种微循环系统,与内皮依赖性血管、马赛克血管共同负责肿瘤生长。常氧状态下,HIF-2α不能稳定存在,缺氧时HIF-2α稳定存在并能够转入细胞核[3],从而参与肿瘤血管生成与重建、上皮间质转化、细胞周期和免疫调节因子的调节,继而影响肿瘤细胞增殖、侵袭和迁移[20,21]。Tang等[22]研究认为,VE-cadherin是缺氧条件下血管生成拟态形成的关键因子。但在缺氧环境中HIF-2α是否通过与VE-cadherin相互作用来促进宫颈腺癌进展尚不清楚。本研究结果发现,缺氧环境下HeLa细胞HIF-2α、VE-cadherin表达增加,但后者表达随着缺氧时间延长有所降低。表明在缺氧过程中,HIF-2α能够持续发挥作用,而VE-cadherin在缺氧初期作用较大,晚期作用有所减弱。Pearson直线相关分析显示,缺氧环境下HeLa细胞HIF-2α表达与VE-cadherin表达呈正相关关系,表明在HeLa细胞中二者可能存在一定调控关系。缺氧后期VE-cadherin表达降低,提示HIF-2α可能通过其他通路调节HeLa细胞增殖。
综上所述,一定程度缺氧能够促进宫颈腺癌细胞增殖和迁移能力,其机制可能与缺氧环境能够增强HIF-2α、VE-cadherin表达有关。

