HBV肝衰竭、肝硬化伴急性肾损伤患者组蛋白去乙酰化酶活性表达及意义
张海月, 张文斌, 刘 杨, 陈 倩, 龚作炯
武汉大学人民医院感染科,湖北 武汉 430060
急性肾损伤(acute kidney injury,AKI)是肝衰竭及失代偿性肝硬化患者常见严重并发症之一,病死率高,早期诊断并及时干预对改善肝衰竭、失代偿期肝硬化患者预后有重要意义。HBV肝衰竭、肝硬化患者除门脉高压内脏血管血流重新分配、肾脏灌注减少外,肝脏清除能力下降及肠黏膜屏障损伤引起的体内大量毒素积累和活化的免疫细胞释放的大量细胞因子和趋化因子所致微循环障碍加重,也在HBV肝衰竭、肝硬化患者AKI的发生、发展过程中起重要作用[1]。组蛋白乙酰化调控是蛋白质翻译后修饰之一,目前在临床上广泛应用于肿瘤治疗,另外在感染、自身免疫性疾病、肾脏病变、神经系统损伤及退行性病变等疾病中研究也有广泛报道[2-8]。本研究旨在探讨HBV肝衰竭、肝硬化伴AKI患者中组蛋白去乙酰化酶(HDAC)活性表达及意义。
1 资料与方法
1.1 研究对象收集武汉大学人民医院2017年1月至2018年12月收治的HBV肝衰竭、肝硬化患者,并按照2015年国际腹水协会(ICA)AKI诊断标准[9],将纳入研究者分成HBV肝衰竭伴AKI、HBV肝硬化伴AKI、未发生AKI的HBV肝衰竭及未发生AKI的肝硬化患者4组。肝衰竭诊断标准符合《肝衰竭诊治指南(2012年版)》[10]。ICA-AKI标准[9]:48 h内血清肌酐(SCr)增高≥26.5 μmol/L;或7 d内SCr增高至≥基线的1.5倍。基线的定义为患者入院前3个月内,离入院最近的1次SCr检测值作为基线,如入院前3个月内无检测指标,则以入院时的检测值为基线。排除标准:(1)除病毒性肝炎外其他病因引起的肝衰竭、肝硬化患者;(2)慢性肾脏疾病;(3)肿瘤患者;(4)肝肾移植术后;(5)未成年人及妊娠期患者。
1.2 观察及检测指标观察分析患者年龄、性别等一般信息,检测中性粒细胞百分比(Neu%)、降钙素原(PCT),肾功能指标SCr、eGFR,肝功能指标ALT、TBA、TBIL、PT-INR(均为患者入院前及住院期间检查结果)。收集纳入研究者血标本,迅速离心取上层血浆分装入冻存管,保存于-80 ℃冰箱备检。ELISA法检测患者血浆NGAL、KIM-1(试剂盒购自Elabscience公司)水平及血清HDAC活性表达(试剂盒购自Biovision公司)。

2 结果
2.1 纳入患者一般情况本研究共纳入患者132例,HBV相关肝衰竭患者72例,90%以上为慢加急性肝衰竭患者,其中20例肝衰竭伴AKI患者,年龄(60.0±11.47)岁,男性占60.0%;肝硬化患者60例,其中16例肝硬化伴AKI患者,年龄(61.0±3.98)岁,男性占75.0%。患者的年龄、SCr、Neu%、PCT、HBV DNA在肝衰竭伴AKI患者高于未发生AKI的肝衰竭患者,eGFR在肝衰竭伴AKI患者低于未发生AKI肝衰竭患者(P<0.05)。患者的SCr、Neu%、PCT在肝硬化伴AKI患者高于未发生AKI的肝硬化患者,eGFR在肝硬化伴AKI患者低于未发生AKI肝硬化患者(P<0.05)。肝衰竭伴AKI与肝硬化伴AKI患者相比,ALT、TBA、TBIL、PCT表达水平更高(见表1)。
2.2 纳入患者HDAC活性表达HDAC活性在HBV肝衰竭伴AKI患者高于肝硬化伴AKI患者(P=0.018),肝衰竭伴AKI患者HDAC活性高于未发生AKI的肝衰竭患者(P=0.034),肝硬化伴AKI患者HDAC活性高于未发生AKI的肝硬化患者(P=0.046),未发生AKI肝衰竭患者比未发生AKI肝硬化患者HDAC活性水平高(P=0.027)(见图1)。
2.3 患者肾损伤生物学标志物血浆NGAL、KIM-1表达NGAL、KIM-1表达在肝衰竭伴AKI患者高于肝硬化伴AKI患者(P=0.012、0.014)及未发生AKI的肝衰竭患者(P=0.043、0.017)(见图2)。
3 讨论
AKI是肝衰竭、失代偿期肝硬化患者常见并发症之一,其发生与肝病患者的预后密切相关。AKI最初的诊断主要依靠SCr值及尿量变化。肝病患者营养不良、肝功能减退时导致SCr生成减少,此外血胆红素升高、血容量分布不均、肾小管上皮细胞过量分泌等因素均可导致SCr检测值偏低,因此SCr指标作为诊断标准可能导致肝病患者GFR假阳性率升高,另外肝病患者短时间内SCr波动可能有重要的临床事件发生。有关肝病患者AKI的诊断标准有改善全球肾脏病预后组织(KDIGO)小组的KDIGO-AKI标准、ICA-AKI标准。2015年的ICA-AKI标准[9]中剔除了尿量这一指标,引入了检测动态SCr值这一概念,能够更好地反映患者肾功能损伤情况。除了SCr值外,目前很多研究提出了监测肾损伤生物学标志物有利于AKI的早期诊断,NGAL、KIM-1是肾小管损伤早期生物学标志物,肾小管受到损伤时,表达量明显升高。本研究发现HBV肝衰竭伴AKI及HBV肝硬化伴AKI患者血浆NGAL、KIM-1表达水平高于未发生AKI的肝衰竭及肝硬化患者,与上述理论一致。
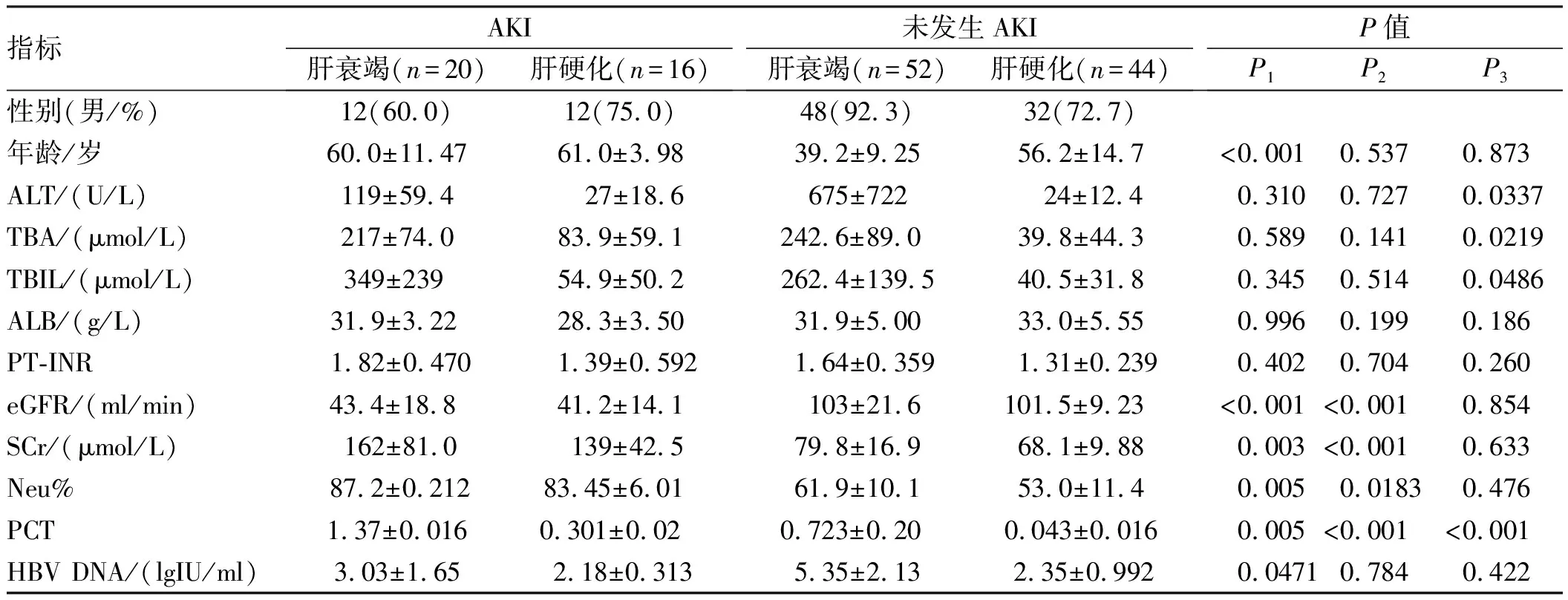
表1 纳入患者临床特征比较Tab 1 Comparison of clinical characteristics of the enrolled patients among four groups
注:P1:肝衰竭伴AKI组与未发生AKI肝衰竭组比较;P2:肝硬化伴AKI与未发生AKI肝硬化组比较;P3:肝衰竭伴AKI组与肝硬化伴AKI组比较。
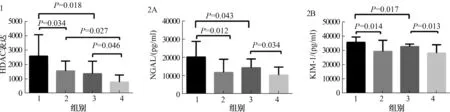
注:1:肝衰竭伴AKI组;2:未发生AKI肝衰竭组;3:肝硬化伴AKI组;4:未发生AKI肝硬化组。图1 纳入患者血浆HDAC活性表达;图2 纳入患者血浆NGAL、KIM-1表达
传统观念认为,AKI的发病机制由全身血液循环障碍所致肾脏低灌注。随着研究的深入,越来越多研究报道了炎症反应所致的促炎介质及细胞因子的大量释放也在AKI发生中起了重要作用[11-14]。肝硬化患者门脉高压、内脏血管扩张、肠道菌群移位导致循环血液中大量内毒素及TNF-α等炎性因子释放,刺激免疫细胞,免疫炎症反应发生,炎症介质释放入血,引起肾小球血管内皮细胞激活,内皮黏附分子产生增加,激活白细胞,释放炎性因子进一步加重免疫炎症反应。同时活化的白细胞向内皮细胞聚集黏附,并释放促炎因子,加重肾脏微循环血流障碍,另外血小板活化聚集,微血管血栓形成,也对微循环造成损伤。除免疫细胞、血管内皮细胞外,肾实质细胞也参与了AKI这一病理生理过程。肾小管上皮细胞受到损伤因子刺激时可发生能量适应性反应,通过降低能量消耗、肾小管上皮细胞向去极化状态过渡以促进细胞增殖进行修复,当损伤持续存在,且大量炎性细胞向肾实质浸润,肾小管损伤较重,出现凋亡、坏死。细菌感染(20%~40%)、静脉曲张破裂出血(26%)及腹腔穿刺大量放液等,均是进展性肝硬化患者发生AKI的诱因[10,15]。2/3的肝病患者AKI的发生与肾血流低灌注有关,其中40%可逆,除有效循环血量降低外,感染也是发生肾前性AKI重要促进因素,有研究报道感染增加了肾前性AKI死亡率[13,16],细菌感染与肝衰竭的严重程度和肝外器官衰竭之间存在着密切的联系。本研究发现,发生AKI的肝衰竭及肝硬化患者Neu%、PCT均高于未发生AKI的患者,提示感染炎症反应可能是HBV患者发生AKI的一个高危因素,另外肾小管损伤相关指标NGAL、KIM-1在肝衰竭伴AKI患者明显高于肝硬化伴AKI患者,提示肝衰竭伴AKI患者往往比肝硬化伴AKI患者存在更为严重的肾小管损伤。AKI患者肾脏器质性损伤的诊断有一定难度,不同类型的AKI对特利加压素和白蛋白的反应不同,因此,早期明确AKI的病因诊断及分型,对肝病患者AKI的治疗意义重大。有研究报道了进展性肝硬化待肝移植患者的肾组织活检结果显示,一半患者肾脏发生组织学改变,另外肝病患者高胆红素及高胆汁酸也可直接对肾小管造成损伤[17-19],这与本研究中肝衰竭伴AKI患者血ALT、TBIL、TBA水平高于肝硬化伴AKI患者一致。
组蛋白的乙酰化水平由组蛋白乙酰化转移酶(HAT)与HDAC共同调控来维持动态平衡状态。当疾病发生时组蛋白乙酰化平衡被打破,HDAC活性发生改变。HDAC对肾脏的发育、增殖有重要调控作用。也有研究报道了HDAC在糖尿病肾病、多囊肾、急性肾损伤等肾脏疾病的调控作用[20-22]。本研究发现肝衰竭及肝硬化患者发生AKI患者的HDAC活性高于未发生AKI患者,未发生AKI的患者中肝衰竭HDAC活性高于肝硬化患者,提示HDAC活性改变可能与疾病严重程度有关,AKI患者往往伴随感染炎症的发生,本研究体现为Neu%、PCT值高于未发生AKI患者,提示HDAC活性改变异常升高可能是疾病进展的一个预测指标,通过监测HDAC活性并及时干预其改变对预防肝病患者AKI发生、减缓AKI进展可能有潜在的治疗价值。

