原发性肝脏神经内分泌肿瘤临床特征分析
何 娜,柏建安,汤琪云
1.南京医科大学第一附属医院全科医学科,江苏 南京 210029; 2.南京医科大学附属逸夫医院消化科
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)是起源于全身散在的神经内分泌细胞的一种罕见肿瘤,包括功能性和无功能性两大类。功能性NENs可产生各种血管活性激素,如血清素、胃泌素、胰岛素、胰高血糖素和生长抑素等,从而引起腹痛、腹泻、面色潮红、皮疹等临床症状。而无功能性的NENs通常在肿块长大到压迫周围器官时才会引起相关症状[1]。
所有的NENs患者中,约57%发生于胃肠胰,27%发生于支气管肺系统。胃肠道中,大多数肿瘤发生于直肠(17.2%)、空/回肠(13.4%)、胰腺(6.4%)[2]。相比起来,原发性肝脏神经内分泌肿瘤(primary hepatic neuroendocrine neoplasms,PHNENs)极其罕见,仅占全身NENs的0.8%~4%[3],国外学者统计2011年之前全球报道不足百余例[4],我国学者统计1995年至2013年PHNENs国内外报道不足200例[5]。1958年EDMONDSON首次报道了1例PHNENs[6]。PHNENs具有与其他NENs不同的临床特征。它们生长尤其缓慢,一般在晚期才会出现比较明显的临床症状,只有6.8%的患者会有典型的类癌综合征[7]。由于超过80%的肝NENs都是转移性的,PHNENs非常少见[8]。本研究中,我们结合南京医科大学第一附属医院2例并文献复习2010年1月至2018年6月报道的26例PHNENs患者临床资料,分析其病例特点并总结经验,以期更好地认识该病。
1 资料与方法
1.1 纳入病例纳入标准:(1)肝脏穿刺或手术病理证实符合NENs特点;(2)经PET-CT、生长抑素受体显像或胃肠镜等检查手段排除其他原发部位;两者缺一不可。我们筛选了南京医科大学第一附属医院2010年1月至2018年6月病理诊断为肝脏NENs的患者共23例,结合胸腹部CT、MRI、胃肠镜及PET-CT等检查结果剔除了转移性肝脏NENs患者21例,只有2例患者考虑为PHNENs。并通过检索万方及PubMed数据库,统计2010年1月至2018年6月国内外关于PHNENs的个案报道中患者资料,仅26例符合纳入标准[1,7,9-25]。
1.2 临床资料人口统计学资料:性别、年龄、肝炎病史、首发症状、诊断时间。实验室检查结果:肝功能:谷丙转氨酶(AST)、谷草转氨酶(ALT)、总胆红素、白蛋白;肿瘤标志物:癌胚抗原(CEA)、甲胎蛋白(AFP)、神经元特异性烯醇化酶(NSE)、嗜铬粒蛋白A(CgA)。肿瘤特征:数量、位置、是否累及血管、是否有淋巴结及远处转移;组织病理学特点:HE染色,免疫组织化学染色:突触素(Syn)、CgA、CD56、NSE、Ki67[26]。
1.3 评估通过定期复查CT、MRI等影像学手段来评估肿瘤的情况和治疗的效果。
1.4 统计学分析采用SPSS 16.0软件进行统计学处理,正态分布的计量资料用均数表示,偏态分布的计量资料用中位数表示,计数资料以例数/%表示。
2 结果
2.1 流行病学文献检索到的26例及本院2例,合计28例PHNENs患者中,男11例,女17例,发病中位年龄为51.5岁(6~87岁),病史1个月至10年以上,起病或缓或急,所有患者均无病毒性肝炎病史及家族史。国内病例主要集中在东部地区,来源于上海(3例)、江苏(3例)、吉林(2例)、北京(2例),其余江西、河南、湖南、四川、山东各1例。国外病例来源于韩国(2例),美国、日本、土耳其、英国、伊朗、荷兰各1例,另5例患者发病地区不明。
2.2 临床表现最常见的症状为腹部疼痛(13例,46.4%)。其他症状包括腰背部疼痛、恶心呕吐、黑便等,3例(10.7%)患者无任何症状,例行体检时发现肝脏肿块。所有患者中,仅1例出现面色潮红的类癌综合征表现[27]。
2.3 肿瘤特点和实验室检查结果初次诊断时17例(60.7%)患者表现为单发肿块,11例(39.3%)患者表现为多发肿块。血清学检查中,2例患者的AST轻度升高,1例患者的白蛋白轻度降低,其余患者ALT、AST、GGT、白蛋白及胆红素都在正常范围内。肿瘤标志物检查中,2例患者CEA升高,1例为6.95 ng/ml,1例为532.9 ng/ml(正常范围<4.7 ng/ml);3例患者NSE升高,分别为21.55 ng/ml、145.8 ng/ml、171.2 ng/ml(正常范围<16.3 ng/ml);仅1例患者行CgA血液学检查,为28 ng/ml(正常范围1.9~15 ng/ml),轻度升高。其余检查结果均在正常范围内。免疫组化中,23例(82.1%)CgA阳性,24例(85.7%)Syn阳性,17例(60.7%)CD56阳性,4例(14.3%)NSE阳性(见图1)。病理分级为G1级2例(7.1%),G2级16例(57.1%),G3级10例(35.7%)(见表1)。

图1 PHNENs组织中Syn、CgA、CD56呈阳性表达免疫组化染色,放大200倍 A:Syn表达阳性; B:CgA表达阳性; C:CD56表达阳性Fig 1 Positive expressions of Syn, CgA and CD56 in tissues of PHNENs A: Syn positive expression; B:CgA positive expression; C:CD56 positive expression

表1 28例患者的人口统计学资料及肿瘤的特点 Tab 1 Demographic data and characteristics of tumors of 28 patients
注:有10例患者肿瘤大小文献未提及。
2.4 器械检查B超:19例患者行腹部超声检查发现肝脏肿块,11例提示肝多发实质包块,8例提示肝单发实质包块。CT:6例患者初诊时行腹部CT检查,平扫时表现为肝脏低密度肿块或结节,肿块边界清楚,增强扫描动脉期病变呈不均匀明显强化(见图2)。MRI:3例患者行MRI检查,呈长T1、长T2,DWI呈高信号;增强扫描病变呈缓慢不均匀强化[28]。行胃肠镜检查、PET-CT、111In-生长抑素受体显像者分别为17、11、7例,未发现其他可能原发部位。
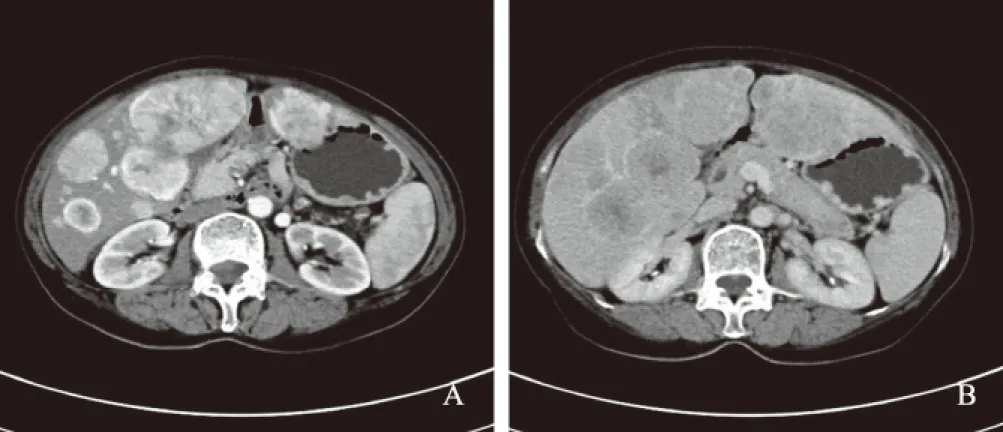
图2 PHNENs的CT动脉期、延迟期 A:动脉期; B:延迟期Fig 2 CT arterial phase and delayed phase of PHNENs A:arterial phase; B:delayed phase
2.5 治疗方案和结局病理分级为G1级的2例患者均拒绝治疗,1例18个月死亡,1例出院1个月后失访[9-10];G2级16例,其中7例接受单纯手术切除治疗,4例接受肝动脉化疗栓塞(transhepatic arterial chemoembolization,TACE)治疗,2例行肝移植手术,2例接受多方案治疗,1例治疗方法不详[11-19]。G3级患者10例,5例接受单纯手术治疗,1例接受放化疗,2例拒绝治疗,2例文献中未提及治疗方案[20-25](见表2)。
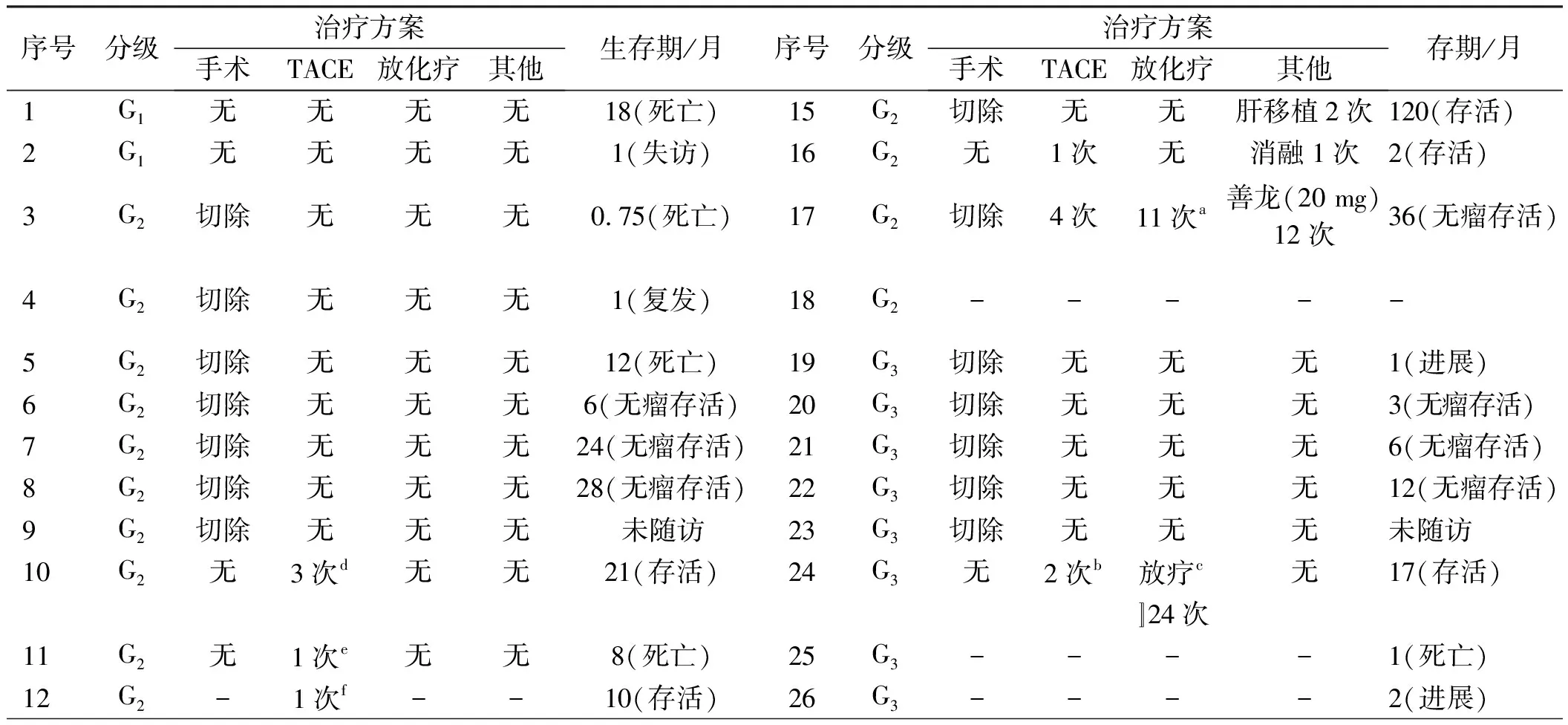
表2 28例PHNENs患者的治疗方案和结局Tab 2 Treatment and outcome of 28 patients with PHNENs
续表2

序号分级 治疗方案手术 TACE 放化疗 其他生存期/月序号分级 治疗方案手术 TACE 放化疗 其他生存期/月13G2无 1次g 无 无 6(存活)27G3-----14G2无 无 无 肝移植 36(死亡)28G3-----
注:a:术后前3个月每月吉西他滨化疗1次,术后第3~6个月每月行吉西他滨+氟尿苷+亚叶酸钙化疗1次,随访1年后因肿瘤标志物较前轻度升高,行吉西他滨+氟尿苷+亚叶酸钙化疗5次;b:5-氟尿嘧啶1 000 mg+丝裂霉素8 mg+顺铂80 mg+阿霉素40 mg;c:脑放疗14次,肝脏放疗10次; d: 米铂84 mg; e: 奈达铂40 mg+雷替曲塞4 mg; f: 奥沙利铂100 mg; g: 奥沙利铂150 mg; -:文献未提及。
3 讨论
在2010年出版的第四版消化系统肿瘤WHO分类分级中,NENs分为3级,低、中级别的NENs分别为G1级和G2级,而高级别的NENs命名为神经内分泌癌。新的分类方法中,核分裂象和Ki67是NENs分级和分类的决定性因素(见表3)。为了明确肿瘤的进展,尚需要对肿瘤进行TNM分期。第七版AJCC/UICC的TNM分期中包含了胃、小肠、结肠、直肠和壶腹部等部位的NENs,但还无关于PHNENs的TNM分期系统[29]。
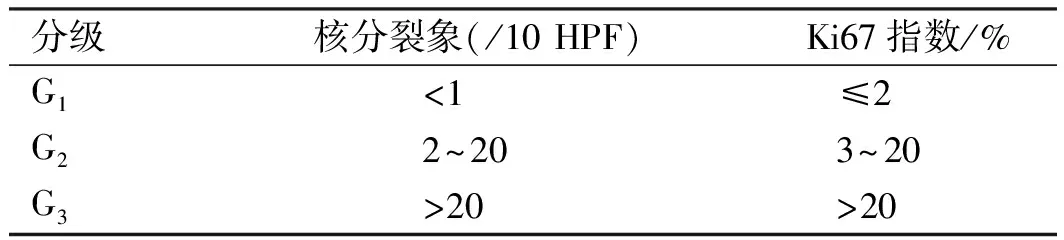
表3 2010年WHO NENs分级Tab 3 NENs grading in WHO 2010
在美国,NENs的发病率逐年上升,在过去40年间(1973年至2012年)由1.09/100 000增长至6.98/100 000,增长了6.4倍[30]。然而,绝大多数的NENs是临床沉默型的,不易被发现,因此实际的发生率可能更高。原发于肝脏的NENs相对罕见,占所有肝脏肿瘤的1%~5%[19],因此医务工作者对该病的临床特点和治疗方法知之甚少,诊断也一直存在争议。由于肝脏是NENs最常见的转移部位,与转移性肝脏NENs的鉴别诊断是诊断PHNENs的重要环节,有文献报道,患者性别、肿瘤大小、发生部位、肿瘤个数4项指标对于区别肝NENs是原发性还是转移性具有一定的参考价值,但最关键的鉴别方法是通过CT、MRI、PET-CT、生长抑素受体显像及消化内镜等多种手段排除其他原发灶可能[31]。病例报道中,有1例最初诊断为PHNENs患者肝脏切除术后出现肝肺多发转移,术后1年查胃镜提示腺癌,不能排除胃组织早有潜在性恶变可能[32]。因此,由于有些原发灶起病隐匿,治疗后还需要长期的随访。
之前的研究表明,大多数PHNENs发生于中年人,且女性更常见[33]。本研究中,17例(60.7%)是女性,中位发病年龄为51.5岁,与之前报道相符。我们的研究中患者的血清肿瘤标志物2例患者CEA升高,3例患者NSE升高,其余均在正常范围内,可见目前常用的肿瘤标志物对于PHNENs灵敏性不高,而之前有研究认为,CgA诊断NENs的灵敏性为71%,特异性为87%[34],可用于肿瘤诊断和治疗过程中的监测。本研究发现,仅国外报道的1例患者行该项检查,可见血清CgA检查在国内外尚未普及,有待进一步研究及推广。文献回顾中,仅1例患者行尿5-HIAA检测,在正常范围内。NENs的诊断主要依赖病理,早期文献报道,PHNENs免疫组化CgA阳性率为89.1%,Syn阳性率为55%[35]。本研究中,CgA阳性率82.1%,Syn阳性率85.7%,CD56阳性率60.7%。
目前为止,肝切除术仍是PHNENs的首选治疗方法,使患者获得无瘤生存。外科切除的目的主要是两个,一是为了能够通过切除肿瘤治愈该病,二是通过降低肿瘤负荷来缓解患者的症状。有文献报道,85%的PHNENs可行手术治疗,且术后5年生存率为74%~78%[36]。如果肿瘤局限于肝脏但又不适合手术,TACE或肝脏移植也是可考虑的治疗选择。因为PHNENs富含血管,对局部缺血非常敏感,TACE可用于肿瘤细胞减灭[37]。对于有远处转移的患者可考虑化疗,但它是否有效仍是备受争议的问题。可选择的化疗药物有5-氟尿嘧啶、阿霉素、丝裂霉素、依托泊苷和顺铂等。近期,肽受体放射性核素治疗(peptide receptor radionuclide therapy,PRRT)在功能性生长抑素受体阳性的胃肠胰NENs中取得了较好的效果,即利用放射性核素标记生长抑素类似物(somatostatin analogous,SSTAs)对生长抑素受体(somatostatin receptors,SSTRs)的特异性结合,可将标记的放射性核素在肿瘤原位发挥化疗和内照射的双重治疗作用[38]。但因大多数PHNENs的SSTRs表现为阴性,对于该病的效果仍有待研究。
本研究有几点局限性:(1)患者数量较少以及回顾性研究的设计,但可为今后PHNENs患者的诊断和治疗提供有价值的信息;(2)由于血液CgA检查尚未普及,我们的研究中仅1例患者行该项检查,我们正在进行这方面的研究,以期填补这一空白。
尽管PHNENs非常少见,但在诊断肝脏肿瘤时仍应该被考虑为鉴别诊断之一。因为胃肠道是NENs常见原发部位,当肝脏活组织检查提示肝脏肿瘤是NENs时,需结合内镜及影像学检查排除其他原发部位的可能,并需要长期随访。手术切除是治愈该疾病的唯一方法。
由于PHNENs罕见,目前多为零散的个案报道,且患者分散于各个城市,尚不能形成系统的研究。随着内镜、影像、功能显像等技术的飞速发展,相信这一疾病发病率会有所提高,医务人员对其认识也会逐渐加深,从而实现多中心研究,推动对该病基础和临床研究的进一步深入。

