Ti3SiC2偶合C改性Li3V2(PO4)3正极材料低温充放电性能研究
江 虹 陶红波
(1.贵州广播电视大学 贵阳 550004; 2.贵州建设职业技术学院 贵阳 550012)
1 前言
锂离子二次电池的充/放电靠正极材料锂离子,故正极材料是锂离子电池至关重要的一部分,是决定锂离子电池循环性能的关键。
Li3V2(PO4)3由于高操作电压、好离子迁移和高理论容量已为锂离子电池正极材料研究热点,其在3.0-4.3 V之间,可发生V3+/V4+氧化还原反应,其中有两个锂离子能够可逆脱出和嵌入;而在3.0-4.8 V之间,材料中的三个锂离子可以完全脱嵌,第三个锂离子的可逆脱嵌使得材料的理论放电比容量可达到197mAh g-1。此外,我国的钒矿资源非常丰富,因此从经济和性能角度上看,Li3V2(PO4)3是一种具有良好发展前景的锂离子电池电极材料。但是与LiFePO4相似,低的电子电导率限制了它的实际应用。目前的研究主要尝试通过离子掺杂、包覆C和导电性好的材料、控制颗粒尺寸和改变颗粒形态来提高材料电导率。
锂离子电池在高温环境下使用,电极动力学过程将变得不稳定,甚至难以控制,电池使用的安全性大为降低,极端情况下还会发生燃烧或者爆炸事故,因此,锂离子电池应尽可能避免在高温环境下使用或者设法采取最佳散热设计,使锂离子电池在使用过程中产生的热量及时得到疏散,避免事故发生,关于这方面的研究已得到许多学者关注。
在很多场合,锂离子电池也不得不面临低温使用条件,比如在冬季气候(我国南方许多地区较长时间处于0℃或更低,而北方的低温天气更为恶劣)条件下或者高空、太空环境中。并且,随着各种锂离子电池产品应用范围的日渐扩大,如在电动汽车、军事、航空航天等领域的应用,对锂离子电池的低温性能也提出了更多更高的要求。因此,研究锂离子电池低温性能并针对不同影响因素采取相应措施加以改善,意义重大。
本文通过C包覆Li3V2(PO4),进一步复合Ti3SiC2制备锂离子电池正极材料并研究其在低温环境下的充放电性能。结果显示,Ti3SiC2的加入对电极的动力学过程有明显的改善效果,降低了电极极化,随着温度的降低,改善效果更为显著[1]。
2 Ti3SiC2偶合C改性Li3V2(PO4)3正极材料的制备
2.1 C包覆Li3V2(PO4)3(Li3V2(PO4)3/C)正极粉体制备
用Sol-gel法制备Li3V2(PO4)3/C,所用原料有NH4H2PO4、V2O5、Li2CO3及C6H8O7·H2O。首先,按化学摩尔计量比称取各原料分别放入烧杯。其次,深蓝色溶液制备,将适量去离子水倒入装有C6H8O7·H2O烧杯,C6H8O7·H2O充分溶解后倒入装有V2O5的烧杯中,在磁力加热搅拌器上恒温60℃搅拌直到形成深蓝色溶液。再次,深蓝色湿凝胶制备,将适量去离子水分别倒入装有NH4H2PO4和Li2CO3烧杯,NH4H2PO4和Li2CO3充分溶解后到入深蓝色溶液烧杯,并在磁力加热搅拌器上加热搅拌到60℃后恒温搅拌充分。用乙酸调节pH=4,使混合液体在60℃搅拌并升温至80℃,继续搅拌使混合液体溶剂不断蒸发,最后形成深蓝色湿凝胶。最后,得到正极粉体,将装有深蓝色湿凝胶烧杯放入烘箱静置,恒温80℃,1天形成干凝胶。用玛瑙研钵研磨干凝胶呈绿色粉末状,绿色粉末在氢体积比为5%的氢氮混合气氛下350℃保温4小时,氨气、水汽等气体充分排除后升温至750℃保温8小时,放置冷却至室温。二次研磨粉体后过280目筛,得到碳质量分数含量为5.73% C包覆Li3V2(PO4)3(Li3V2(PO4)3/C)正极粉体。
2.2 Ti3SiC2偶合C改性Li3V2(PO4)3正极粉体的制备
将得到的Li3V2(PO4)3/C粉体分散到去离子水中形成悬浮液,加入质量分数为0.5%的聚乙烯醇溶液,超声振荡后于室温下搅拌。按Ti3SiC2质量分数分别为0、3%、4%和5%称取Ti3SiC2溶于去离子水中形成溶液,室温下搅拌,逐滴加入到Li3V2(PO4)3/C悬浮液中,然后在60℃下搅拌后升温到80℃搅拌,直至水蒸发得到糊状物。将得到的糊状物放入烘箱80℃下干燥,之后研磨得到包覆Ti3SiC2的Li3V2(PO4)3/C粉体。在氩气氛下650℃热处理5小时,研磨过280目筛,得到 C和Ti3SiC2偶合改性Li3V2(PO4)3正极材料粉体。将Ti3SiC2包覆量为0、3%、4%和5%的样品,分别命名为T0、T3、T4和T5。
3 Ti3SiC2偶合C改性Li3V2(PO4)3为正极的电池制备
将所制备的C和Ti3SiC2偶合改性Li3V2(PO4)3材料为正极粉体、聚四氟乙烯乳液和乙炔黑按质量比80:15:5混合制成正极片,在充满氩气的手套箱中组装成2430型扣式电池。电解液为1mol/L LiPF6的二甲基碳酸酯(DMC)和碳酸乙烯酯(EC)的混合液(DMC与EC体积比为1:1),电池隔膜为Celgard 2400聚丙烯微孔膜,电池的负极为锂片。
4 Ti3SiC2偶合C改性Li3V2(PO4)3正极材料电池低温充放电性能研究
4.1 室温充放电性能研究
图1是电压窗口为3.0-4.8 V,T0-T5样品分别在不同倍率下的首次充放电曲线。结果显示出4个试样有类似的充放电曲线。4个充电平台,3个放电平台。
4个样品的充放电曲线在低倍率下区别微小,随着倍率增加,从0.2 C到5 C,与其他样品相比,T4样品显示出最长的放电平台;而T0样品的两个充电平台逐渐合二为一,第三个放电平台逐渐变得倾斜。在高倍率下因为极化的增加和电解液的分解使充放电平台变得不明显[2]。充放电时,倍率越大,电流密度越大,电极电荷积累越多。随着时间积累,电荷在电极上的积累越来越多,电极电位偏离平衡电位,产生严重的极化现象。
比较图1的(a)(b)(c)(c)4张图,可以看出,相比T0样品,T3、T4和T5样品具有更平缓的充放电平台,Ti3SiC2偶合C改性Li3V2(PO4)3的样品极化在充放电过程中减小,其原因是Ti3SiC2的存在使电子和锂离子在活性颗粒间的扩散速率得到提高,从而使电荷在电极上的积累速率减小。因此,Ti3SiC2改性减小了充放电过程中的极化,缓解了容量衰减[3]。倍率增加,相比于T0样品,T3、T4和T5样品容量明显更高。

图1 室温下T0、T3、T4和T5样品在0.2 C(a)、1 C(b)、5 C(c)和10 C(d)下的首次充放电曲线
图2是在0.1 C、0.2 C、0.5 C、1 C、2 C、5 C和10 C倍率下对T0、T3、T4和T5样品分别进行了10次充放电循环得到的倍率循环性能曲线。由Ti3SiC2包覆量的改变对电池倍率性能和循环性能的影响做进一步分析。图2显示,第11次循环之前,在0.2 C下,各样品的容量保留率区别不明显。随着倍率逐渐升高,Ti3SiC2和碳包覆复合改性的Li3V2(PO4)3样品T3、T4和T5有更好的容量保留率,这一结果和首次充放电性能一致。尤其是在第60次循环后,T0样品容量保留只有24%,而T4样品仍然保有65%的容量。从0.1 C循环到10 C后,再在0.2 C下充放电时,T4样品容量保留率为91%,仍然有容量137mAh g-1,而T0容量保留率为72%,只剩容量83mAh g-1。上述结果证明,Ti3SiC2改性可以显著提升Li3V2(PO4)3/C倍率循环性能,Ti3SiC2偶合C改性的Li3V2(PO4)3正极材料具有优良的结构稳定性和稳定的循环性能。其主要原因是C和Ti3SiC2偶合改性所形成的新材料微观结构,Ti3SiC2的高韧力学性能够减小活性颗粒的循环应力,使因循环应力引起的材料活性颗粒内应力变化减小,从而提高正极寿命和循环性能,同时新的微观结构有利于阻止活性物质颗粒和电解液的直接接触,缓解电解液的侵蚀溶解V元素。另外,Ti3SiC2和碳包覆复合改性改变了材料的导电网络活性物质颗粒接触模式,为点-面接触模式,同时Ti3SiC2能够补充碳包覆不完整的导电网络使材料导电网络电子通道增加,电子电导提高。
Ti3SiC2偶合C改性的Li3V2(PO4)3正极材料优异的充放电性能,虽然在低倍率下效果不明显,但随着倍率逐渐升高,改性效果越来越明显。这主要是Ti3SiC2的存在同时提高了电子电导和锂离子扩散。研究表明[4],在充放电时,电极上活性颗粒发生电化学反应,反应方向从颗粒表面向颗粒中心,随着时间推移,反应逐步向颗粒内部递进,颗粒中心部残余的未反应部分导致了容量的损失。电解液提供给电化学反应所需要的离子和电子,参加反应的离子和电子从电解液扩散到颗粒间空隙,再向颗粒内部扩散,最后到达颗粒内反应界面。随着电化学反应由颗粒外向内进行,反应面减小,反应速率降低,导致离子和电子浓度梯度减小,离子和电子的扩散速度变慢,进一步导致电化学反应速率降低。当倍率一定时,若颗粒内部的电化学反应速率不能满足设定的电流,在外电场的推动下离子和电子更倾向于从其他活性颗粒表面开始扩散。这时,由于离子和电子供给不足,使活性颗粒内部的电化学反应停止,会导致在颗粒内形成未反应即未被利用的“核”,引起容量的不可逆损失。而随着倍率升高,测试过程中的电流增大,离子和电子在颗粒内部扩散的深度减小,使得颗粒内未被利用的活性物质“核”增大,导致材料的容量随着倍率增加而减小。Ti3SiC2的存在减小了未被利用的这个“核”。

图2 室温下T0、T3、T4和T5样品在不同充放电倍率0.1-10 C下的循环性能
为了研究所有样品组装的电池在室温同一倍率下的循环稳定性,图3是在室温、10 C下T0、T3、T4和T5样品的循环性能测试图,显示了Ti3SiC2改性对电极的结构稳定性和循环性能有优异的效果。即便在200次循环后,Ti3SiC2改性的样品衰减容量也不明显。在10 C下循环200次后,T4样品容量仍然保留100mAh g-1,是T0样品的10倍。

图3 室温下T0、T3、T4和T5样品在10 C下的循环性能
4.2 0℃充放电性能分析
图4是电压窗口为3.0-4.8 V,T0-T5样品分别在不同倍率下的首次充放电曲线与室温首次充放电曲线比较,比较曲线形状、走势和变化规律,低温0℃首次充放电曲线与室温首次充放电曲线相同,T3、T4和T5样品的容量随着倍率增加较T0样品容量更高。其原因与室温下相同,主要是适量Ti3SiC2能够促进锂离子和电子在活性物质颗粒内的扩散,加大了活性颗粒的有效利用,使容量损失降低。
比较相同倍率下容量大小,同一样品在0℃低温时的容量明显降低。这是因为根据热力学原理,其一,离子扩散速率是温度的函数,温度越低,离子扩散速率越低。在相同倍率下,低温时较室温下,离子和电子在活性物质颗粒内扩散得较浅,活性物质颗粒内未被利用的“核”较大。其二,电化学反应速率也是温度的函数,随温度降低而减小。在上述两个因素的同时作用下,低温的放电比容量比相同条件下的室温比容量要小[5,6]。
表1是0℃下 T0、T3、T4和T5样品在0.2和10 C倍率下比较容量比较,各样品的比容量在0.2C下差别不大,T4样品都有最高的放电比容量,比样品T0高出6mAh g-1。在10 C下,样品T0的容量和其他样品的差别明显,T4样品同样有最高的放电比容量72mAh g-1,比样品T0高出48mAh g-1。结果显示,0℃下T0、T3、T4和T5样品的容量变化规律与室温一致。

图4 低温0 ℃下T0、T3、T4和T5样品在0.2 C (a)、1 C(b)、5 C (c)和10 C (d)倍率下的首次充放电曲线

样品T0T3T4T5T0T3T4T5倍率0.2C10C比容量/mAhg-113714014313826607263与T0比容量差值/mAhg-103610344837
图5(a)是低温0℃,T0、T3、T4和T5样品在不同倍率下充放电10个循环的倍率循环性能曲线。结果与室温相似,在0.2 C下,第11次循环之前,四个样品的容量保留率没有明显区别。随着倍率逐渐升高,Ti3SiC2改性的Li3V2(PO4)3/C正极材料样品表现出更好的容量保留率。T4样品在第60次循环后仍然保有96%容量保留率。表2样品是从0.1 C循环到5 C后,再在0.2 C下充放电时的容量保留比较表。

表2 样品从0.1 C循环到5 C后,再在0.2 C下充放电时的容量保留比较表
表2的数值说明Ti3SiC2改性在低温下也能很好地改善循环性能[7]。其中,T4的循环性能最好。
图5(b)是0℃下样品在5C倍率下循环50次的稳定性能测试结果。结果显示,T0、T3、T4和T5样品在5C倍率下循环50次的容量保留率分别为78%、89%、97%和90%。T4样品容量仍然保留110mAh g-1,较T0的58mAh g-1高出52mAh g-1。与室温下的结果相一致,低温下Ti3SiC2仍然可以改善Li3V2(PO4)3/C的结构稳定性和循环性能。T4样品在0℃下的电化学性能最好,相比于其他样品该样品首次充放电、倍率性能和循环性能测试结果最优。这些结果说明,Ti3SiC2改性确实较为有效[1,8]。

图5 0 ℃下(a)T0、T3、T4和T5样品在0.1-5 C下的循环性能和(b)在5 C下的循环性能
4.3 -20℃充放电性能分析
图6为低温-20℃下,电压窗口3.0-4.8V,样品在0.2C和1C倍率下首次充放电曲线,比较曲线形状、走势和变化规律,低温-20℃首次充放电曲线的与室温和0 ℃首次充放电曲线相似。T3、T4和T5样品的容量,随着倍率增加较T0样品容量更高。其原因与0℃相同,并且-20℃下测得的容量在相同倍率下最低。表3是-20℃下T0、T3、T4和T5样品在0.2C和1 C倍率下容量比较。各样品的比容量在0.2C下差别不大,T4样品具有最高的放电比容量,比样品T0高出9mAh g-1。在1C下,样品T0的容量和其他样品的差别明显,T4样品同样有最高的放电比容量102mAh g-1,比样品T0高出43mAh g-1。结果显示,-20℃下T0、T3、T4和T5样品的容量变化规律与室温和0℃相似。低倍率下各样品在-20℃的容量差别依然不大,然而随着倍率增加,容量差别越来越明显[7,9]。表3是-20℃下T0、T3、T4和T5样品在0.2C和1C倍率下首次充放容量比较,显示同样的结果。
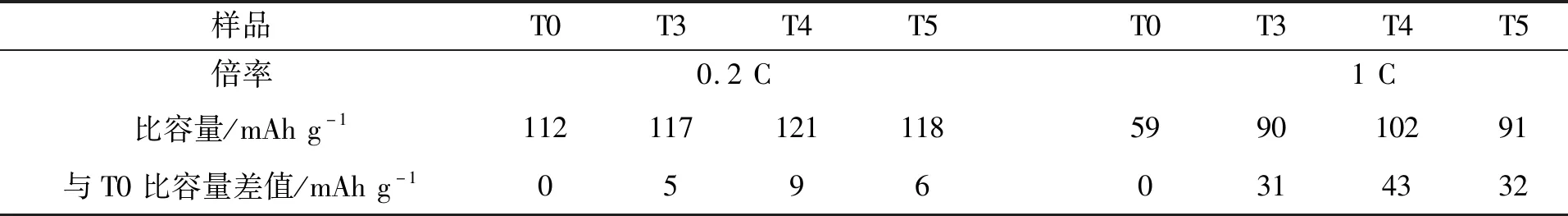
表3 -20℃下T0、T3、T4和T5样品在0.2C和1 C倍率下首次充放容量比较
上述结果说明Ti3SiC2的改性在-20℃一样有效。对比室温、0℃和-20℃性能结果,T4样品在所有测试温度下的放电容量均最高、循环性能均最好。

图6 低温-20 ℃下T0、T3、T4和T5样品在0.2 C(c)、1 C(d) 倍率下的首次充放电曲线
图7(a)是低温-20℃,T0、T3、T4和T5样品在不同倍率下充放电10个循环的倍率循环性能曲线。结果与室温和0℃结果相似,在0.2 C下,四个样品的容量保留率没有明显区别。随着倍率逐渐升高,Ti3SiC2改性的Li3V2(PO4)3/C正极材料样品表现出更好的容量保留率。对于T0,5 C下的容量几乎为0,而Ti3SiC2改性的T4样品仍有一定的容量保留31mAh g-1。当从0.1C循环到5C后,再在0.2C下充放电时,T4仍然保有第10次循环后容量117mAh g-1的94%,T4样品的容量保留率最高。表4是-20℃下样品从0.1C循环到5C后,再在0.2C下充放电10个循环时样品的容量保留比较表。结果显示,Ti3SiC2改性的样品有很好的低温循环可逆性。

表4 -20 ℃下样品从0.1 C循环到5 C后,再在0.2 C下充放电10个循环时的容量保留比较
图7(b)是-20℃,2C倍率下循环50次样品的循环稳定性测试结果。在2C倍率下循环50次后的T0、T3、T4和T5样品放电比容量分别为9mAh g-1、74mAh g-1、88mAh g-1、75mAh g-1。结果显示,在2C下在50次循环后,Ti3SiC2改性的样品容量也没有明显的减小。T4样品仍然保有80mAh g-1的容量,而T0的容量几乎为零。

图7 -20 ℃下T0、T3、T4和T5样品在0.1-5 C下的循环性能(a)及在2 C下循环图(b)
5 结语
通过室温、0℃和-20℃下T0、T3、T4和T5样品充放电性能分析、研究、比较,表明:Ti3SiC2和C偶合改性是提高Li3V2(PO4)3低温充放电性能的一种有效方法,Ti3SiC2偶合C能够改善Li3V2(PO4)3充放电性能,包括稳定性和循环性能,充放电倍率越大,改性效果越加显著;温度越低,充放电循环性能越差;容量越小,循环性能越差;适量的Ti3SiC2偶合可以同时提高材料的锂离子扩散系数和电子电导。在3.0-4.8V电压窗口下,Ti3SiC2偶合量为4%(质量分数)时,材料具有最好的充放电性能,相比之前报道过的其他复合改性手段,Ti3SiC2改性效果优异。

