响应面法优化制备牡蛎短肽工艺
柏昌旺,章超桦,2,3,4,5,林海生,2,3,4,5,秦小明,2,3,4,5,曹文红,2,3,4,5,杨雨柔
响应面法优化制备牡蛎短肽工艺
柏昌旺1,章超桦1,2,3,4,5,林海生1,2,3,4,5,秦小明1,2,3,4,5,曹文红1,2,3,4,5,杨雨柔1
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东海洋大学深圳研究院,广东 深圳 518120;3. 广东省水产品加工与安全重点实验室// 4. 广东普通高等学校水产品深加工重点实验室// 5.国家贝类加工技术研发分中心(湛江),广东 湛江 524088)
探究前处理方式对酶解效果的影响,优化牡蛎短肽制备工艺。在确定高效酶种类和前处理方式的基础上,以氮回收率、短肽得率为指标对酶解时间、料液比、酶解温度、加酶量进行单因素试验,再利用响应面设计建立数学模型,以短肽得率为响应值,进行4因素3水平的响应面分析。牡蛎经80 ℃热处理10 min后使用动物蛋白酶的酶解效果最佳。响应面结果显示,最佳酶解工艺为料液比(g/mL)1∶3.9、温度47 ℃、加酶量3 300 U/g、自然pH(6.5)、酶解3 h,其短肽得率为(58.53 ± 1.20)%,比原酶解工艺提高24.8%。
牡蛎;短肽;可控酶解;响应面法
牡蛎俗称生蚝、海蛎子,因肉质爽滑,味道鲜美,营养丰富,被附以“根之源”“海洋牛奶”等美誉[1]。近年来,我国牡蛎行业产量呈现逐年上升的趋势,2018年养殖量达513.9万t[2]。但是目前国内牡蛎的应用仍以直接食用或制成调味料为主,针对其精深加工技术与新型产品开发的进展较为缓慢,因此,推动牡蛎深加工及综合利用对其产业的可持续发展具有十分重要的意义[3]。一般来说,3 ~ 9个氨基酸聚合而成的肽称为短肽,其相对分子质量范围为180 ~ 1 000,介于氨基酸与蛋白质之间,具有吸收好、代谢快、活性高等优点,是目前国内外研究开发的热点[4]。牡蛎短肽具有抗氧化、抗肿瘤、降血压、抗凝血、抗炎症、改善学习记忆[5-11]等多种生物活性。但现阶段牡蛎肽的传统制备工艺普遍存在短肽得率低,酶解后的超滤和分离纯化工艺复杂、富集困难等问题[12],直接阻碍了其产业化发展。目前急需一种高效制备牡蛎短肽的工艺。
蛋白质的可控酶解是指通过控制水解条件、水解度的方法而获得目标分子量分布的水解产物[13],但现阶段可控酶解技术只应用于提高功能物质的活性,对如何控制、富集目标分子量产物研究尚未见有报道。本研究利用可控酶解技术水解牡蛎,研究不同蛋白酶、前处理方式对酶解效果的影响,在单因素的基础上采用响应面法确定酶解牡蛎的最佳工艺,为牡蛎可控酶解短肽的制备工艺及规模化生产提供依据。
1 材料与方法
1.1 材料与试剂
香港牡蛎(),体质量(20.56 ± 1.34)g,购于湛江市东风市场;菠萝蛋白酶(1.6×104U/g)、木瓜蛋白酶(7.0×104U/g)、动物蛋白酶(6.8×104U/g)、风味蛋白酶(7.0×104U/g)、中性蛋白酶(6.3×104U/g),南宁庞博生物工程有限公司;Protamex(6.3×104U/g)、Flavourzyme(5.9×104U/g),诺维信生物技术有限公司;还原型谷胱甘肽(GSH),上海源叶生物有限公司;混合氨基酸标准溶液,和光纯药工业株式会社;氢氧化钠、甲醛等分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
PHS-25雷磁pH计,上海康仪仪器有限公司;UV-8000 紫外分光光度计,上海元析仪器有限公司;VAPODEST450 全自动凯氏定氮仪,德国Gerhardt公司;L-8900全自动氨基酸分析仪,日立高新技术公司;SHZ-水浴恒温震荡器,上海博迅医疗生物仪器股份有限公司;冷阱CT-6、ZLS-1型真空离心浓缩仪,湖南赫西仪器装备有限公司。
1.3 实验方法
1.3.1 牡蛎酶解液的制备 牡蛎全肉经流水解冻后打浆均匀,按料液质量体积比(g/mL,下同)1∶3加水,调各酶最适pH值,8 000 r/min匀浆2 min,加酶酶解后100 ℃水浴灭酶10 min,静置冷却至室温后以8 000 r/min离心15 min,最后四层纱布过滤获取上清液,在-20 ℃下保存备用。
1.3.2 高效蛋白酶的筛选 选用Flavourzyme、Protamex、动物蛋白酶、中性蛋白酶、风味蛋白酶、木瓜蛋白酶、菠萝蛋白酶,在各自最适条件下进行酶解(表1),以水解度、氮N回收率、短肽质量浓度、短肽得率为指标综合评价酶解效果。
表1 各酶酶解条件

Table 1 Enzymatic conditions of each enzyme
1.3.3 前处理对酶解效果的影响 称取牡蛎浆液40 g放入250 mL锥形瓶中,按料液比1∶3加蒸馏水后均质,分别采用热处理(60、70、80、90、100 ℃下水浴保温10 min)和室温25 ℃下超声波处理(功率500 W处理10、15、20 min,)两种方式对牡蛎匀浆液进行预处理,冷却至室温测pH值后加入动物蛋白酶酶解4 h,最后100 ℃水浴灭酶10 min离心取上清液,-20 ℃冷冻保存备用。
1.3.4 单因素试验 在筛选出最佳蛋白酶和前处理方式的基础上,探究酶解时间、料液比、温度、加酶量对短肽得率和N回收率的影响。酶解时间:在加酶量为3 000 U/g、温度50 ℃、料液比1∶3、自然pH条件下分别酶解1、2、3、4、5 h。料液比:在加酶量为3 000 U/g、温度50 ℃、酶解时间3 h、自然pH条件下料液比为1∶2、1∶3、1∶4、1∶5、1∶6。酶解温度:在加酶量为3 000 U/g、料液比1∶4,酶解时间3 h、自然pH条件下酶解温度为40、45、50、55、60 ℃。加酶量:在酶解温度45 ℃、料液比1∶4、酶解时间3 h、自然pH下加酶量分别为1 000、2 000、3 000、4 000、5 000 U/g。
1.3.5 响应面试验设计 在单因素试验的基础上,利用Box-Behnken实验设计原理,以酶解时间()、料液比()、酶解温度()、加酶量()四个因素为自变量,短肽得率为响应值,采用软件Design-Expert V8.0.6.1设计四因素三水平的响应面分析试验优化酶解条件,相应因素与水平设计如表2所示。
表2 响应面试验因素与水平

Table 2 Response surface test factors and levels
1.3.6 指标测定
1.3.6.1 水解度的测定 原料中总氮量和非蛋白氮量采用凯氏定氮法[14],水解液中氨基态氮量和原料中游离的氨基态氮量采用中性甲醛电位滴定法[15]。水解度(DH)计算公式如下:
1.3.6.2 蛋白质回收率的测定 蛋白质回收率= 上清液总蛋白质含量/ 底物总蛋白质含量。
1.3.6.3 短肽质量浓度的测定 参考徐倩等[16]的方法略有改动。标准曲线的绘制:首先配制10 mg/mL的GSH溶液,然后将其稀释成0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg/mL的10种不同浓度的标准溶液。取2 mL标准溶液与3 mL的双缩脲试剂混匀,于漩涡混合仪上混合均匀,60 ℃水浴10 min后于540 nm 下测定光密度值。以标准肽浓度为横坐标(mg/mL),各浓度相应的吸光值为纵坐标,制作一定浓度范围内的标准曲线。
样品测定:取牡蛎酶解液4 mL,加入4 mL体积分数10%的三氯乙酸(TCA)溶液,在旋涡混合仪上混合均匀后静置10 min,然后4 000 r/min离心15 min,取上清液稀释倍后,取2 mL加入双缩脲试剂3 mL [(样液)∶(双缩脲试剂) =2∶3],于漩涡混合仪上混合均匀,60 ℃水浴10 min取上清液于540 nm下测定光密度值,对照标准曲线求得样品溶液中的短肽质量浓度(mg/mL)。
1.3.6.4 短肽得率的测定[17]
短肽得率= (·)/,
式中:为样品溶液中短肽质量浓度(mg/mL);为10% TCA总体积(mL);为样品蛋白质质量(g)。
1.3.7 数据分析 采用Design Expert 8.0.6.1软件对响应面数据进行分析,EXCEL 2016、Origin 9.0进行数据分析,SPSS 23进行数据显著性分析。
2 结果与分析
2.1 不同蛋白酶酶解效果分析
图1A所示,风味蛋白酶的水解度最高为(41.86 ± 3.62)%,动物蛋白酶略低,为(41.37 ± 1.19)%,两者无显著差异(> 0.05)。中性蛋白酶的N回收率最高为(84.12±2.18)%,动物蛋白酶次之为(77.53 ± 0.49)%。由图1B显示结果可知,动物蛋白酶的短肽质量浓度和短肽得率均显著高于其他六种蛋白酶(< 0.01),分别为(15.68 ± 0.67)mg/mL,34.79%。不同蛋白酶的酶切位点千差万别导致酶解效果的大不相同,动物蛋白酶本身是一种复合酶,它既是内切酶又是外切酶,具有多种酶切位点,故其酶解产物各项指标利用率高。因此,选取动物蛋白酶为酶解牡蛎的高效蛋白酶,进行下一步实验。

凡有一个标记相同字母即为差异不具统计学意义(> 0.05)
The same letter means no statistically significant difference (>0.05)
图1 不同蛋白酶之间的酶解效果比较
Fig.1 Comparison of enzymatic hydrolysis between different proteases
2.2 不同前处理对酶解效果的影响
由图2A可知,热处理10 min后的动物蛋白酶酶解产物水解度和N回收率均低于未处理,且随着温度升高,牡蛎酶解产物的水解度和N回收率逐步降低。这可能是因为加热温度过高或时间过长,都会使已暴露出来的S—H氧化生成S—S或疏水相互作用导致致密的网状结构形成,导致众多酶切位点反而被包埋[18]。郭玉华等研究显示热处理温度越高,牡蛎酶解产物的水解度越低[18];林海生等研究表明热处理组水解度均低于未处理组[19]。本研究结果与其结论相一致。图2A显示,酶解产物在500 W条件下超声10、15、20 min后的水解度和N回收率均低于未处理组。这可能是500 W超声波过强且超声波过程中产热导致牡蛎蛋白质结构被破坏,致使蛋白酶酶解效率降低。这与郭玉华的研究结果相一致[19]。
由图2B结果所示,超声波组的短肽质量浓度、短肽得率均低于未处理组。热处理组的两项指标在60~80℃时随温度增长呈现明显的上升趋势,在80℃时短肽得率达到最高,为(43.25 ± 0.56)%,之后增长趋势较为平缓,90 ℃时甚至略有下降。100 ℃时的短肽质量浓度最高,为(21.06 ± 0.27)mg/mL,与80 ℃的短肽质量浓度(20.79 ± 0.27)mg/mL无显著性差异(>0.05)。温度升高使得短肽含量升高,可能是因为热处理虽导致部分酶切位点被包埋,使酶解产物体系中水解度和N回收率显著下降,但与未处理相比,热处理使更多隐藏的内切位点暴露,蛋白酶得以作用于肽链内部,从肽链中间切断,迅速降低蛋白质分子量,使短肽得率上升。这说明热处理对短肽的生成是个有效推进的过程。综合评定,选择将80 ℃热处理10 min后的牡蛎酶解液进行下一步实验。
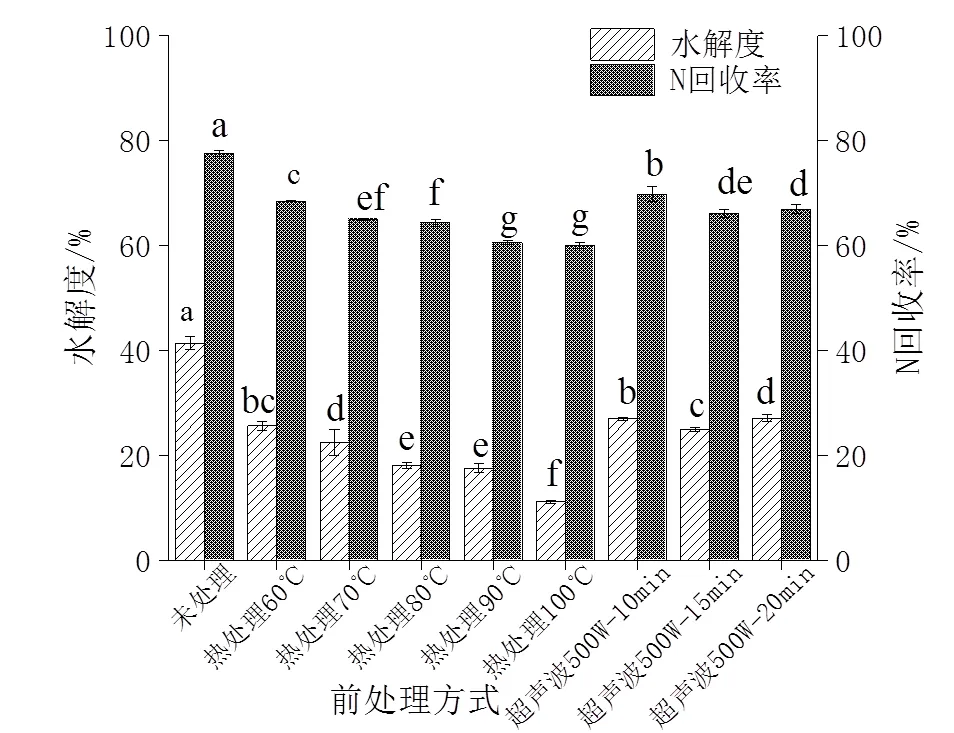
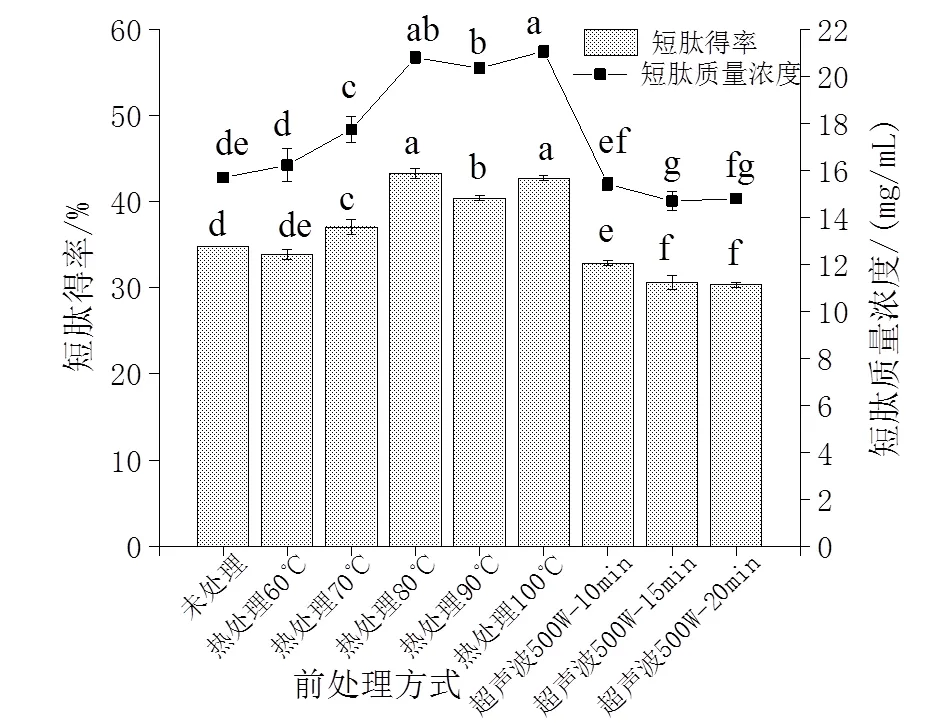
凡有一个标记相同字母即为差异不具统计学意义(> 0.05)
The same letter means no statistically significant difference (>0.05)
图2 不同前处理方式对酶解效果的影响
Fig. 2 Effect of different pretreatment methods on enzymatic hydrolysis
2.3 单因素试验
2.3.1 酶解时间的确定 由图3所示,随着酶解时间的增长,N回收率逐步增加,在3 h后无显著性变化(>0.05)。短肽得率先上升后下降,3 h时有最高值,这主要是因为反应初期,底物浓度高,蛋白质迅速被酶解成肽和氨基酸,随着时间的延长,肽被切割成分子量更小的氨基酸导致短肽含量的下降。因此,酶解时间选择3 h为宜。
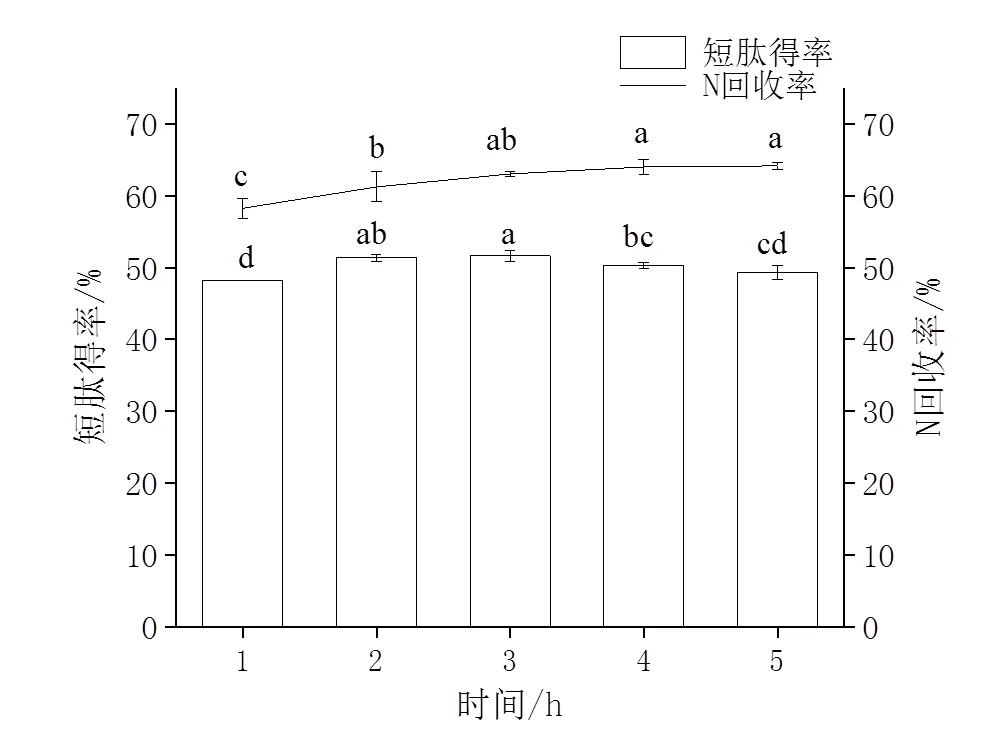
图3 酶解时间对短肽得率和N回收率的影响
2.3.2 料液比的确定 由图4可知,随着料液比增加,短肽得率和N回收率呈现先增大后减小的趋势,在1∶4时出现峰值。这是因为一般情况下作为溶质的底物蛋白质浓度过高,会减低分子间的扩散,导致酶与底物接触面积减少,对酶解产生抑制作用。此后当料液比增加到一定程度时会降低底物浓度,减少酶与底物接触几率,使酶解作用减弱[20]。因此,料液比选择1∶4为宜。
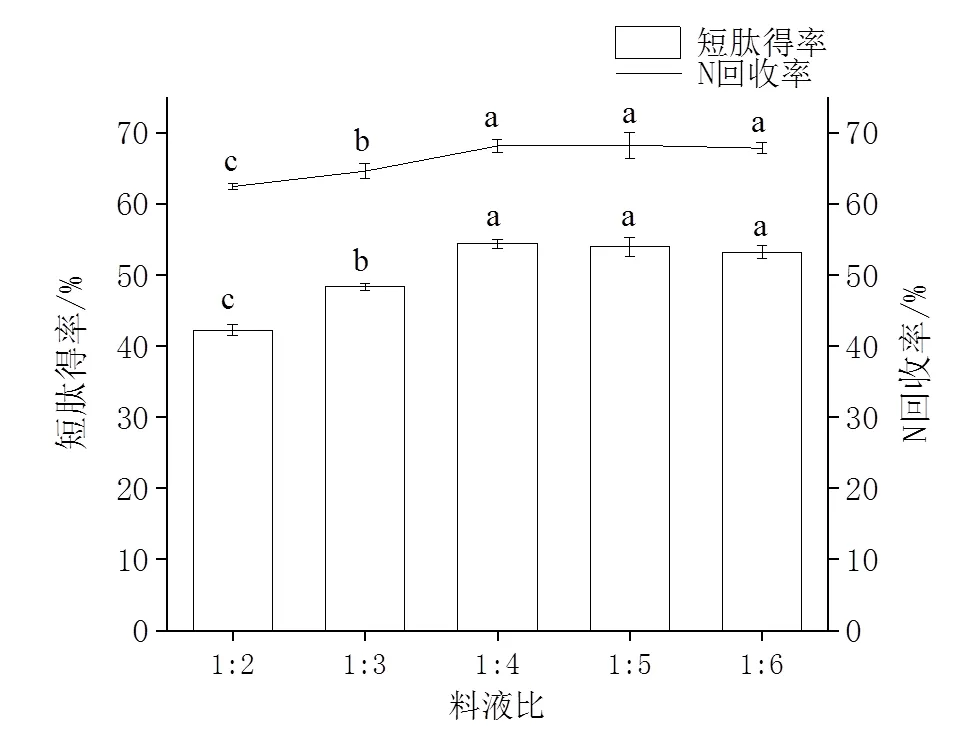
图4 料液比对短肽得率和N回收率的影响
2.3.3 酶解温度的确定 由图5可知,随着温度的升高,短肽得率和N回收率先升高后下降,45 ℃时出现峰值,且显著高于(<0.01)其他温度下的酶解效果。这是因为在一定温度范围内,酶活力会随着温度上升而升高;最适温度时,酶的催化反应速率最快;当温度过高时,酶蛋白会逐步发生变性作用,影响酶的催化活力导致酶解效果降低。因此,酶解温度选择45 ℃为宜。

图5 酶解温度对短肽得率和N回收率的影响
2.3.4 加酶量的确定 由图6所示,加酶量在1 000 ~ 3 000 U/g时,短肽得率与N回收率升高迅速。酶量再增加时,短肽得率有所降低,分析可能是由于酶与底物反应过于充分,导致部分短肽被酶解成氨基酸。N回收率在加酶量为4 000 U/g时略有降低,但加酶量5 000 U/g时仍有所提高,但与3 000 U/g无显著性差异(> 0.05)。考虑到生产成本,选择加酶量3 000 U/g最为适宜。
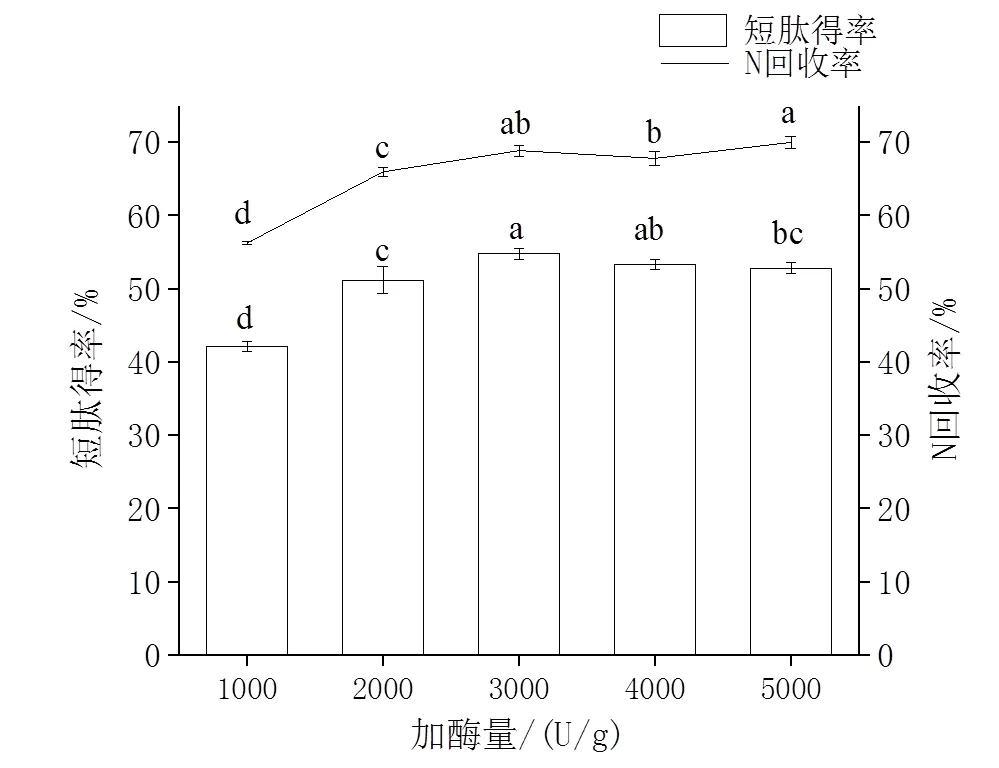
图6 加酶量对短肽得率和N回收率的影响
2.4 响应面优化试验
2.4.1 响应面试验结果与分析 根据单因素实验结果,设计以短肽得率为响应值,酶解时间()、料液比()、酶解温度()、加酶量()四个因素为自变量的响应面试验方案,试验方案和结果如表3所示。

表3 响应面试验方案与结果
采用Design Expert 8.0.6.1软件对响应面模型进行分析,得出短肽得率()与各因素变量的二次多项回归方程为:= 57.48 + 0.46- 0.26+ 3.43+ 1.69- 0.035- 0.073- 0.17+ 0.16+ 0.16- 0.40- 2.082- 0.832- 4.582- 2.582。对方程进行显著性检验方差分析及可信度分析,结果分别如表4和表5所示。
由表4可知,短肽得率回归模型< 0.000 1,说明该模型极显著。一次项、,二次项2、2、2呈现为极显著,2为显著。由值可以看出,在4个因素中,对短肽得率影响最大的因素是酶解温度(),其次分别是加酶量()、酶解时间(),影响最小的是料液比(),其中,失拟项= 0.074 8 > 0.05,为不显著,说明方程模拟较好,可以很好的分析数据。由表5可知,模型拟合系数R= 0.991 2,模型校正拟合系数2adj= 0.959 1,表示该模型能够解释短肽得率95.91%的变化来自于所选变量。同时变异系数为1.35%,说明模型置信度高,可以准确预测和分析四个变量对酶解制备牡蛎短肽得率高低的影响。

表4 二次回归方程的显著性检验及方差分析
注:*表示差异显著(< 0.05);**表示差异极显著(< 0.01)

表5 二次回归方程的可信度分析
2.4.2 响应面3D模型分析 由图7可知,a ~ f的三维图形均呈现凸面且开口向下,响应面中心点处于变量范围内,说明短肽得率在两因素交互作用中有最大值。图7b与图7f中,随着因素的改变,短肽得率呈现先增加后减低的趋势,且曲面相对较为陡峭,等高线密集成椭圆形,但图形中的时间-温度、加酶量-温度的交互作用不显著。其他图形的变化趋势与之相似,交互作用均不显著。

图7 时间、料液比、加酶量、温度四因素两两交互作用三维分析
2.4.3 验证实验 以短肽得率为响应值,利用软件分析获得最佳酶解工艺条件为料液比1∶3.9,酶解温度46.78 ℃,加酶量3 296.8 U/g,酶解时间3.04 h,自然pH,此时的短肽得率为58.37%。考虑实际操作的可行性,将工艺条件调整为料液比1∶3.9,酶解温度47 ℃,加酶量3 300 U/g,酶解时间3 h,自然pH,在此条件下进行3次实验的短肽得率为(58.53 ± 1.20)%,与预测值接近且无显著性差异(> 0.05),说明该二次项回归方程能准确预测可控酶解制备牡蛎短肽。且该工艺比传统工艺短肽得率提升24.8%[21]。
3 结论
本实验确定牡蛎匀浆液经80 ℃热处理10 min后加动物蛋白酶为制备牡蛎短肽的高效方法。确定最佳酶解工艺条件,即料液比1∶3.9,酶解温度47 ℃,动物蛋白酶加酶量3 300 U/g,自然pH下酶解时间3 h,此条件下短肽得率达(58.53 ± 1.20)%,比传统工艺的短肽得率提升24.8%。该回归模型可靠,说明利用响应面法能有效优化制备牡蛎短肽的酶解工艺。
[1] 张雪妍, 秦小明, 高加龙, 等. 牡蛎酶解工艺优化及其酶解产物对小鼠睾酮分泌的影响[J]. 广东海洋大学学报, 2019, 39(3): 96-102.
[2] 农业部渔业局. 2019中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2019.
[3] 林海生, 秦小明, 章超桦, 等. 中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J]. 南方水产科学, 2019, 15(2): 110-120.
[4] 唐开永, 周鸿翔, 田娅玲, 等. 低浓度小分子多肽含量测定方法的比较研究[J]. 食品研究与开发, 2018, 39(16): 144-148.
[5] ASHA K K, REMYA KUMARI K R, ASHOK KUMAR K, et al. Sequence Determination of an Antioxidant Peptide Obtained by Enzymatic Hydrolysis of Oyster(Preston)[J]. International Journal of Peptide Research and Therapeutics, 2016, 22(3): 421-433.
[6] WANG Q K, LI W, HE Y H, et al. Novel antioxidative peptides from the protein hydroly-sate of oysters ()[J]. Food Chemistry, 2014, 145: 991-996.
[7] WANG Y K, HE H L, WANG G F, et al. Oyster () Hydrolysates Produced on a Plant Scale Have Antitumor Activity and Immunostimulating Effects in BALB/c Mice[J]. Marine Drugs, 2010, 8(2): 255-268.
[8] DO H J, PARK H J, KIM O J, et al. Angiotensin-converting enzyme inhibitor-y activity of enzymatic hydrolysates of(Oyster)[J]. Journal of Life Science, 2012, 22(2): 220-225.
[9] CHENG S Z, TU M L, CHEN H, et al. Identification and inhibitory activity against α-thrombin of a novel anticoagulant peptide derived from oyster () protein[J]. Food & Function, 2018, 9(12): 6392-6401.
[10] HWANG J W, LEE S J, KIM Y S, et al. Purification and characterization of a novel peptide with inhibitory effects on colitis induced mice by dextran sulfate sodium from enzymatic hydrolysates of[J]. Fish & Shellfish Immunology, 2012, 33(4): 993-999.
[11] 徐成. 牡蛎肉对东莨菪碱诱导学习记忆障碍的改善作用及其活性组分的研究[D]. 湛江:广东海洋大学, 2016.
[12] 李璇, 杜梦霞, 王富龙, 等. 生物活性肽的制备及分离纯化方法研究进展[J]. 食品工业科技, 2017, 38(20): 336-340; 346.
[13] 林伟锋, 赵谋明, 彭志英, 等. 海洋鱼蛋白可控酶解动力学模型的研究[J]. 食品与机械, 2005(3): 10-13.
[14] 中国国家标准化管理委员会. GB 5009.5-2016. 食品中蛋白质的测定方法[S]. 北京: 中国标准出版社, 2016: 1-7.
[15] 王永华. 食品分析[M]. 北京:中国轻工业出版社, 2012.
[16] 徐倩, 戴遥, 赵永慧, 等. 酶法制备鱼降血压肽的工艺优化及其组分分析[J]. 食品工业科技, 2018, 39(20): 151-157; 164.
[17] 孙建忠. 林蛙油小分子肽的制备及其分子量分布研究[D]. 长春: 吉林农业大学, 2008.
[18] 郭玉华, 曾名勇. 牡蛎酶解工艺的研究[J]. 中国海洋药物, 2008(2): 37-41.
[19] 林海生, 曹文红, 章超桦, 等. 牡蛎蛋白酶解物的制备及其抗氧化活性研究[J]. 食品工业科技, 2013, 34(16): 163-168.
[20] 孙瑞坤, 章超桦, 曾少葵, 等. 方格星虫酶解工艺优化及酶解物免疫活性[J]. 广东海洋大学学报, 2018, 38(3): 54-61.
[21] 常格. 牡蛎蛋白酶解产物抗疲劳作用研究及新产品研发[D]. 湛江: 广东海洋大学, 2016.
Optimization of Preparation Process of Oyster Oligopeptides by Response Surface Methodology
BAI Chang-wang1, ZHANG Chao-hua1,2,3,4,5, LIN Hai-sheng1,2.3,4,5,QIN Xiao-ming1,2,3,4,5, CAO Wen-hong1,2,3,4,5,YANG Yu-rou1
(1.,524088,; 2.,18120,;3.// 4.//5.(),520488,)
To explore the effect of pretreatment on enzymatic hydrolysis and optimize the preparation of oyster oligopeptides.Based on the screening of protease and the confirmation of the pretreatment method, the effects of hydrolysis time, solid-liquid ratio, enzymatic temperature, enzyme-to-substrate ratio on the oligopeptides yield and N recovery rate were investigated. Then mathematical models were set up by response surface methodology. With oligopeptides yield as the response values, the four-factor and three-level response surface analysis was set up.The results showed that animal protease was found to be more suitable for the preparation of oligopeptides from oyster with a pretreatment by heating at 80℃for 10 min. The response surface showed the optimal enzymatic hydrolysis which included hydrolysis temperature at 47 ℃, solid to liquid ratio of 1:3.9, enzyme addition amount of 3300 U/g protein and enzymatic hydrolysis for 3 h under natural conditions with unregulated pH(6.5). Under these conditions, the yield of oligopeptides was 58.53%±1.20%, which was 24.82% higher than that of the traditional enzymatic hydrolysis process.
oyster; oligopeptides; controllable enzymatic hydrolysis; response surface analysis
TS254.4
A
1673-9159(2019)06-0085-08
10.3969/j.issn.1673-9159.2019.06.011
2019-08-16
广东省应用型科技研发专项资金项目(2016B020235002);贝类产业技术体系建设专项(CARS-49);广东普通高等学校水产品高值化加工与利用创新团队项目(GDOU2016030503);海洋贝类营养健康食品关键技术及产业化(GDOU2017052606)
柏昌旺(1995—),男,硕士研究生,研究方向为水产品高值化加工与利用。E-mail:1029537824@qq.com
章超桦(1956—),男,教授,博士,研究方向为海洋生物资源综合利用。E-mail:zhangch2@139.com
柏昌旺,章超桦,林海生,等. 响应面法优化制备牡蛎短肽工艺[J]. 广东海洋大学学报,2019,39(6):85-92.
(责任编辑:刘朏)

