马氏珠母贝金黄壳色选育群体植核后差异表达免疫基因筛选
王 哲,王姿曼,郝瑞娟,李俊辉,邓岳文,2
马氏珠母贝金黄壳色选育群体植核后差异表达免疫基因筛选
王 哲1,王姿曼1,郝瑞娟1,李俊辉1,邓岳文1,2
(1. 广东海洋大学水产学院,广东 湛江 524088 2. 广东省珍珠养殖与加工工程技术研究中心,广东 湛江 524088)
筛选()金黄壳色选育群体植核后免疫相关基因与代谢通路。利用转录组对植核前后马氏珠母贝的血细胞进行转录组建库及测序分析。分别获得61.78×106和62.68×106个高质量转录组数据,且映射到参考基因组的平均映射率分别为70.16%和67.82%。与植核前相比,植核后分别有2 925个和3 097个基因显著上调和下调(差异倍数≥2, 校正后≤0.001),其中包括免疫相关基因凝集素、Toll样受体,热休克蛋白等。对差异基因进行GO分类分析,分为基因的分子功能、细胞组分、生物过程3个大类,并细分为11个子类别,其中结合和催化功能的基因较多。KEGG分类分析差异基因,可将基因参与的KEGG代谢通路分为6个分支,细胞过程、环境信息处理、遗传信息处理、人类疾病(仅限动物)、代谢、有机系统。KEGG富集结果显示,差异表达基因显著富集到免疫相关通路胞质DNA感应途径、白细胞跨内皮迁移等免疫通路。
马氏珠母贝;金黄壳色选育群体;转录组;免疫相关基因
马氏珠母贝()是重要的海水育珠贝。在其育珠时需在受体贝体内植入珠核与外套膜小片(供体贝),植入后,外套膜小片与受体贝结缔组织形成珍珠囊并分泌珍珠质形成珍珠[1-2]。研究发现,育珠贝的贝龄、植核季节、术前处理方法、术后处理方法和育珠模式等均影响珍珠产生[3-10]。植核过程是一种移植耐受应激反应[1],对于珍珠的产量和质量有很大影响[11],但相关机制研究相对较少。
随着高通量测序技术的发展,对珍珠贝植核免疫反应组学研究渐增[12-13]。雷倩楠[14]利用RNA-seq技术对马氏珠母贝植核育珠后不同时间血细胞进行转录组分析,发现在植核育珠后第10天差异表达基因最多,不同时期差异表达基因包括溶菌酶、清道夫受体、甘露糖受体等。Wang等[12]利用iTRAQ结合LC-MS/MS技术分析马氏珠母贝植核后0、10、20、30 d的血细胞蛋白,共获得相关蛋白2 702个,其中与免疫相关的差异蛋白包括纤维蛋白溶酶原、干扰素诱导蛋白、肿瘤坏死因子等。祁晓翔等[15]对三角帆蚌()植核后不同时期的外套膜和内脏团进行转录组分析,筛选出58个与钙代谢相关的基因。Wei等[13]对植核后0、48 h的马氏珠母贝血细胞进行转录组分析,发现移植后48 h,血细胞中白细胞介素受体和Toll样受体的表达水平显著增加,诱导珍珠贝免疫应答反应。Wei等[16]对珠母贝()同种异体移植组和异种移植组在0、6、12、24、48、72、96 h血细胞进行转录组分析,鉴定到诸多与氧化还原反应、MAPK信号通路和凋亡相关的基因。通过分析组学数据,发现与植核相关免疫基因及其调控机理[17-18],如田荣荣发现,胆碱可免疫调节基因通过调控NF-κB信号通路参与调控机体的免疫反应等[19]。上述研究为深入了解珍珠贝植核免疫耐受机制提供了丰富的基础资料,但对于不同选育群体免疫耐受机制的研究较少。王哲等[20]研究表明,马氏珠母贝金黄壳色群体在植核后免疫酶活力较佳,且育珠性状优于对照养殖群体;另外,研究发现,马氏珠母贝植核3 d后在血细胞转录水平及血清免疫酶活均出现明显变化[21]。本研究利用转录组测序检测马氏珠母贝金黄壳色选育群体植核前后差异表达的免疫基因,以期为壳色品系培育提供参考。
1 材料与方法
1.1 实验材料
为本课题组选育的金黄壳色第4代群体[22],贝龄1.5龄,壳长5.5 ~ 6.0 cm。植核手术时,每个受体贝植入1粒规格为5.5 mm珠核。以同批次进行术前处理未植核的个体为对照组,植核3 d后的贝体为实验组,以2 mL注射器从贝体闭壳肌抽取血淋巴为样品,以3 500 r/min、4℃条件离心5 min,弃上清,得血细胞,加1 mL Trizol,于液氮中速冻,- 80℃下保存,用于转录组测序分析。每3个个体合为一个样,且每个转录组进行3个平行测定。
1.2 RNA 提取及文库构建
利用Trizol 法对血细胞提取总RNA,利用琼脂糖凝胶电泳及核酸定量仪(NamoDrop 2000, Therino scientific)检测RNA的完整性及纯度。用带有OligodT的磁珠富集有polyA尾巴的mRNA;用DNA探针杂交rRNA去除rRNA,RNaseH选择性消化DNA/RNA杂交链,再用DNaseI消化,去除DNA探针,纯化后得所需RNA。用打断buffer把获得的RNA片段化,用随机的N6引物进行反转录,再合成cDNA二链形成双链DNA。把合成的双链DNA末端补平并5′端磷酸化,3′端形成突出一个“A”的黏末端,再连接一个3′端有凸出“T”的鼓泡状的接头。连接产物通过特异的引物进行PCR扩增。PCR产物热变性成单链,再用一段桥式引物将单链DNA环化,得到单链环状DNA文库。利用BGISEQ-500进行上机测序。
1.3 转录组数据分析
测序所得原始数据称为原始序列读数。利用过滤软件SOAPnuke(v1.5.2)去除包含接头的序列读数,去除未知碱基N含量大于5%序列,去除低质量序列 (定义质量值低于10的碱基占该序列总碱基数的比例大于20%的序列为低质量序列)。过滤后获得干净序列读数。利用 HISAT (v2.0.4) 将干净序列比对到参考基因组序列[23](http://gigadb.org/dataset/ view/id/100240/File_page/11)。使用Bowtie2 (v2.25) 将干净序列比对到参考基因序列,对比对结果使用RSEM (v1.2.12) 计算基因和转录本的表达水平。
1.4 差异表达基因分析
本研究利用DEGseq方法[24]检测差异表达基因(Differentially Expressed Gene,DEG)。定义差异倍数为两倍以上且值≤0.001的基因为显著差异表达基因。根据GO注释及分类,将差异基因进行功能分类,并对值进行FDR (False Discovery Rate) 校正,FDR≤0.01视为显著。根据 KEGG、KEGG PATHWAY注释结果,将差异基因进行KEGG分类及通路富集分类,同时利用R软件(phyper函数)进行富集分析,并对值进行FDR校正,FDR≤0.01的通路视为显著富集。
2 结果
2.1 总RNA质量检测分析
马氏珠母贝金黄壳色群体植核前后3 d时的血细胞检测结果显示,提取的总RNA经Agilent 2000检测,每个样品的浓度均大于200 ng/μL,RIN均大于7.0,检验结果为合格(表1),说明RNA 符合建库要求,可进行转录组测序。
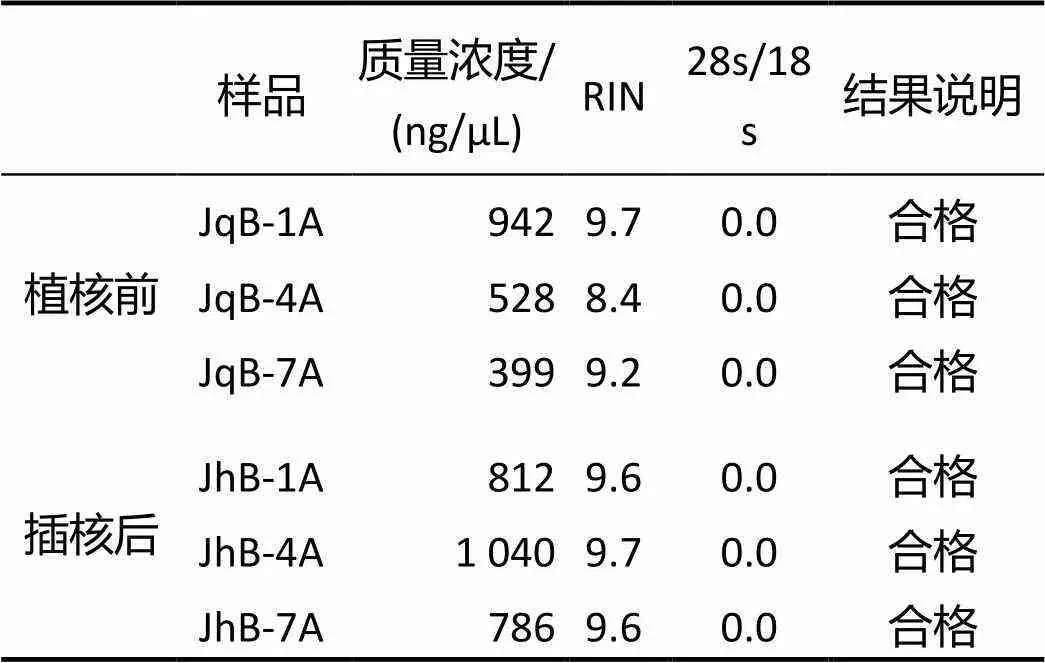
表1 植核前后个体RNA检测结果
2.2 转录组数据整体评价
利用BGISEQ-500平台分别对马氏珠母贝金黄壳色群体植核前后提取的cDNA进行测序,分别获得(61.78±0.608)×106和(62.68±0.025)×106的高质量Reads,并映射到马氏珠母贝基因组(表 2)。转录组的质量分析表明,20分别为98.4%、98.23%,30分别为91.34%、91.13%。基因被映射到马氏珠母贝基因组,植核前转录组平均映射率为70.16%,植核后为67.82%(表2)。因此,转录组结果的测序质量良好,说明随后的转录组分析结果是可靠的。
2.3 差异表达基因分析
比较马氏珠母贝金黄壳色群体植核前后的转录组数据,在两组之间鉴定出6 022个差异表达的基因(差异倍数2,校正后≤0.001)。与植核前转录组相比,金黄壳色群体植核后有2 925个上调基因和3 097个下调基因。其中包括非特异性免疫相关基因凝集素(CTL)、Toll样受体(TLR)、补体分子(C1q)、乙酰胆碱受体(nAchR)、应激蛋白热休克蛋白(HSP70、HSP90)等(表3)。
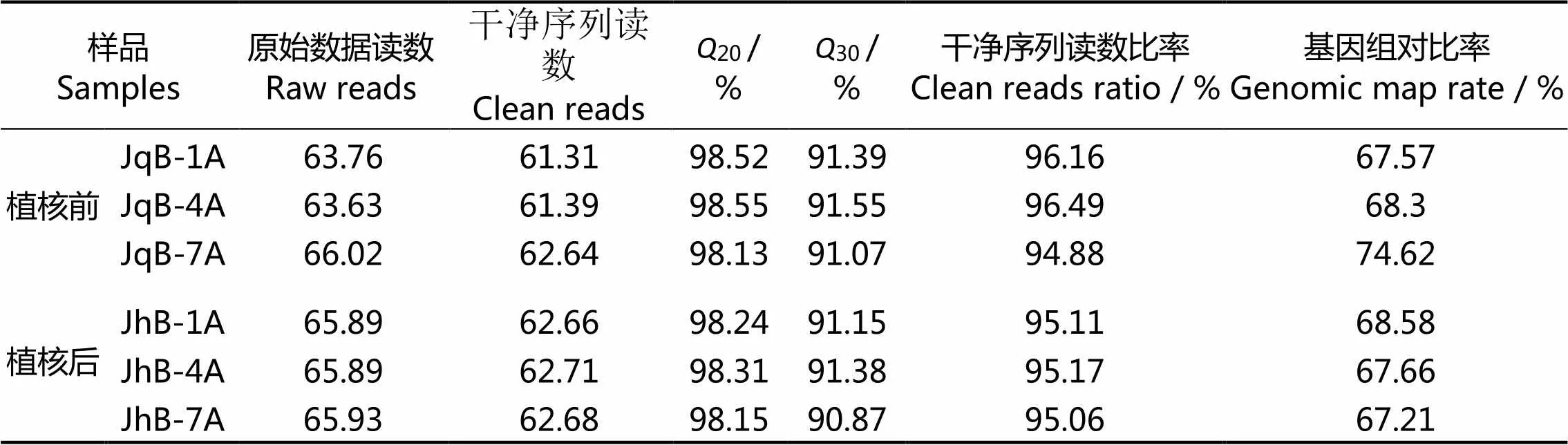
表2 转录组测序数据统计

表3 植核前后转录组差异表达部分免疫相关基因
2.4 差异基因的GO和KEGG注释
差异基因的GO富集分析表明,GO总共有3个分类,分别描述基因的分子功能(molecular function,1 716个)、细胞组分(cellular component,2 616个)、生物过程(biological process,1 913个)。在分子功能类型中包含11个子类别,其中结合(binding,755个)和催化活性(catalytic activity,539个)的基因较多。在细胞组分功能类型中包含16个子类别,细胞(cell,443个)、细胞部分(cell part,430个)、膜(membrane,554个)和膜部分(membrane part,519个)相关基因较多。涉及生物过程功能的差异基因包括25个子类别,主要生命过程是细胞过程(cellular process,542个)、代谢过程(metabolic process,421个)等(图1)。
根据 KEGG 注释结果以及分类,将差异基因进行KEGG通路分类分析。将基因参与的KEGG代谢通路分为6个分支:细胞过程(Cellular processes,1 045个)、环境信息处理(Environmental information processing,1 244个)、遗传信息处理(Genetic information processing,671个)、人类疾病(Human disease,2 844个)(仅限动物)、代谢(Metabolism,1 802个)、有机系统(Organismal systems,2 479个)。在细胞工程中包含4个子类别,其中细胞群落-真核生物(Cellular community-eukaryotes,324个)相关基因较多。环境信息处理包含3个子类别,其中信号传递过程(Signaling molecules and interaction,846个)基因较多。遗传信息处理包括4个子类别,其中折叠、排列和降解过程(Folding, sorting and degradation,221个)的基因较多。疾病包括11个子类别,其中癌症(Cancer: Overview,651个)、病毒感染(infections diseases: Viral,497个)基因较多。代谢过程包括12个子类别,有机系统包括10个子类别,其中免疫系统(immune system,615个)和内分泌系统(Endocrine system,567个)基因较多(图2)。
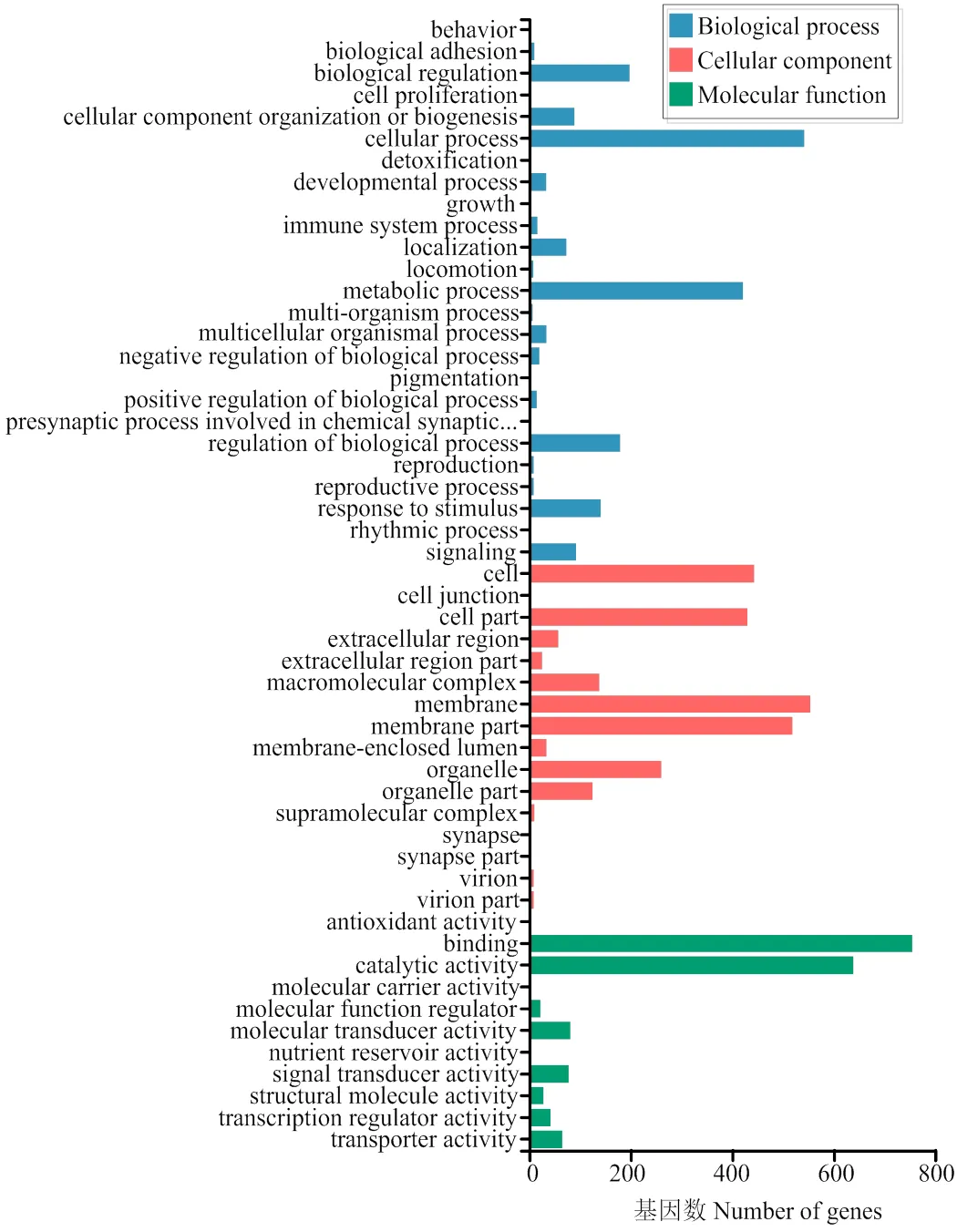
图1 差异基因GO分类
KEGG数据库富集结果由R 软件中的 phyper 函数进行,对金黄壳色群体植核前后差异表达基因进行KEGG通路富集分析,结果显示,差异表达基因富集到了333条特定的代谢通路,其中前20条显著富集的代谢通路如图3,主要包括胞质DNA传感通路(Cytosolic DNA-sensing pathway)、半胱氨酸和甲硫氨酸代谢(Cysteine and methionine metabolism)、碳代谢(Carbon metabolism)和白细胞跨内迁移(Leukocyte transendothelial migration)等通路。其中参与先天性免疫的包括胞质DNA传感通路,白细胞跨内迁移、趋化因子信号通路(Chemokine signaling pathway),Toll 样受体信号通路(Toll-like receptor signaling pathway)等。
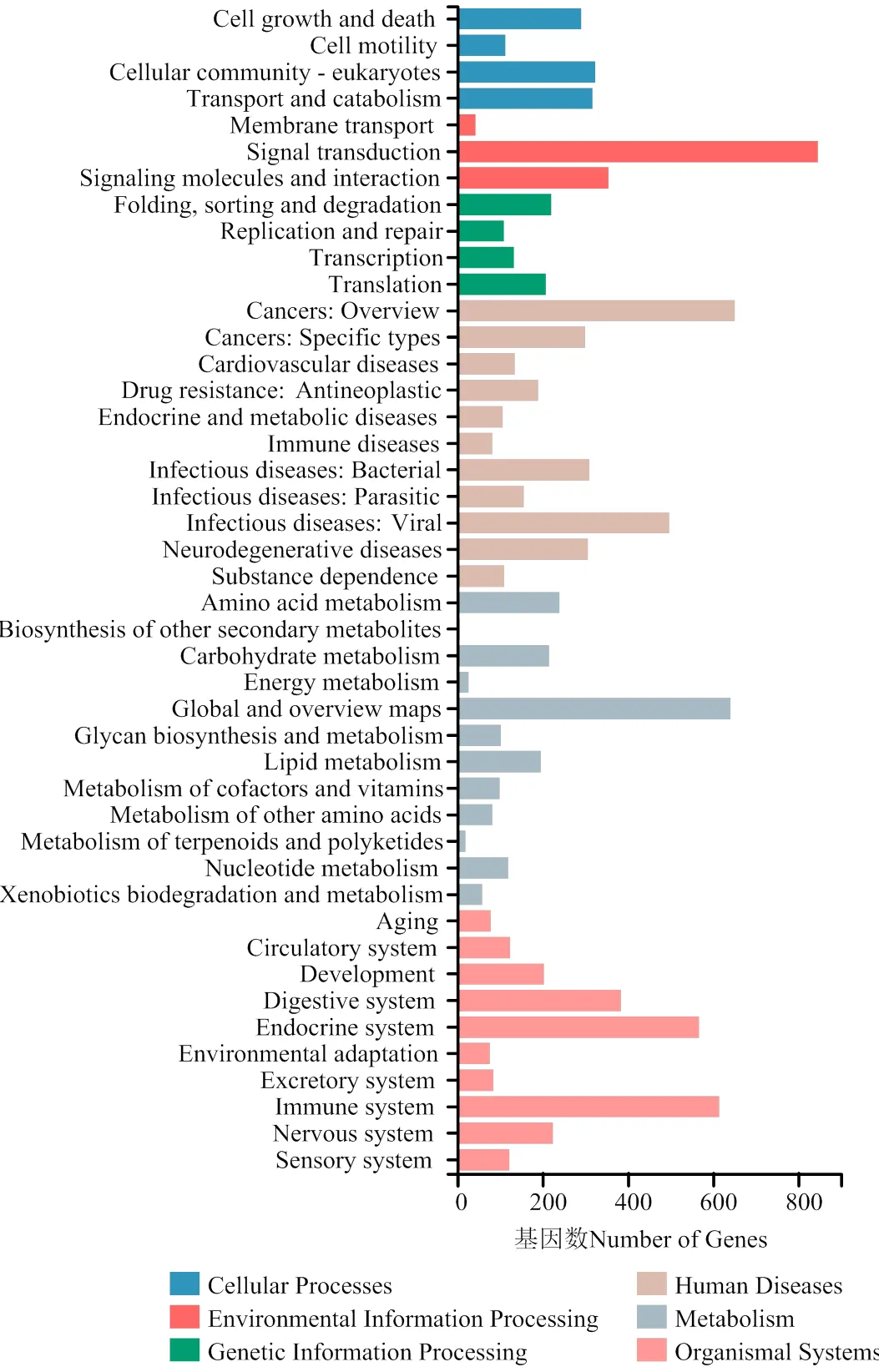
图2 差异基因KEGG Pathway分类结果
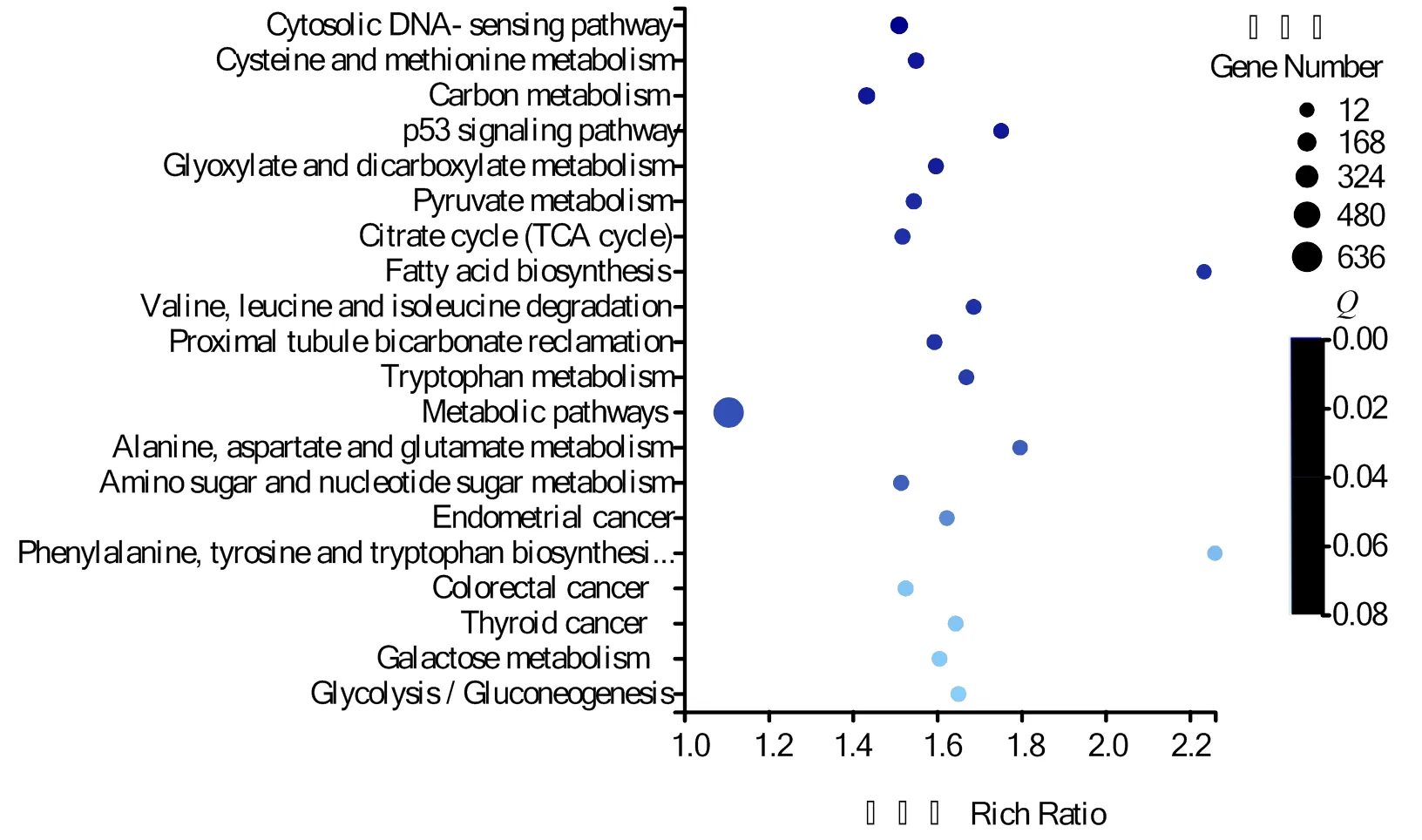
图3 差异基因KEGG Pathway富集分析
3 讨论
在珍珠贝有核珍珠植核育珠过程中,供体贝的外套膜小片及珠核植入受体贝时将引起育珠贝的免疫排斥反应。该过程会导致育珠贝吐核甚至死亡,仅部分育珠贝可适应植核和小片,逐渐形成珍珠囊,分泌珍珠质形成珍珠[1]。因此,研究植核育珠前后基因表达的组学差异,对提高珍珠贝的留核率和降低死亡率有重要意义。本研究比较马氏珠母贝金黄壳色群体植核前后血细胞的转录组变化,从mRNA水平解析植核手术对于育珠贝在基因表达方面的影响。植核前后转录组数据分析的质控结果显示,植核前后转录组的20分别为97.85%和97.78%,30分别为90%和89.77%,说明转录测序质量较好,满足后续的分析要求。
比较马氏珠母贝金黄壳色群体植核前后的转录组数据,鉴定出6 101个差异表达基因:植核后有3 432个基因较植核前显著上调,2 669个基因显著下调,说明受体贝贝体植核时受到强烈刺激,导致机体大量基因发生变化以应对植核手术,这与雷倩楠[14]的结果相似。雷倩楠[14]对马氏珠母贝植核后不同时期血细胞转录组分析发现,与植核前相比,植核后5、10、15、20、60 d分别有3 345、6 846、4 636、4 167、4 716、6 679个差异基因。对植核前后转录组分析获得的差异表达基因,发现许多与非特异性免疫相关基因,包括凝集素、Toll样受体、HSP70蛋白等发生显著变化,说明这些基因在植核后的免疫反应中发挥了作用。
凝集素是一类糖结合蛋白,广泛存在于双壳贝类中,并诱导机体摧毁病原物并激活免疫反应[25-29]。Fisher等[26]研究发现,牡蛎、蛤等贝类体内的凝集素可凝集多种脊椎动物的红细胞。Tunkijjanukij等[30]从马贻贝()血淋巴中得到一种可特异性结合脂多糖(LPS)的凝集素,该凝集素经纯化后对多种海洋细菌均表现出抗菌活性。C-型凝集素(CTL)作为凝集素的一种,在贝类免疫防御中发挥重要作用,主要功能有促进机体对入侵异物的识别和吞噬,凝集细菌和抵抗病毒感染、防止病原蔓延,激活免疫系统等[31]。本研究中,在植核前后的表达有显著性差异(差异倍数大于2,且、均小于0.01),进一步表明该基因对贝体受伤后免疫机能的调控作用。
热休克蛋白参与多种免疫应答及调节细胞凋亡,以应对环境压力[32]。Gao等[35]发现,在感染弧菌()6 h后,海湾扇贝(表达水平达到峰值,48 h后恢复到正常水平。Wei等[16]用大珠母贝()外套膜做小片,对植核后的马氏珠母贝进行转录组测序分析,发现在植核0 ~ 9 h时显著高表达。Wang等[12]用iTRAQ技术比较马氏珠母贝植核后4个时期血细胞蛋白变化,发现热休克蛋白等诸多免疫相关蛋白发生显著变化以应对植核手术。本研究亦发现,金黄壳色群体植核后3 d,和均发生上调,以应对植核手术对贝体的刺激。
TLR4 可参与植核移植反应,且TLR4高表达出现在植核后2 d[17]。研究发现,马氏珠母贝Toll-like 受体基因PmTLR6在植核后5和10 d表达水平无显著性变化,15和20 d表达量呈上升趋势,于30 d达到最大值,约为空白对照组(0 d)的5倍,说明PmTLR6可能在马氏珠母贝免疫防御反应中担任着重要角色[36]。Wei等[13]对植核后不同时期血细胞转录组研究发现,TLR在植核后48 h显著高表达。本研究中,TLR在植核后3 d,多个TLR基因发生上调,参与植核育珠手术后的免疫应答,同时存在一些TLR发生显著下调,因此TLR基因应对植核手术的具体机制仍需进一步研究。
在双壳类中,TLR/NF-κB信号通路负责促进免疫应答的信号转导[37]。TLRs识别配体可激活关键转录因子并与MyD88相互作用,从而释放白细胞介素(ILS)、抗菌肽、溶菌酶和其他抗病原体感染的免疫基因。NFκB通路是一种细胞内信号通路,在双壳类中,MyD88能激活转录因子,从而诱导细菌和病毒感染的急性时相反应并控制促炎特性、效应分子和细胞因子的表达[38-40]。本研究中,植核后NF-κB信号通路被显著富集,并且基因在植核前后差异显著说明TLR/NF-κB信号通路在植核后免疫反应过程中发挥重要作用。该结果与Wei等[13]的转录组分析结果相一致。
4 结语
本研究利用转录组对金黄壳色群体植核前后育珠贝的血细胞进行转录组分析,发现植核后有2 925个基因显著上调,有3 097个基因显著下调,其中包括免疫相关基因凝集素、Toll样受体、热休克蛋白等。对差异基因进行KEGG富集分析发现,免疫相关通路细胞DNA传感途径,白细胞跨内皮迁移等参与金黄壳色群体的植核育珠免疫反应。本研究为壳色育珠提供参考资料。
[1] SOUTHGATE P C, LUCAS J S. The pearl oyster[M]. Netherlands: Elsevier Science, 2008: 77-102.
[2] KISHORE P, SOUTHGATE P C. A detailed description of pearl-sac development in the black-lip pearl oyster(Linnaeus 1758) [J]. Aquaculture Research, 2016, 47(7): 2215-2226.
[3] 尹立鹏, 邓岳文, 杜晓东, 等. 贝龄对马氏珠母贝植核贝生长、成活率和育珠性状的影响[J]. 中国水产科学, 2012, 19(4): 715-720.
[4] 林伟财, 谢绍河, 杜晓东, 等. 影响大珠母贝育珠效果的主要因素分析[J]. 中国农学通报, 2016, 32(32): 29-33.
[5] 符韶, 梁飞龙, 邓岳文. 影响马氏珠母贝植核育珠绩效的关键技术研究[J]. 水产养殖, 2016, 37(7): 45-49.
[6] BLAY C, PLANES S, KY C L. Optimal age of the donor graft tissue in relation to cultured pearl phenotypes in the mollusc,[J]. PLoS One, 2018, 13(6): e0198505.
[7] MCGINTY E L, EVANS B S, TAYLOR J U U, et al. Xenografts and pearl production in two pearl oyster species,and: Effect on pearl quality and a key to understanding genetic contribution[J]. Aquaculture, 2010, 302(18): 175-181.
[8] SHI Y H, WANG H, ZHAN X, et al. The influence of saibo donor and host on the nacre deposits of pearls produced from[J]. Journal of Shellfish Research, 2013, 32(2):271-274.
[9] 周畅, 谢莉萍, 张荣庆. 插核手术对合浦珠母贝免疫水平的影响[J]. 水产学报, 2001, 25(5): 419-423.
[10] 焦钰, 杜晓东, 师尚丽, 等. 珍珠囊发育中马氏珠母贝血清免疫因子的变化规律[J]. 广东海洋大学学报, 2007, 27(4): 21-24.
[11] WEI J F, LIU B S, FAN S G, et al. Serum immune response of pearl oysterto xenografts and allografts[J]. Fish & Shellfish Immunology, 2017, 62: 303-310.
[12] WANG W, LEI Q N, LIANG H Y, et al. Towards a better understanding of allograft-induced stress response in the pearl oyster: Insights from iTRAQ-based comparative proteomic analysis [J]. Fish & Shellfish Immunology, 2017, 62: 247-256.
[13] WEI J F, LIU B S, FAN S G, et al. Differentially expressed immune-related genes in hemocytes of the pearl oysteragainst allograft identified by transcriptome analysis.[J]. Fish & Shellfish Immunology, 2017, 67: 331-345.
[14] 雷倩楠. 马氏珠母贝植核育珠移植耐受免疫相关基因与蛋白质鉴定及分析[D]. 湛江: 广东海洋大学, 2016.
[15] 祁晓翔. 三角帆蚌转录组和数字基因表达谱分析及EF-hand基因的表达研究[D]. 上海: 上海海洋大学, 2015.
[16] WEI J F, FAN S G, LIU B S, et al. Transcriptome analysis of the immune reaction of the pearl oysterto xenograft from[J]. Fish & Shellfish Immunology, 2017, 67: 331-345.
[17] WU Y Y, LIANG H Y, WANG Z X, et al. A novel toll-like receptor from the pearl oyster,, is induced in response to stress[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2017, 214: 19-26.
[18] WU S Z, HUANG X D, LI Q, et al. Interleukin-17 in pearl oyster (): Molecular cloning and functional characterization[J]. Fish & Shellfish Immunology, 2013, 34(5): 1050-1056.
[19] 田荣荣. 马氏珠母贝胆碱能免疫调节系统的初步研究[D]. 湛江: 广东海洋大学, 2016.
[20] 王哲, 杨创业, 李俊辉, 等. 马氏珠母贝金黄壳色选育群体与养殖群体血清免疫酶活力比较[J]. 中国农学通报, 2019, 35(11): 160-164.
[21] JIAO Y, YANG S, CAO Y F, et al. Genome and transcriptome analyses providing insight into the immune response of pearl oysters after allograft and xenograft transplantations[J]. Fish and Shellfish Immunology, 2019, 90:109-117.
[22] 王学颖, 高远镇, 杜晓东, 等. 马氏珠母贝金黄壳色选系F3和基础群体的遗传结构比较[J]. 海洋通报, 2012, 31(3): 324-328.
[23] DU X D, FAN G Y, JIAO Y, et al. The pearl oystergenome and multi-omic analyses provide insights into biomineralization[J]. GigaScience, 2017, 6 (8):1–12.
[24] WANG L L, FENG Z X, WANG X, et al. DEGseq: an R package for identifying differentially expressed genes from RNA-seq data[J]. Bioinformatics, 2010, 26(1): 136-138.
[25] FISHER W S, DINUZZO A R. Agglutination of bacteria and erythrocytes by serum from six species of marine molluscs [J]. Journal of Invertebrate Pathology, 1991, 57(3): 380-394.
[26] 朱家萍. 马氏珠母贝血清抗菌活性蛋白的分离纯化与鉴定[D]. 湛江: 广东海洋大学, 2015.
[27] WANG Z L, JIAN J J, LU Y S, et al. A tandem-repeat galectin involved in innate immune response of the pearl oyster[J]. Mar Genomics, 2011, 4(3): 229-236.
[28] NI D J, SONG L S, WU L T, et al. Molecular cloning and mRNA expression of peptidoglycan recognition protein (PGRP) gene in bay scallop (, Lamarck 1819) [J]. Developmental & Comparative Immunology, 2007, 31(6), 548-558.
[29] OLAFSEN J A, FLETCHER T C, GRANT P T. Agglutinin activity in pacific oyster () hemolymph following in vivochallenge[J]. Developmental and Comparative Immunology, 1992, 16(2/3):123-138.
[30] TUNKIJJANUKIJ S, OLAFSEN J A. Sialic acid-binding lectin with antibacterial activity from the horse mussel: further characterization and immunolocalization[J]. Developmental and Comparative Immunology, 1998, 22(2): 139-150.
[31] 胡钰婷, 张殿昌, 崔淑歌, 等. 合浦珠母贝C-型凝集素基因的序列特征和功能分析[J]. 水产学报, 2011, 35(9): 1327-1335.
[32] PARK K, BANG H W, PARK J, et al. Ecotoxicological multilevel-evaluation of the effects of fenbendazole exposure tolarvae[J]. Chemosphere, 2009, 77(3): 359-367.
[33] 王宇萍, 蒋建东. 热休克蛋白70的结构和功能[J]. 中国细胞生物学学报, 2010, 32(2): 305-313.
[34] ZHAO X X, WANG Q H, JIAO Y, et al. Identification of genes potentially related to biomineralization and immunity by transcriptome analysis of pearl sac in pearl oyster[J]. Marine Biotechnology, 2012, 14(6):730-739.
[35] GAO Q, ZHAO J M, SONG L S, et al. Molecular cloning, characterization and expression of heat shock protein 90 gene in the haemocytes of bay scallop[J]. Fish & Shellfish Immunology, 2008, 24(4):379-385.
[36] 吴羽媛, 郭志颖, 梁海鹰, 等. 马氏珠母贝TLR6基因的克隆、序列分析与表达[J]. 水产学报, 2017, 41(11): 1687-1697.
[37] GERDOL M, GOMEZ-CHIARRI M, CASTILLO M G, et al. Immunity in molluscs: Recognition and effector mechanisms, with a focus on Bivalvia[M] Advances in Comparative Immunology. 2018, 8: 225-341.
[38] LI R J, ZHANG R, ZHANG L, et al. Characterizations and expression analyses of NF-κB and Rel genes in the Yesso scallop () suggest specific response patterns against Gram-negative infection in bivalves[J]. Fish & Shellfish Immunology, 2015, 44(2): 611-621.
[39] MYLÈNE T, GERDOL M, ROSANI U, et al. Toll-like receptors and MyD88 adaptors in Mytilus: Complete CDS and gene expression levels[J]. Developmental & Comparative Immunology, 2013, 40(2): 158-166.
[40] TOUBIANA, M, ROSANI U, GIAMBELLUCA S, et al. Toll signal transduction pathway in bivalves: Complete CDS of intermediate elements and related gene transcription levels in hemocytes of immune stimulated[J]. Developmental & Comparative Immunology, 2014, 45(2): 300-312.
Screening of Immune Related Genes of Yellow Colored Line ofAfter Nucleus Insertion Operation by Transcriptome Analysis
WANG Zhe1, WANG Zi-man1, HAO Rui-juan1, LI Jun-hui1, DENG Yue-wen1,2
(1.,,524088,2.,524088,)
To investigate the immune-related genes and metabolic pathways of yellow colored line ofafter nuclear insertion operation.The cDNAs were used to construct the transciptome for the analyis of the blood cells of the cultivar before and after nucleus insertion operation.61.78 × 106and 62.68 × 106high quality Reads were obtained respectively and the average mapping rates to the reference genome were 70.16% and 67.82%, respectively. Compared with that before nuclear insertion, 2925 and 3097 genes were significantly up-regulated and down-regulated (Fold Change≥2 and Adjustedvalue≤0.001), including immune-related genes, such as lectin, Toll-like receptor, heat shock protein and so on. The differential genes were classified by GO and divided into three categories: molecular function, cell component and biological process. They were subdivided into 11 subcategories, among which there were more genes with binding and catalytic functions. KEGG classification analysis of differential genes showed that genes-involved KEGG metabolic pathway can be divided into six branches: cellular processes, environmental information processing, genetic information processing, and human disease (animals only), metabolism and organismal systems. The results of KEGG enrichment showed that Cytosolic DNA-sensing pathway, Leukocyte transendothelial migration was significantly enriched in immune related pathway.
; Yellow colored line; Transcriptome; immune-related genes
Q78
A
1673-9159(2019)06-0009-08
10.3969/j.issn.1673-9159.2019.06.002
2019-03-21
国家贝类产业体系专项(CARS-049);广东省科技厅项目(2017A030303076)
王哲(1989―),女,硕士研究生,研究方向为水产无脊椎动物生物学。Email:2262891416@qq.com
邓岳文(1975―),男,博士,教授,珍珠贝遗传育种与养殖。Email: dengyw@gdou.edu.cn
王哲,王姿曼,郝瑞娟,等. 马氏珠母贝金黄壳色选育群体植核后差异表达免疫基因筛选[J]. 广东海洋大学学报,2019,39(6):9-16.
(责任编辑:刘庆颖)

