金鲳鱼皮明胶流变性质
曾少葵,吴文龙,章超桦,王瑶珠,苏伟明
金鲳鱼皮明胶流变性质
曾少葵1,2,3,吴文龙1,2,3,章超桦1,2,3,王瑶珠1,苏伟明1,2,3
(1. 广东海洋大学食品科技学院/2. 广东省水产品加工与安全重点实验室/3. 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
研究金鲳鱼()鱼皮明胶流变性质。利用氨基酸分析仪测定明胶的氨基酸组成,并对66.7 g·L-1明胶凝胶的动态粘弹性进行分析比较。金鲳鱼皮明胶氨基酸组成中每1 000总氨基酸残基中甘氨酸为334个,亚氨基酸脯氨酸和羟脯氨酸共184个,凝胶强度为342 g; 66.7 g·L-1金鲳鱼皮明胶溶液粘度为7.13 cp,凝胶温度及熔胶温度分别为20.4 ℃和28.3 ℃,乳化性及乳化稳定性分别为8.32 m2/g、34 min。金鲳鱼皮明胶凝胶强度优于牛骨明胶,凝胶温度、熔胶温度低于牛骨明胶,更适合应用于要求低温贮藏的可食膜或微胶囊基料。
金鲳鱼皮;明胶;氨基酸组成;流变性质
明胶是一种不可逆的胶原蛋白水解物,已被作为一种天然的增稠剂、乳化剂、胶冻剂、稳定剂、发泡剂、分散剂及澄清剂,广泛应用于食品、医药、化妆品制造等领域。通常,明胶以陆上动物的猪皮、牛皮或牛骨为提取原料。近年来,由于口蹄疫和疯牛病等疾病的爆发,使哺乳动物明胶的安全性备受人们的关注。目前,从水产动物组织中提取明胶已成为该领域的研究热点。Zeng等[1-2]对罗非鱼皮、鱼鳞明胶的理化性质进行了分析;郑雅爻等[3]对鲢鱼皮明胶提取方法及谷氨酰胺转氨酶改性对明胶结构和膜性能的影响进行了探讨;沙小梅等[4]对草鱼鱼鳞明胶进行糖基化反应,研究糖基化鱼鳞明胶消化后多肽的抗氧化活性。金鲳鱼(),学名卵形鲳鲹,分布于印度洋、印度尼西亚、澳洲、日本、美洲的热带及温带的大西洋海岸及中国黄海、渤海、东海、南海。目前,广东、福建已实现网箱养殖。据统计,2016年我国金鲳鱼产量约为10万t[5],近年产量逐年增加,2018年,仅广西铁山港区深水抗风浪网箱养殖示范区内的金鲳鱼产量就达到了4.4万t[6]。金鲳鱼的鱼皮含有丰富的胶原蛋白[7],适合于提取明胶。因此,本研究利用酸碱二元法提取金鲳鱼皮明胶,并对其流变性质及功能性质进行探讨,旨在为金鲳鱼皮高值化利用提供一条行之有效途径。
1 材料与方法
1.1 材料
鲜活金鲳鱼购自湛江昌大昌超级购物广场有限公司,运到实验室手工宰杀后,除去内脏、取皮、清洗后冷冻至-18 ℃备用;牛骨明胶(150AB8)购买于罗赛洛(广东)明胶有限公司。
1.2 仪器
TMS-pro质构仪为Food Technology Corperation (U·S·A)产品,835-50 氨基酸分析仪为日本HITACHI 公司产品,HAAKE MARSⅢ模块化高级流变仪为德国赛默飞世尔科技公司产品,UV-756MC紫外分光光度计为日本岛津公司产品。
1.3 方法
1.3.1 明胶提取 金鲳鱼皮明胶提取参照ZENG等方法[1]进行。将洗净后金鲳鱼皮剪碎,按料液比1∶10(g·mL-1)于3.0 g·L-1NaOH溶液中浸泡160 min,每隔40 min更换1次NaOH溶液,以除去非胶原成分,然后洗涤至中性后沥干,浸于0.7‰ HCl溶液(料液比1∶10, g·mL-1)160 min,每隔40 min换1次溶液,使黑膜基本脱净,再洗涤至中性,按鱼皮重1.5倍加入水,在50 ℃熬胶,然后用200目筛过滤得到澄清胶液,再在5 000 r/min下离心15 min,将上清液60 ℃真空浓缩至10 brix后,置于65 ℃恒温干燥,得到成品。
明胶得率=干明胶质量/鱼皮原料质量,(1)
蛋白质回收率= 明胶得率×明胶粗蛋白含量/
鱼皮粗蛋白质含量。 (2)
1.3.2 基本成分测定 水分测定采用常压干燥法[8];粗蛋白测定采用半微量凯氏定氮法[9];粗脂肪测定采用索氏抽提法[10];总糖测定采用硫酸-苯酚法[11];灰分测定采用高温灼烧法[12]。
1.3.3 氨基酸分析 明胶经 6 mol·L-1HCl 110 ℃水解 24 h,将水解液过滤,滤液蒸干除去HCl,然后用1 mL(pH 2.2)柠檬酸钠缓冲液溶解,定容后过滤,用日立835-50型高速氨基酸分析仪测定氨基酸。
1.3.4 胶原蛋白含量测定 采用分光光度法测定羟脯氨酸[13],按下式计算胶原蛋白含量。
胶原蛋白含量=羟脯氨酸含量×11.1。 (3)
1.3.5 凝胶强度测定 根据MUYONGA方法[14]测定凝胶强度并进行校正。将明胶于60 ℃水中溶解成66.7 g·L-1溶液,于(10 ± 1)℃凝胶16~18 h后,在TMS-Pro质构仪上用直径12.7 mm的平头圆柱探头以0.5 mm/s速度测定,压入冻胶表面4 mm处所承受的最大力为(g)。凝胶强度按下式校正:
凝胶强度 =×[/(100 –-) ]2,(4)
式中、及分别为明胶的粗蛋白、水分及灰分含量。
1.3.6 透射比测定 参照GB 6783-2013[15]方法,在45 ℃下,采用分光光度计测定66.7 g·L-1明胶溶液在波长620 nm下的透射比。
1.3.7 流变性质测定 将明胶在60 ℃溶解制成66.7 g·L-1溶液,采用同心圆筒探头,设置1.9 mm间隙、40 ℃、控制应力3 Pa及速率100.0 s-1在HAAKE MARSⅢ模块化高级流变仪测定4 min的粘度[16]。
将66.7 g·L-1明胶溶液冷却至7 ℃凝胶16~18 h,根据Gudmundsson方法[17],测定以0.75 ℃/min降温及升温过程明胶凝胶的动态粘弹性变化。′为弹性模量,″为粘性模量,损耗角正切tan″/′。从35 ℃至15 ℃降温时,′与″相交处(即tan1)对应的温度为凝胶温度,从15 ℃至35 ℃升温时′与″相交处对应的温度即为熔胶温度。
1.3.8 pH测定 将明胶于60 ℃水中溶解成10.0 g·L-1明胶溶液,用pH仪测定其pH。
1.3.9 氮溶解指数测定 明胶的氮溶解指数(Soluble nitrogen in-dex, NSI)是指明胶中水溶解性氮占总氮百分率。将明胶于60 ℃溶解成20.0 g·L-1溶液,采用福林酚法[18]测定其上清液中蛋白质含量,按下式计算氮溶解指数。
氮溶解指数=溶液蛋白质含量/明胶粗蛋白含量。(5)
1.3.10 乳化性和乳化稳定性测定 参照Pearce方法[19]测定明胶乳化性(Emulsifying activity,EAI)和乳化稳定性(Emulsion stability,ESI)。将2 mL花生油与6 mL 20.0 g·L-1明胶溶液混合,20 000 r/min均质10 min,在混合0 min和10 min后从容器底部吸取乳液1 mL,用0.1%SDS稀释100倍后于涡旋振荡器混合10 s,分别测定500 nm处光密度值0、10。乳化性和乳化稳定性按下式计算:
= (2 × 2.303 ×0× 100) / (× c × θ), (6)
=0/(0-10)× △。 (7)
其中,,分别为乳化性(m2/g)及乳化稳定性(min),0、10分别为0、10 min乳液光密度值,为光路(0.01 m),为蛋白浓度(g/m3),为分散相体积分数(0.25),△为时间间隔(10 min)。
1.3.11 持水性和吸油性测定 将一定量明胶置于离心管中,加入50 mL蒸馏水或10 mL花生油,每15 min用涡旋振荡器混合5 s, 1 h后离心(3 000 r/min,20 min),除去上清液,将离心管倾斜45度角于滤纸上继续排水或油30 min后,称量吸水或油后明胶和离心管的总质量[20]。
持水性(或吸油性) =(T-0)/g, (8)
其中,T为吸水或吸油后明胶和离心管总质量,0为离心管质量,g为明胶质量。
1.3.12 数据处理 采用IBM® SPSS® Statistics V19和Microsoft® Excel 2013对实验数据进行统计、分析,采用LSD检验组间的差异,< 0.05作为差异显著的标志。
2 结果
2.1 鱼皮基本成分
金鲳鱼鱼皮经去鳞、清洗、剪碎、沥干后测定其基本成分及胶原蛋白含量,结果见表1。

表1 基本成分及胶原蛋白质量分数
注: 粗蛋白质量分数=×5.51。
Note: The conversion factor for calculating the content of crude protein is 5.51.
由表1可知,金鲳鱼皮中粗蛋白含量丰富,与罗非鱼皮(33.14 %)、黄鳍金枪鱼皮(32.66%)基本持平,高于军曹鱼皮(28.53 %)[21]。金鲳鱼皮胶原蛋白含量约占其粗蛋白84%,可见是提取明胶的良好原料。
2.2 明胶得率及基本成分
按1.3.1方法提取金鲳鱼皮明胶得率为19.43% (以湿基计)。测定所得明胶基本成分,并与牛骨明胶进行比较,结果如表2所示。
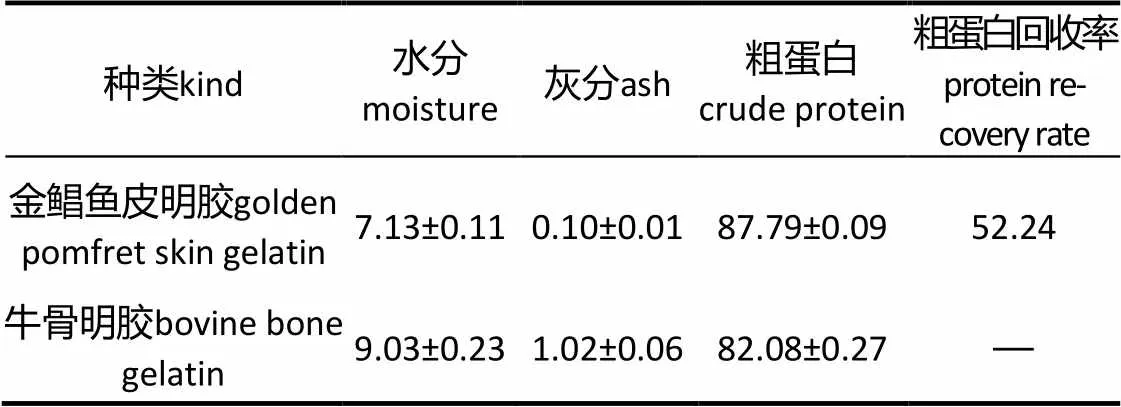
表2 明胶基本成分质量分数
注: 粗蛋白质量分数=×5.51
Note: The conversion factor for calculating the content of crude protein is 5.51.
根据国家标准要求,明胶水分含量应小于或等于14%,灰分含量不高于2%[15]。由表2可知,金鲳鱼皮明胶这2项含量均较低,而粗蛋白含量为94.5 %(以干基计),比商品牛骨明胶高。此外,粗蛋白回收率高达52.24%,由此可见,本研究提取明胶的方法是有效的。
2.3 氨基酸组成
金鲳鱼皮与牛骨明胶的氨基酸组成见表3。

表3 金鲳鱼皮明胶和牛骨明胶氨基酸组成
注:每1 000个总氨基酸残基中的残基数
由表3可知,金鲳鱼皮明胶氨基酸组成中甘氨酸约占总氨基酸含量的1/3,符合胶原蛋白氨基酸组成Gly-X-Y的特征。每1 000个总氨基酸残基含184个亚氨基酸,即脯氨酸和羟脯氨酸,高于牛骨明胶及罗非鱼鳞明胶(173个)[2],略低于罗非鱼皮明胶(185个)[1]。丙氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸及脯氨酸等疏水性氨基酸占总氨基酸的32.9%。据报道,明胶的亚氨基酸及疏水性氨基酸含量与其凝胶强度、热稳定性等性质有关[22]。
2.4 理化性质
金鲳鱼皮明胶及牛骨明胶的凝胶强度、透射比及pH测定结果见表4。
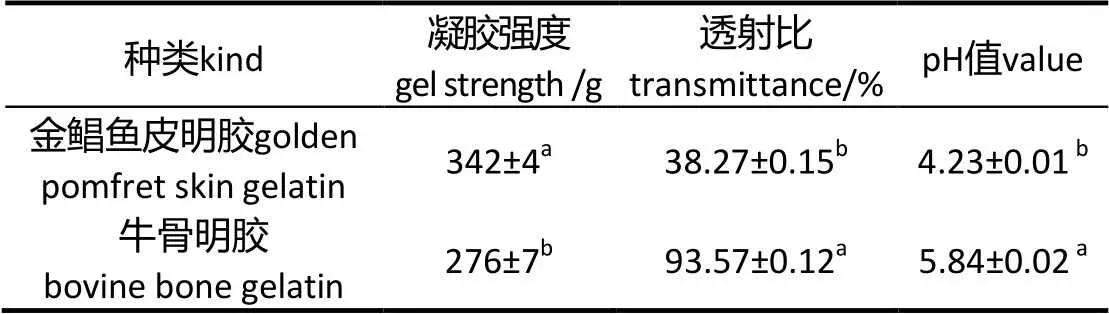
表4 明胶理化性质
注:同一列标记相同字母即为差异不具统计学意义。
Note: Same letters in the same column indicated no significant difference.
由表4可知,金鲳鱼皮明胶的凝胶强度优于牛骨明胶、罗非鱼皮明胶(260 g)[1]及鲢鱼皮的明胶(70 g)[3],但低于猪皮明胶(367 g)[1]。明胶的凝胶强度大小与其蛋白质分子量大小、分布、氨基酸组成有关,受提取过程中酸碱处理的浓度及时间影响[23]。
另外,金鲳鱼皮明胶在620 nm的透射比低于国家标准的50%[15],工业化生产可以采用活性炭吸附法来改善明胶透射比[24]。
2.5 流变性
2.5.1 动态粘弹性 测定66.7 g·L-1金鲳鱼皮及牛骨明胶凝胶的动态粘弹性,弹性模量′、粘性模量″在降温及升温过程的变化规律如图1、图2所示。

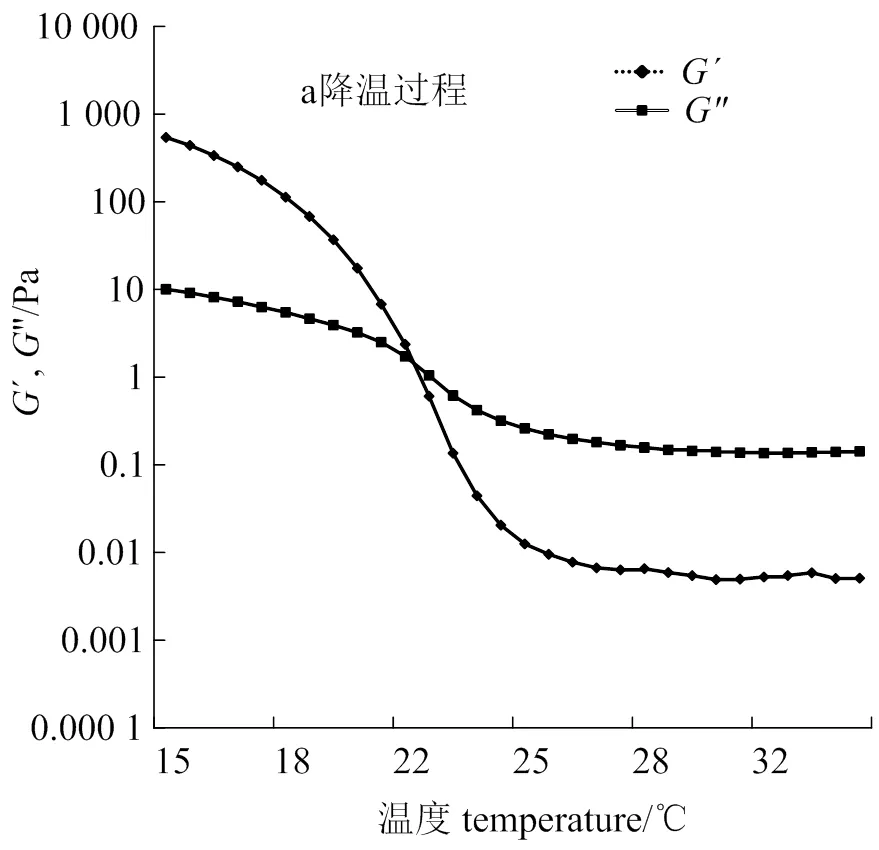
弹性模量′、粘性模量″是表征高分子浓溶液动态粘弹性的参数。从图1、图2可以知道,在15 ℃时,金鲳鱼皮及牛骨明胶凝胶的弹性模量′约是它们粘性模量″的100倍。′越大,则明胶弹性越大,tan越小,体系弹性成分占优势,则表现固体特征[25]。在升温过程中,金鲳鱼皮明胶与牛骨明胶的凝胶均表现热可逆行为,这是由于明胶丝连接区交联与离解作用所需的能量不同所致[26]。随着温度升高,′和″下降,但2种明胶的变化幅度有显著差异(< 0.05),损耗角正切tan增加。金鲳鱼皮明胶凝胶的′随着温度升高呈下降趋势,″无显著变化,在温度28 ℃附近,′迅速下降,当tan= 1时的温度为熔胶温度[17]。在降温过程,金鲳鱼和牛骨明胶凝胶的′、″的变化趋势及幅度差异不显著(﹥0.5),当′ =″即tan= 1的温度,为凝胶温度。
2.5.2 凝胶温度、熔胶温度及粘度 流变仪测定66.7 g·L-1明胶溶液的粘度及从凝胶动态粘弹性图得到的凝胶温度及熔胶温度见表5。

表5 明胶流变性质
注: 同一列标记相同字母即为差异不具统计学意义。
Note: Same letters in the same column indicated no significant difference.
从表5可知,金鲳鱼皮明胶的凝胶温度及熔胶温度均低于牛骨明胶,高于罗非鱼皮(18 ℃,22.4 ℃)[1]及斑鱵()皮明胶(19.5 ℃,25 ℃)[27]。可见,水生动物明胶的热稳定性不如陆生动物明胶,适合用于作为冷冻食品的微胶囊化或可食膜开发的基料。
粘度反映亲水性,与明胶分子量大小、分散性及凝胶强度有直接关系。金鲳鱼皮明胶粘度略低于牛骨明胶,但高于Mirzapour-Kouhdasht等[23]从鲤鱼下脚料提取的明胶(6.77)。由此可推测,金鲳鱼皮明胶成膜性略低于牛骨明胶,优于鲤鱼下脚料明胶。
2.6 明胶的溶解性
测定金鲳鱼皮明胶及牛骨明胶在25 ℃及60 ℃的氮溶解指数,结果见表6。

表6 明胶不同温度下的氮溶解指数
注:同一列或行标记相同字母即为差异不具统计学意义。
Note:Same letters in the same column or line indicated no significant difference.
由表6可知,常温下牛骨明胶的氮溶解指数高于金鲳鱼皮明胶,然而在60 ℃时金鲳鱼皮明胶比牛骨明胶更容易溶解,这可能与明胶的氨基酸组成有关。从表3可知,金鲳鱼皮明胶氨基酸组成中,疏水性氨基酸所占百分比高于牛骨明胶,因而在常温下两者的溶解性有显著差异(< 0.05)。
2.7 明胶的功能性质
测定金鲳鱼皮明胶乳化性、稳定性、吸水性及吸油性,并与商品牛骨明胶进行比较,结果如表7所示。
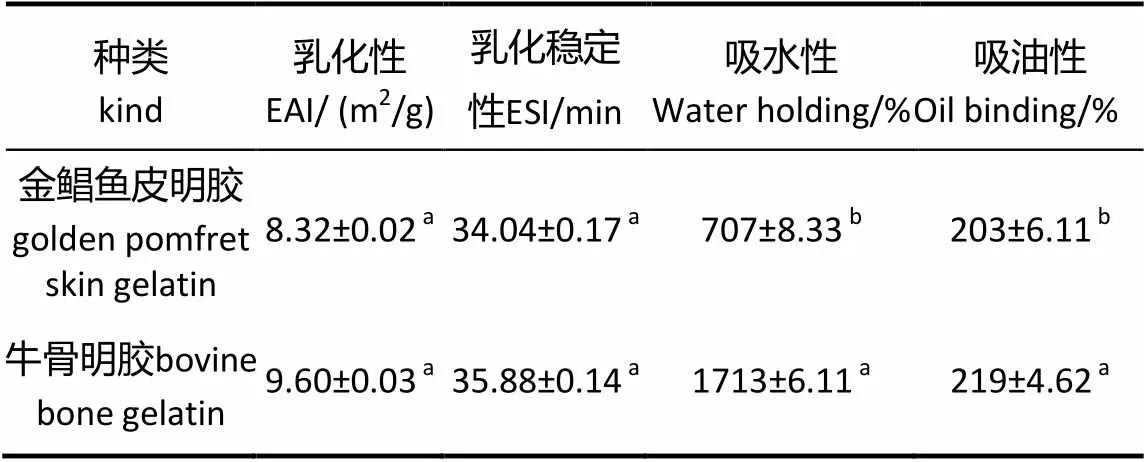
表7 明胶功能性质
注:同一列标记相同字母即为差异不具统计学意义。
Note: Same letters in the same column indicated no significant difference.
表7结果表明,金鲳鱼皮明胶的乳化性、乳化稳定性以及吸油性与商品牛骨明胶没有显著差异(﹥0.5),但吸水性差异明显。这可能与加工明胶的方法尤其是干燥方法有关,可通过喷涂卵磷脂或用水解明胶以薄膜包覆明胶改善其吸水性[28]。
3 结论
(1)金鲳鱼皮中胶原蛋白占其粗蛋白比例高,可以用作提取明胶的原料。
(2)金鲳鱼皮明胶凝胶强度高于牛骨明胶,凝胶温度、熔胶温度低于牛骨明胶,适合用于作为热敏性物质的微胶囊化基料。
[1] ZENG S K, YAN X Y, CAO W H, et al. Optimisation of extraction conditions and characteristics of skin gelatin from Nile tilapia ()[J]. International Journal of Food Science and Technology, 2010, 45(9): 1807-1813.
[2] 曾少葵, 刘坤, 吴艺堂, 等. 脱钙罗非鱼鱼鳞明胶提取工艺优化及其理化性质[J]. 南方水产科学, 2013, 9(2): 38-44.
[3] 郑雅爻,马月,罗永康, 等. 鲢鱼皮明胶提取方法和谷氨酰胺转氨酶改性对明胶结构和膜性能的影响[J]. 食品科学, 2017, 38(19): 92-99.
[4] 沙小梅, 胡姿姿, 涂宗财, 等. 基于体外模拟消化的糖基化草鱼鱼鳞明胶抗氧化性研究[J]. 食品与发酵工业, 2018, 44(3): 58-64.
[5] 廖静, 钟小芳. 金鲳鱼“产业革命”即将开启[J]. 海洋与渔业, 2017(4): 24-25.
[6] 汪杨. 去年金鲳鱼产量达到4.4万吨广西北海市网箱养殖业“点鱼成金” [EB/OL] .(2019-02-21) [2019-07-19] http://www.shuichan.cc/news_view-379147.html
[7] WANG Y X, WEI P X, WENG W Y. Characteristics and select functional properties of collagen from golden pompano () skins[J]. Journal of Aquatic Food Product Technology, 2017, 26(8): 892-902.
[8] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中水分的测定:GB 5009.3-2016[S]. 北京: 中国标准出版社, 2016.
[9] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中蛋白质的测定:GB 5009.5-2016[S]. 北京: 中国标准出版社, 2016.
[10] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中脂肪的测定:GB 5009.6-2016[S]. 北京: 中国标准出版社, 2016.
[11] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 肉制品总糖含量测定: GB/T9695.31-2008[S]. 北京: 中国标准出版社, 2008.
[12] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中灰分的测定:GB 5009.4-2016[S]. 北京: 中国标准出版社, 2016.
[13] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 肉与肉制品羟脯氨酸含量测定: GB/T9695.23-2008[S]. 北京: 中国标准出版社, 2008.
[14] MUYONGA J H, COLE C G B, DUODU K G. Extraction and physicochemical characterisation of Nile perch () skin and bone gelatin[J]. Food Hydrocolloids, 2004,18(4): 581–592.
[15] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品添加剂明胶:GB 6783-2013[S]. 北京: 中国标准出版社, 2013.
[16] MARIO H U M, HISILA S O, FRANCISCO J C M, et al. Giant squid skin gelatin: Chemical composition and biophysical characterization[J]. Food Research International, 2011, (12)44:3243-3249.
[17] GUDMUNDSSON M. Rheological properties of fish gelatins[J]. Journal of Food Science, 2002, 67(6): 2172-2176.
[18] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with Folinphenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1):256-275.
[19] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of agricultural and food chemistry, 1978, 26(3): 716-723.
[20] 杨树奇. 军曹鱼皮胶原蛋白的提取及其功能特性的研究[D]. 湛江: 广东海洋大学, 2010.
[21] 杨树奇,曾少葵,周春霞, 等. 3种鱼皮的基本成分及氨基酸组成分析[J]. 广东海洋大学学报, 2010, 30(1): 97-100.
[22] BADII F, Howell N K. Fish gelatin: structure, gelling properties and interaction with egg albumen proteins[J]. Food Hydrocolloids, 2006, 5(20): 630–640.
[23] MIRZAPOUR-KOUHDASHT A, SABZIPOUR F, TAGHIZADEH M S, et al. Physicochemical, rheological, and molecular characterization of colloidal gelatin produced from common carp by-products using microwave and ultrasound-assisted extraction[J]. Journal of texture studies, 2019, 50(5):416-425.
[24] 曾少葵, 杨萍, 邓楚津, 等. 罗非鱼皮明胶的脱腥方法及理化性质[J]. 水产学报, 2010, 34(3): 349-356.
[25] BINSI P K, SHAMASUNDAR B A, ILEEP A O D, et al. Rheological and functional properties of gelatin from skin of Bigeye snapper) fish: Influence of gelatin on the gel-forming ability of fish mince[J]. Food hydrocolloids, 2009, 23 (1):132-145.
[26] RAFE A, RAZAVI S M. Scaling law, fractal analysis and rheological characteristics of physical gels cross-linked with sodium trimetaphosphate[J]. Food Hydrocolloids, 2017, 62(1): 58–65.
[27]ABDELHEDI O, JRIDI M, NASRI R, et al. Rheological and structural properties ofskin gelatin: Potential use as an active fish coating agent[J]. Food Hydrocolloids, 2019, 87 (2) : 331–341.
[28] 信息组. 提高明胶可湿性和可分散性和可分散性的方法[J]. 明胶科学与技术, 2009, 29(4): 189-194.
Research on the Rheological Properties of Skin Gelatin from Golden Pomfret ()
ZENG Shao-kui1,2,3, WU Wen-long1,2,3, ZHANG Chao-hua1,2,3,WANG Yao-zhu1, SU Wei-ming1,2,3
(1.,524088,//2.,524088,//3.,524088,)
The rheological properties of golden pomfret () skin gelatin were researched.The amino acid composition of gelatin was determined by amino acid analyzer. And the dynamic viscoelasticity of 66.7 g·L-1gelatin gel was analyzed.In amino acid composition of golden pomfret skin gelatin, there are 334 glycine and 184 imino acids including proline and hydroxyl-proline residues per 1000 total amino acid residues, respectively. The gel strength of golden pomfret skin gelatin was 342 g. Rheological behaviors indicated that viscosity of the 66.7 g·L-1solution was 7.13 cp. The gelling and melting points were 20.4 and 28.3 ℃, respectively. The emulsion activity and emulsion stability were 8.32 m2/g and 34 min, respectively.The gel strength of the golden pomfret skin gelatin was better than that of bovine bone gelatin. The gelling and melting points were lower than those of bovine bone gelatin. Therefore, the gelatin extracted from golden pomfret skin is suited to use as material to make microcapsules or edible films in low temperature.
golden pomfretskin; gelatin; amino acid composition; rheological property
TS254.9
A
1673-9159(2019)06-0108-07
10.3969/j.issn.1673-9159.2019.06.014
2019-07-19
广东普通高等学校水产品高值化加工与利用创新团队(GDOU10106030503);2016 年广东省应用型科技研发专项资金项目(2016B020235002)
曾少葵(1963-),女,硕士,教授,研究方向为水产品高值化加工与利用。E-mail: zsk1105@126.com
章超桦,E-mail:chz2382@126.com
曾少葵,吴文龙,章超桦,等. 金鲳鱼皮明胶流变性质[J].广东海洋大学学报,2019,39(6):108-114.
(责任编辑:刘岭)

