尼罗罗非鱼淋巴毒素α基因克隆与表达分析
邹子鸿,郑 琦,黄 瑜,汤菊芬,王 蓓,鲁义善,简纪常,蔡 佳
(广东海洋大学水产学院,广东省水产经济动物病原生物学及流行病学重点实验室 暨水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
尼罗罗非鱼淋巴毒素α基因克隆与表达分析
邹子鸿,郑 琦,黄 瑜,汤菊芬,王 蓓,鲁义善,简纪常,蔡 佳
(广东海洋大学水产学院,广东省水产经济动物病原生物学及流行病学重点实验室 暨水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
【目的】克隆尼罗罗非鱼(Oreochromis niloticus)淋巴毒素α 基因(lymphotoxin alpha, LTα),分析该基因的组织分布,探讨该基因在抗菌抗病毒免疫过程中的重要作用。【方法】通过RACE 技术获得尼罗罗非鱼淋巴毒素α 基因(On-LTα)的cDNA 全长,通过生物信息学分析其序列结构特征;利用实时荧光定量PCR 检测基因的组织分布特征,以及健康尼罗罗非鱼感染无乳链球菌后该基因的表达变化,并进一步分离出尼罗罗非鱼非特异性毒性细胞(NCC),检测脂多糖(LPS)和聚肌胞苷酸(Poly I:C)刺激后,On-LTα 在NCC 中的表达变化。【结果】On-LTα 基因序列全长为2 699 bp ,包含705 bp 开放阅读框(ORF),编码234 个氨基酸(GenBank 登录号:MK770358)。该蛋白属于跨膜蛋白,具有肿瘤坏死因子(TNF)家族保守结构域。实时荧光定量结果表明,On-LTα在健康尼罗罗非鱼11 种组织中均有表达,在脾脏中的表达量最高;无乳链球菌刺激后,该基因在脾脏中的表达量显著升高;LPS 与Poly I:C 刺激后,On-LTα 在NCC 中表达量也显著上调。【结论】On-LTα 参与了尼罗罗非鱼抗菌抗病毒的免疫应答过程。
尼罗罗非鱼;淋巴毒素α 基因;基因克隆;基因表达;非特异性细胞毒性细胞(NCC)
肿瘤坏死因子(Tumor necrosis factor, TNF)超家族由19 个成员组成,TNF 通过与其受体(TNF receptor, TNFR)相互作用可调节炎症和非特异性免疫反应,在自身免疫性疾病、抵抗细菌和病毒感染中发挥重要作用[1-2]。淋巴毒素α(LTα)又称TNF-β,是TNF 超家族中重要成员之一,有膜结合和游离两种存在形式,在T 细胞、B 细胞和自然杀伤(Natural killer,NK)细胞等淋巴细胞中均有表达,在免疫调节中发挥不同的作用[3-5]。在抗感染免疫中,LTα通过调控NF-κB 信号通路与该通路中调节蛋白的活性参与炎症、基质降解和细胞凋亡过程[6],还可调节树突状细胞激活的适应性免疫过程[7],以及诱导白介素(IL-6)的表达[8]。LTα 基因缺失会减弱CD8+T 细胞的应答,从而不能抑制小鼠中枢神经系统中病毒的感染[9]。LTα 在小鼠的NK 细胞前体中表达,并可促进NK 细胞的发育[10-11]。LTα 缺失会影响NK 细胞的发育和募集,导致肿瘤生长和转移增强[12]。然而目前LTα 的研究主要集中在哺乳动物中,鱼类TNF-β(LTα)基因的报道尚十分匮乏。
尼罗罗非鱼(Oreochromis niloticus)是我国重要的淡水经济鱼类之一,随着养殖规模的扩大以及养殖密度的增加,病害频发,严重影响了罗非鱼养殖业的发展[13]。肿瘤坏死因子在抵抗细菌和病毒感染中发挥重要作用,淋巴毒素α 基因是肿瘤坏死因子家族的一员。为了解该基因在尼罗罗非鱼抗菌抗病毒过程中的作用,本研究克隆尼罗罗非鱼淋巴毒素α 基因(On-LTα),并进行生物信息学分析,检测On-LTα 在健康鱼体中的组织分布及其在无乳链球菌、脂多糖(LPS)和聚肌胞苷酸(PolyI:C)刺激后的表达变化,为深入了解该基因在尼罗罗非鱼抗感染免疫中的作用提供基础。
1 材料与方法
1.1 材料
实验用尼罗罗非鱼(50 ± 3)g,购自广东省高州市某罗非鱼养殖场,于24 h 循环水系统中暂养一周后用于实验,系统水温为(28 ± 1)℃。
SMARTer®RACE 试剂盒、pMD18-T 载体、Ex Taq 酶购自TaKaRa 公司。LPS 购自碧云天公司。PolyI:C 购自Apexbio 公司。DH5α 购自武汉转导生物实验室。TransZol Up Plus RNA Kit、实时荧光定量试剂盒(TransStart Green qPCR SuperMix)购自北京全式金公司。Percoll 分离液购自GE Healthcare公司。无乳链球菌(Streptococcus agalactiae)由广东省水产经济动物病原生物学及流行病学重点实验室保存。
1.2 方法
1.2.1 总RNA 的提取及cDNA 的合成 取上述暂养活力较好且健康的罗非鱼5 尾,剖取脑、心脏、胸腺、肝脏、头肾、脾脏、肠、肾、鳃、肌肉和皮肤用于组织分布检测。使用TransZol Up Plus RNA Kit 提取总RNA,参照反转录试剂盒说明书进行反转录,获得 cDNA 一链用于后续实验。使用SMARTer® RACE 试剂盒合成脾脏cDNA 第一链,用于3′ 及5′ RACE。
1.2.2 On-LTα 基因全长cDNA 克隆 通过NCBI数据库预测得到On-LTα 基因序列,利用PCR 技术从罗非鱼cDNA 中扩增出On-LTα 的开放阅读框(Open reading frame,ORF),然后设计全长引物5′RACE 和3′RACE(表1),通过RACE 技术得On-LTα 基因的cDNA 全长。
1.2.3 On-LTα 基因生物信息学分析 基因序列的比对、ORF 的查找以及同源性分析在NCBI 网站上进行;利用ExPASy (http://web.expasy.org/protparam/)在线分析理化性质;通过 SignalP 4.1 Server (http:// www.cbs.dtu.dk/services/SignalP/)预测信号肽;利用SMART(http://smart.embl-heidelberg.de/)在线分析结构域;通过 PSITE(http://linux1.softberry.com/ berry.phtml?topic=psite&group=programs&subgroup=proloc)预测氨基酸功能位点;二级结构和三级结构的模拟则运用 SOPMA 和SWISS-MOLDEL 软件完成;使用DNAMAN5.0 软件进行多序列比对;经过ClustalX 比对后的序列利用MEGA5.2 软件构建系统进化树。
1.2.4 无乳链球菌人工感染 将制备好的1 mL 菌液接种于50 mL 的BHI 液体培养基中,置于28 ℃、180 r/min 的摇床中扩培24 h。扩培后用磷酸缓冲液(PBS)将菌液调整为1×109CFU/mL 后待用。随机取健康尼罗罗非鱼10 尾,分为实验组和对照组,实验组每尾注射100 μL 菌液,对照组则注射等量的生理盐水,注射0、3、6、12、24、48、72 h 后,分别从两组鱼(每组5 尾)的脾脏中提取RNA,反转录成cDNA 后保存,方法同1.2.1。
1.2.5 尼罗罗非鱼头肾非特异性细胞毒性细胞(NCC)的分离 方法如郑琦等[14]。取2 g 尼罗罗非鱼的头肾组织,充分破碎后,使用RPMI-1640 培养基配制成细胞悬液,添加至两层不同浓度Percoll分离液液面,置于水平离心机中以500 g、4 ℃条件离心30 min。
1.2.6 LPS 和Poly(I:C)刺激NCC 将NCC 接种至24 孔细胞培养板中,细胞量约1×105个/孔,分别加入终质量浓度为1 mg/mL 的LPS 和5 mg/mL 的Poly(I:C)进行刺激,依次收取刺激0、4、8、12、24 h 后的细胞,提取RNA,反转录后作为定量模板。
1.2.7 On-LTα 基因表达分析 根据On-LTα 基因全长序列,用Primer Premier 5.0 设计引物On-LTα-RT-F、On-LTα-RT-R , 内参引物为 On-LTα-actin-F 和On-LTα-actin-R (表1)。反应体系为10 μL,其中模板0.5 μL,引物(10 μmol/L)各 0.5 μL,2×SYBR Green Mix (Roche) 5 μL,双蒸水0.5 μL,每个样品设置5个复孔,反应条件为:95 ℃,10 s;95 ℃,5 s;58 ℃,15 s;72℃,20 s;循环35 次。实验结果依照 2-ΔΔCt法计算[15],用SPSS 20 进行统计学分析。

表1 引物名称和序列 Table 1 Primer sequences
2 结果与分析
2.1 On-LTα 基因cDNA 全长序列及氨基酸序列分析
On-LTα(GenBank 登录号:MK770358)cDNA序列全长为2 699 bp,ORF 包含705 bp,编码234个氨基酸(图1)。理论分子质量为21.77 ku,等电点为6.49。该蛋白平均亲水值(GRAVY)为-0.194,属亲水性蛋白。SMART 在线分析可知,该蛋白含有TNF 典型结构域(图2)。TMHMM Server 分析表明,该蛋白在第38 和60 位氨基酸之间存在一个跨膜结构域。通过SignalP 5.0 在线分析可知,该蛋白无信号肽。亚细胞定位预测主要分布于细胞膜。通过 PSITE 预测可知,该蛋白存在N-糖基化位点2 个、蛋白激酶C 磷酸化位点6 个、酪蛋白激酶 II 磷酸化位点5 个、酪氨酸激酶磷酸化位点1 个。
2.2 On-LTα 蛋白空间结构预测
预测的On-LTα 蛋白空间结构见图3。由图3可知,On-LTα 蛋白的234 个氨基酸残基中,包含33.33%的α 螺旋(蓝色h)、20.09%的延伸链(红色e)、11.11%的β 转角(绿色t)以及35.47%的无规则卷曲(黄色c),其中α 螺旋和无规则卷曲是该蛋白最大量的结构元件。通过构建的蛋白三维立体结构模型(图4)发现,该蛋白与人类的同源物具有一定保守性。
2.3 同源性比较及进化分析
利用ClustalX 软件将尼罗罗非鱼淋巴毒素α 与底鳉(Fundulus heteroclitus)、斑马鱼(Danio rerio)、人类(Homo sapiens)、南极鳕(Notothenia coriiceps)和大黄鱼(Larimichthys crocea)进行多序列比对,结果显示,该基因编码的蛋白在以上物种中相似度不高(图5)。结合NCBI 分析发现,尼罗罗非鱼On-LTα氨基酸序列与底鳉的相似度最高(50.69%),与南极鳕的相似度(47.35%),与大黄鱼的相似度(40.52%),与人类的相似度(27.93%),与斑马鱼的相似度最低(27.27%)。

图1 尼罗罗非鱼On-LTα 蛋白核苷酸及推导的氨基酸序列 Fig.1 Nucleotides and deduced amino acid sequences of protein On-Ltα in Nile Tilapia

图2 尼罗罗非鱼On-LTα 基因结构域示意图 Fig.2 Schematic of Nile Tilapia On-LTα

图3 尼罗罗非鱼On-LTα 蛋白二级结构预测 Fig.3 Predicted secondary structure of Nile Tilapia On-LTα
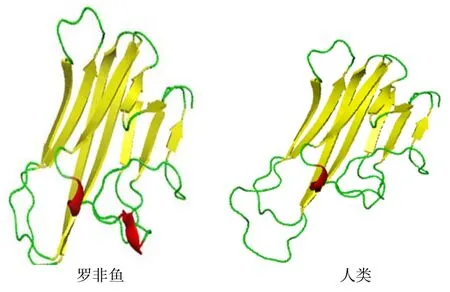
图4 尼罗罗非鱼On-LTα 蛋白与人类On-LTα 蛋白三维结构 Fig.4 The three-dimensional structures of On-LTα in Nile Tilapia (Lift) and Homo sapiens (Right)

图5 尼罗罗非鱼LTα 与其他物种LTα 氨基酸序列比对 Fig.5 Multiple alignments of LTα amino acid sequence of Nile Tilapia with other species
对尼罗罗非鱼(O.niloticus)、底鳉(F.heteroclitus)、褐家鼠(Rattus norvegicus)、牛(Bos taurus)、金丝猴(Rhinopithecus roxellana)、大棕蝙蝠(Eptesicus fuscus)、西部锦龟(Chrysemys picta bellii)、人(H.sapiens)和大黄鱼(Larimichthys crocea)等物种的LTα 基因所编码氨基酸进行类聚分析,结果见图6。图6 可见,尼罗罗非鱼的LTα 与底鳉分类地位最近,列举物种中鱼类全部聚为一支。
2.4 尼罗罗非鱼On-LTα 基因的组织分布
组织分布结果显示,On-LTα 基因在尼罗罗非鱼11 种组织中均有表达,在脾脏中的表达量最高,其次是心脏、肌肉、肠,而肝脏中的表达量最低(图7)。

图6 N-J 法构建On-LTα 氨基酸系统进化树 Fig.6 Phylogenetic tree of On-LTα by neighbour-joining method

图7 尼罗罗非鱼On-LTα 在不同组织中的表达 Fig.7 The expression of On-LTα of Nile Tilapia in different tissues
2.5 无乳链球菌刺激后尼罗罗非鱼脾脏中On-LTα表达变化
无乳链球菌刺激后,尼罗罗非鱼的脾脏On-LTα表达量在3、6、12、48 h 时显著性(P < 0.05)上 调,其中在3 h 时达到最大值(图8)。

图8 无乳链球菌感染尼罗罗非鱼后On-LTα 在脾脏中的表达 Fig.8 Temporal expression of On-LTα in spleen of Nile Tilapia after infected by Streptococcus agalactiae
2.6 LPS、Poly I:C 分别刺激NCC 后On-LTα 的表达
图9 表明,尼罗罗非鱼NCC 在LPS 和PolyI:C刺激后,NCC 中的On-LTα 均在12 h 时表达量明显上调。

图9 LPS 和PolyI:C 刺激后On-LTα 基因在NCC 中的表达 Fig.9 Expression of On-LTα in NCC of Tilapia after infected by LPS and PolyI:C
3 讨论
本研究克隆得尼罗罗非鱼淋巴毒素α 基因cDNA 全长,并推导出编码On-LTα 的氨基酸序列。分析显示,On-LTα 序列与其他几种鱼类之间的同源性较低(仅为27% ~ 50%),仅部分氨基酸和功能位点保守,但该基因结构上均有一个特征性的跨膜结构域和典型的TNF 家族保守结构域。而TNF 超家族配体和受体的结构及作用模式相对保守,其同源结构域在不同物种间的保守性也较低(约20% ~ 30%)[16]。
On-LTα 在健康尼罗罗非鱼的多种组织中均有表达,且在脾脏的表达量最高。鱼类脾脏是二级淋巴器官,On-LTα 对于调控二级淋巴器官的发育以及脾脏中T、B 细胞区域中基质细胞的发育有重要作用[17-18],On-LTα 基因敲除后的小鼠体内大部分淋巴结消失,脾脏结构严重紊乱[19-23]。本研究中,On-LTα
无乳链球菌是一种广泛分布于自然界的条件致病菌[24],主要是罗非鱼的细菌性病原体。研究表明,无乳链球菌灭活疫苗可诱导脾脏肿瘤坏死因子的表达量升高[25]。本研究中,健康尼罗罗非鱼感染无乳链球菌后,脾脏中On-LTα mRNA 表达量在3 h时显著上调,说明On-LTα参与了尼罗罗非鱼脾脏中的抗菌免疫过程。
NCC 在进化上是自然杀伤细胞(NK)的前体,功能与NK 细胞相似,主要来源于血液和淋巴器官,也是鱼类防御病原微生物侵入的第一道防线[26-27],该类细胞激活后可表达肿瘤坏死因子α,通过TNF-α与膜表面受体结合而发挥毒性作用,在免疫监视、增强鱼体非特异性免疫,提高抗病能力方面起重要作用[28]。On-LTα(TNFβ)与TNFα基因密切相关联,它们的序列相似(30%),可通过相同的受体发挥作用[29],且同一种细胞类型可同时表达TNFα和TNFβ,TNFβ还可调节TNFα的表达[2]。有研究表明,长牡蛎(Crassostrea gigas)血淋巴细胞中一个有典型TNF 结构域的分子(命名为CgTNF-1),其mRNA表达量在LPS 处理后12 h 显著增加[16]。本研究中NCC 在经LPS 处理后12 h,On-LTα mRNA 表达量也显著增加,与文献[16]一致,表明具有TNF 典型结构域的On-LTα可响应LPS 处理引起的免疫应答。经PolyI:C 刺激后12 h,NCC 内mRNA 表达量也显著上调。由此可见,On-LTα与NCC 的激活存在联系,具体机制需进一步研究证实。
本研究成功克隆尼罗罗非鱼中的On-LTα基因,并分析在无乳链球菌刺激下该基因在脾脏中的表达,以及尼罗罗非鱼NCC 经LPS 和Poly I:C 刺激后该基因在体内或体外的表达。结果表明,LTα基因参与了尼罗罗非鱼抗菌抗病毒的免疫过程。
[1]冯速, 邱樊, 张壮壮, 等.肿瘤坏死因子家族及其相关药物的研究进展[J].药学进展,2016,40(4):284-292.
[2]孙亚薇, 白志超, 朱秋雨, 等.肿瘤坏死因子β及其相关疾病的研究进展[J].中国医药生物技术,2017,12(4):365-368.
[3]FHU C W, GRAHAM A M, YAP C T, et al.Reed-Sternberg cell-derived lymphotoxin- activates endothelial cells to enhance T-cell recruitment in classical Hodgkin lymphoma[J].Blood,2014,124(19):2973-2982.
[4]RUDDLE N H.Lymphotoxin and TNF: How it all began—a tribute to the travelers[J].Cytokine & Growth Factor Reviews,2014,25(2):83-89.
[5]WARE C F.Network communications: lymphotoxins,LIGHT, and TNF[J].Annual Review of Immunology,2005,23(1):787-819.
[6]BUHRMANN C, SHAYAN P, AGGARWAL B B, et al.Evidence that TNF-β (lymphotoxin α) can activate the inflammatory environment in human chondrocytes[J].Arthritis Research&Therapy,2013,15(6):R202.
[7]GOMMERMAN J L, BROWNING J L,WARE C F.The Lymphotoxin Network: orchestrating a type I interferon response to optimize adaptive immunity[J].Cytokine Growth Factor Rev,2014,25(2):139-145.
[8]LAUENBORG B, CHRISTENSEN L, RALFKIAER U,et al.Malignant T cells express lymphotoxin α and drive endothelial activation in cutaneous T cell lymphoma[J].Oncotarget,2015,6(17):15235-49.
[9]KUMARAGURU U, DAVIS I A, DESHPANDE S, et al.Lymphotoxin alpha-/-mice develop functionally impaired CD8+ T cell responses and fail to contain virus infection of the central nervous system[J].Journal of Immunology,2001,166(2):1066-1074.
[10]KIM T J, UPADHYAY V, KUMAR V, et al.Innate lymphoid cells facilitate NK cell development through a lymphotoxin-mediated stromal microenvironment[J].Journal of Experimental Medicine, 2014, 211(7):1421-1431.
[11]IIZUKA K, CHAPLIN D D, WANG Y, et al.Requirement for membrane lymphotoxin in Natural Killer Cell development[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(11):6336-6340.
[12]ITO D, BACK T A, WILTROUT R, et al.Mice with a targeted mutation in lymphotoxin-alpha exhibit enhanced tumor growth and metastasis: impaired NK cell development and recruitment.[J].Journal of Immunology,1999,163(5):2809-2815.
[13]黄锦炉.罗非鱼无乳链球菌病病原学、病理学及cpsE基因的原核表达研究[D].四川:四川农业大学,2012.
[14]郑琦, 陈一锦, 黄瑜, 等.尼罗罗非鱼非特异性细胞毒性细胞(NCC)分离条件的优化[J].广东海洋大学学报,2017,37(3):123-126.
[15]LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) Method[J].Methods,2001,25(4):402-408.
[16]孙颖.长牡蛎肿瘤坏死因子(CgTNF-1)免疫调节机制的初步研究[D].青岛: 中国科学院研究生院(海洋研究所),2014.
[17]UPADHYAY V, FU Y X.Lymphotoxin signalling in immune homeostasis and the control of microorganisms[J].Nature Reviews Immunology, 2013,13(4):270-279.
[18]NGO V N, KORNER H, GUNN M D, et al.Lymphotoxin α/β and tumor necrosis factor are required for stromal cell expression of homing chemokines in b and t cell areas of the spleen[J].Journal of Experimental Medicine,1999,189(2):403-412.
[19]BANKS T A, ROUSE B T, KERLEY M K, et al.Lymphotoxin-alpha-deficient mice.Effects on secondary lymphoid organ development and humoral immune responsiveness[J].Journal of Immunology,1995,155(4):1685-93.
[20]ALIMZHANOV M B, KUPRASH D V,KOSCOVILBOIS M H,et al.Abnormal development of secondary lymphoid tissues in lymphotoxin β-deficient mice[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(17):9302-9307.
[21]MACKAY F, MAJEAU G R, LAWTON P, et al.Lymphotoxin but not tumor necrosis factor functions to maintain splenic architecture and humoral responsiveness in adult mice[J].European Journal of Immunology,1997,27(8):2033-2042.
[22]RENNERT P D, BROWNING J L, MEBIUS R, et al.Surface lymphotoxin α/β complex is required for the development of peripheral lymphoid organs[J].Journal of Experimental Medicine,1996,184(5):1999-2006.
[23]KONI P A, SACCA R, LAWTON P,et al.Distinct roles in lymphoid organogenesis for lymphotoxins alpha and beta revealed in lymphotoxin beta-deficient mice[J].Immunity,1997,6(4):491-500.
[24]刘志刚, 可小丽, 卢迈新, 等.罗非鱼无乳链球菌强毒株基因组表达文库的构建及鉴定[J].南方水产科学,2015,11(6):34-40.
[25]付天增.无乳链球菌和海豚链球菌灭活疫苗对罗非鱼的免疫效果[D].济南: 山东农业大学,2017.
[26]魏世娜.红笛鲷NCCRP-1 基因的克隆和表达分析[D].湛江: 广东海洋大学,2010.
[27]魏世娜, 简纪常, 吴灶和, 等.鱼类非特异性细胞毒性细胞(NCC)的研究进展[J].中国水产科学, 2010,17(2):374-380.
[28]甘桢.尼罗罗非鱼T 细胞激活相关基因的功能研究[D].湛江: 广东海洋大学,2015.
[29]AGGARWAL B B,KOHR W J,HASS P E,et al.Human tumor necrosis factor.Production, purification, and characterization.[J].Journal of Biological Chemistry,1985,260(4):2345-54.
Cloning and Expression Analysis of Gene Lymphotoxin α in Nile Tilapia (Oreochromis niloticus)
ZOU Zi-hong, ZHENG Qi, HUANG Yu, TANG Ju-fen, WANG Bei, LU Yi-shan, JIAN Ji-chang, CAI Jia
(Fisheries College of Guangdong Ocean University, Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals & Key Laboratory of Control for Diseases of Aquatic Economic Animals of Guangdong Higher Education Institutes, Zhanjiang 524088, China)
【Objective】 To clone and analyze the lymphotoxin alpha gene (LTα), analyze the transcript distribution in different tissues, and to explore the important role of lymphotoxin alpha (LTα) in the antibacterial and antiviral immunity of Oreochromis niloticus.【Method】The full-length cDNA of lymphotoxin α from Nile Tilapia (On-LTα)was obtained by RACE.The sequence of On-LTα was analyzed by bioinformatics method.The tissue distribution and expression profiles of On-LTα following Streptococcus lactobacillus immunization were investigated by Real-time quantitative PCR.Furthermore, On-LTα transcript levels in the isolated non-specific toxic cells (NCC) after lipopolysaccharide (LPS) and Poly I:C stimulation were also examined.【Results】On-LTα gene sequence is 2 699 bp including a 705 bp open reading frame (ORF) which encodes a polypeptide of 234 amino acids.(GenBank accession number: MK770358).On-LTα protein belonged to the transmembrane protein and possessed a conserved domain of the tumor necrosis factor (TNF) family.Quantification PCR found that On-LTα was constitutively expressed in all 11 tissues tested.In the healthy Nile tilapia, the highest expression being detected in the spleen.The relative expression levels of On-LTα in the spleen were significantly increased during S.agalactia infection.The isolated NCCs cultured in vitro could also induce the significant upregulation of On-LTα under LPS and Poly I:C stimulation.【Conclusion】On-LTα might be involved in the antimicrobial and antiviral immune responses of tilapia.
Oreochromis niloticus; gene lymphotoxin alpha; gene clone; gene expression; Non-specific cytotoxic cell (NCC)
Q954.4
A
1673-9159(2019)06-0001-08
10.3969/j.issn.1673-9159.2019.06.001
邹子鸿,郑琦,黄瑜,等.尼罗罗非鱼淋巴毒素α基因克隆与表达分析[J].广东海洋大学学报,2019,39(6):1-8.
2019-06-28
国家自然科学基金(31302226, 31572651);广东海洋大学优秀硕士学位论文培育项目(201833)
邹子鸿(1994―),男,硕士研究生,研究方向为水生动物免疫学。E-mail: 1220140057@qq.com
蔡佳,男,副教授,博士,研究方向为水生动物免疫学。E-mail: matrix924@foxmail.com
(刘庆颖、刘胐)

