欧前胡素对IgE诱导的RBL-2H3过敏性炎症细胞模型的免疫调节作用
龙彤, 宋鹏, 梁培育, 欧善际, 王声兴
(1.海口市中医医院耳鼻喉科,海南海口570216;2.海南医学院第一附属医院泌尿外科,海南海口570102)
近年来,随着过敏性鼻炎(allergic rhinitis,AR)患病率的显著升高,AR的防治愈来愈受重视[1]。肥大细胞是AR发病过程中的主要效应细胞,活化的肥大细胞分泌多种促进局部炎症反应的细胞因子[2,3]。抑制肥大细胞功能是缓解AR进展的有效途径。
欧前胡素(imperatorin)属于6,7-呋喃香豆素,是常用中药蛇床子、白芷、防风、当归、明党参、独活的主要药效成分之一[4],也是元胡止痛片、伤痛宁片、通窍鼻炎片、天麻头痛片等中成药的质检标准成分[5-10]。欧前胡素具有广泛的药理作用,如镇痛、抗炎、抗菌、抗肿瘤等[4]。研究发现,欧前胡素可有效抑制肥大细胞活化及脱颗粒,从而发挥治疗过敏性炎症的作用[11]。
大鼠嗜碱性白血病细胞(ratbasophilic leukemia cells,RBL-2H3)是一种常用的肥大细胞脱颗粒体外检测细胞模型,其表面表达IgE高亲和力受体,可用于过敏原鉴定、诊断和潜在免疫治疗分析[12-14]。本研究采用IgE诱导RBL-2H3细胞活化脱颗粒这一致敏模型,模拟AR鼻部变态反应,探讨不同剂量的欧前胡素对RBL-2H3细胞脱颗粒及细胞因子分泌的影响,以期阐明欧前胡素治疗AR的作用机制,现将研究结果报道如下。
1 材料与方法
1.1 细胞及培养 大鼠嗜碱性白血病细胞RBL-2H3购自中国科学院上海细胞库。将装有RBL-2H3细胞的冻存管从液氮罐中取出,复苏后培养于含体积分数10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM中,并放置于37℃,体积分数5%CO2培养箱中培养。
1.2 药物与试剂 欧前胡素标准品购自北京索莱宝科技有限公司。大鼠组胺、白细胞介素(IL)-3、IL-4、IL-6、肿瘤坏死因子α(TNF-α)、环氧化酶2(COX-2)和干扰素γ(IFN-γ)酶联免疫吸附分析(ELISA)试剂盒均购自武汉华联科生物技术有限公司;DMEM购自美国HyClone公司;胎牛血清购自美国Gibco公司;抗二硝基酚(dinitrophenol,DNP)IgE单克隆抗体(anti-DNP IgE)、4-methylumbelliferyl-N-acetyl-β-D-glucosaminide试剂购自美国Sigma公司;牛血清白蛋白(DNP-BSA)购自圣克鲁斯生物技术(上海)有限公司;Trizol试剂购自美国Ambion公司;反转录试剂盒购自大连TARAKA公司;SYBR Green PCR试剂盒购自美国KAPA Biosystems。PCR引物由南京金斯瑞生物科技有限公司合成。
1.3 仪器DMIL LED倒置显微镜(德国徕卡公司);MK3酶标仪(芬兰LabsystemsMultiskan MS公司);CFX-Connect96荧光定量PCR仪(美国Bio-Rad公司);JY045-3C凝胶成像系统(北京君意公司)。
1.4 四甲基偶氮唑盐(MTT)测定细胞活力 收集对数生长期的RBL-2H3细胞,调整细胞密度为5×104个/mL接种于96孔板中,90μL/孔,置于37℃、体积分数5%CO2培养箱中培养过夜,分别加入不同剂量(0、2、5、10、15、20μmol/L)的欧前胡素,每组设置3个复孔。培养24 h后,每孔加入20μL浓度为5mg/mL的MTT溶液,继续培养4 h。弃上清液,各孔加入150μL二甲基亚砜溶液,摇床振荡10min,使结晶充分溶解。酶标仪测定各孔于490 nm处的吸光度(D),计算各组细胞的生长抑制率。公式:生长抑制率=(D0μmol/L-D其他浓度)/D0μmol/L×100%。
1.5 模型构建[15]及给药 收集生长状况良好的RBL-2H3细胞,胰蛋白酶消化细胞,并调整细胞密度为1×106个/mL,接种于48孔板中,200μL/孔。除正常对照组外,其他组均加入体积分数10%胎牛血清和200 ng/mL anti-DNP IgE溶液,培养过夜。PBS清洗3次,将欧前胡素溶于台式液中,按照低浓度(5μmol/L)、中浓度(10μmol/L)和高浓度(15μmol/L)分别加入培养板中,继续孵育1 h,加入500 ng/mLDNP-BSA刺激RBL-2H3细胞。
1.6底物显色法测定脱颗粒率DNP-BSA刺激各组RBL-2H3细胞6 h后,回收细胞培养液上清,再加入200μL含0.1%TritonX-100的台式液裂解细胞。将上清液和裂解液分别加入96孔板中,每孔加入100μL 12 mmol/L 4-methyl-umbelliferyl-N-acetyl-β-D-glucosaminide试剂作为底物,37℃条件下反应30min,酶标仪测定各孔D(450 nm)。脱颗粒计算公式:脱颗粒率=D上清(/D上清+D细胞裂解液)×100%。
1.7 ELISA检测细胞培养上清液中组胺、IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ的释放水平DNP-BSA刺激各组RBL-2H3细胞15min后,回收细胞培养液上清,按照ELISA试剂盒说明书测定上清液中的组胺含量。DNP-BSA刺激细胞24 h后,按照ELISA试剂盒说明书操作,测定细胞上清液中的IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ浓度。
1.8 逆转录聚合酶链反应(RT-PCR)法检测细胞内IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ mRNA表达量DNP-BSA刺激各组细胞24 h后,1 000 r/min离心5min,弃上清。PBS清洗3次,采用Trizol试剂提取细胞总RNA,根据反转录试剂盒说明操作将RNA反转录为cDNA,以cDNA为模板进行RT-PCR扩增。以GAPDH为内参基因,2-△△Ct法计算各基因mRNA相对表达量(p)。各基因引物序列见表1。
1.9 统计方法 采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差()表示,多组比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用SNK检验,以P<0.05为差异有统计学意义。
2 结果
2.1 欧前胡素对RBL-2H3细胞生长的影响MTT法检测不同浓度的欧前胡素干预RBL-2H3细胞24 h后的细胞活力,结果如图1所示,随着浓度的升高,细胞抑制率逐渐升高。根据本实验结果,20μmol/L欧前胡素的细胞生长抑制率陡增,考虑到该浓度对细胞毒性作用大,故筛选欧前胡素5μmol/L为低剂量组干预浓度,10μmol/L为中剂量组浓度,15μmol/L为高剂量组浓度。
2.2 欧前胡素对RBL-2H3细胞脱颗粒的影响 与正常对照组比较,模型组脱颗粒率显著升高(P<0.05)。与模型组比较,不同剂量组的脱颗粒率明显降低(P<0.05或P<0.01),且高剂量组效果更显著。提示欧前胡素可抑制RBL-2H3细胞脱颗粒行为,并呈一定的剂量依赖性。结果见图2。

表1 RT-PCR引物序列Figure 1 RT-PCR primer sequences

图1 不同浓度欧前胡素对RBL-2H3细胞生长的影响Figure 1 The effectof different concentrations of im peratorin on grow th of RBL-2H3 cells(,n=3)
2.3 欧前胡素对RBL-2H3细胞分泌因子的影响 与正常对照组比较,模型组RBL-2H3细胞上清液中组胺、IL-3、IL-4、IL-6、TNF-α和COX-2水平显著升高(P<0.05),而IFN-γ含量显著降低(P<0.05)。经不同浓度欧前胡素处理过的RBL-2H3细胞上清液中组胺、IL-3、IL-4、IL-6、TNF-α和COX-2水平显著低于模型组(P<0.05),IFN-γ含量显著高于模型组(P<0.05),且呈现剂量依赖性。结果见表2。

图2 欧前胡素对RBL-2H3细胞脱颗粒的影响Figure 2 The effectof imperatorin on degranulation of RBL-2H3 cells(,n=3)
2.4 欧前胡素对RBL-2H3细胞分泌因子基因表达水平的影响 通过RT-PCR法检测RBL-2H3细胞内IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ基因表达水平,结果如图3所示。与正常对照组比较,模型组IL-3、IL-4、IL-6、TNF-α、COX-2 mRNA表达水平升高,IFN-γmRNA表达水平降低,差异均有统计学意义(P<0.01)。与模型组比较,欧前胡素低、中、高剂量组IL-3、IL-4、IL-6、TNF-α、COX-2 mRNA表达水平降低,IFN-γ mRNA表达水平升高(P<0.05或P<0.01),且呈剂量依赖性。
表2 各组RBL-2H3细胞释放组胺、IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ水平比较Table 2 Com parison of the release levels ofhistam ine,IL-3,IL-4,IL-6,TNF-α,COX-2 and IFN-γin RBL-2H3 cells of various groups(,n=3)

表2 各组RBL-2H3细胞释放组胺、IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γ水平比较Table 2 Com parison of the release levels ofhistam ine,IL-3,IL-4,IL-6,TNF-α,COX-2 and IFN-γin RBL-2H3 cells of various groups(,n=3)
①P<0.05,与正常对照组比较;②P<0.05,与模型组比较
组别正常对照组模型组欧前胡素低剂量组欧前胡素中剂量组欧前胡素高剂量组组胺[ρ/(ng·mL-1)]0.43±0.006 2.68±0.008①1.86±0.003②1.56±0.016②0.87±0.014②IL-3[ρ/(pg·mL-1)]437.11±67.70 2426.66±16.23①1323.62±13.18②1001.49±12.47②709.48±14.95②IL-4[ρ/(pg·mL-1)]57.79±1.37 239.65±2.05①179.30±1.28②142.51±1.50②70.63±0.72②IL-6[ρ/(pg·mL-1)]43.26±1.34 240.22±1.70①179.85±1.83②155.17±1.16②109.39±1.28②TNF-α[ρ/(pg·mL-1)]43.01±2.10 357.53±1.16①248.44±2.50②206.38±0.75②116.27±2.16②COX-2[ρ/(pg·mL-1)]441.67±7.77 1774.01±18.98①1285.25±18.31②1012.85±20.64②659.38±11.95②IFN-γ[ρ/(pg·mL-1)]202.92±0.95 47.55±1.56①83.97±0.64②115.08±1.16②162.89±0.92②
3 讨论
IgE诱导肥大细胞活化、脱颗粒,肥大细胞活化脱颗粒是Ⅰ型超敏反应的关键步骤,抑制RBL-2H3细胞嗜碱性颗粒的脱落可有效抑制炎症反应[15]。本研究检测并计算了不同剂量欧前胡素处理下的RBL-2H3细胞脱颗粒率,结果发现,与正常对照组比较,模型组细胞脱颗粒率显著升高,而经过欧前胡素干预后,RBL-2H3细胞脱颗粒率下降,且呈现出剂量依赖性,高剂量组下降更明显。提示欧前胡素可抑制过敏性炎症细胞模型嗜碱性颗粒的脱落。肥大细胞活化、脱颗粒的同时也会释放组胺,并分泌与炎症反应相关的细胞因子。
组胺是一种致炎致敏因子,与组胺受体结合后发挥其活性作用,导致炎症反应、变态反应产生[16]。组胺是AR临床症状的核心炎性因子,刺激鼻黏膜末梢神经进而引起鼻痒和打喷嚏,增大血管通透性引起鼻分泌亢进,并刺激炎性细胞因子和黏附因子的分泌[17]。
Th1/Th2细胞比例失衡参与了AR的发生发展过程,IFN-γ为Th1细胞分泌抗炎因子,而IL-4则为Th2细胞分泌的代表性促炎细胞因子,因此,IFN-γ/IL-4水平的失衡与AR密切联系[18]。刘萍等[19]研究发现,AR模型小鼠血清中IL-4、TNF-α水平显著升高,而IFN-γ水平显著降低。IgE引起的AR早期过敏反应中,产生的TNF-α等原炎性因子刺激Th2细胞分泌促炎细胞因子[20]。Feng等[21]发现IgE介导的RBL-2H3过敏性炎症细胞模型中IL-4、TNF-α释放增多,COX-2表达升高,从而导致COX-2产物前列腺素E2(PGE2)和前列腺素D2(PGD2)的水平升高,PGE2的增加可能介导辅助T细胞分泌炎性因子加剧炎症反应,故抑制COX-2有助于抗过敏作用。IL-3和IL-6作为炎性细胞因子,在AR动物模型中的表达也出现显著上调[22,23]。在本研究中,IgE诱导的RBL-2H3过敏性炎症细胞模型释放的组胺、IL-3、IL-4、IL-6、TNF-α、COX-2水平显著高于正常对照组,且其在细胞内的基因表达也显著上调,而IFN-γ的表达下调,提示模型组细胞炎性反应加剧。经过不同剂量的欧前胡素治疗后,各炎症指标的表达及释放均受到显著抑制,而参与免疫调节的IFN-γ的表达显著上调,且呈现出一定的剂量依赖性。
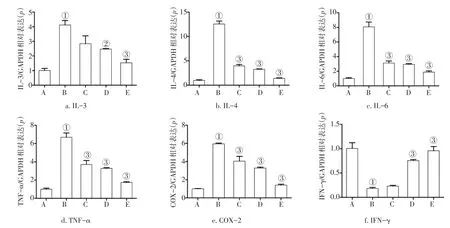
图3 各组RBL-2H3细胞IL-3、IL-4、IL-6、TNF-α、COX-2和IFN-γmRNA表达水平比较Figure 3 Com parison of them RNA expression levels of IL-3,IL-4,IL-6,TNF-α,COX-2 and IFN-γin RBL-2H3 cells of various groups(,n=3)
综上所述,欧前胡素可显著抑制RBL-2H3细胞脱颗粒,并降低组胺及各炎症指标的释放,促进IFN-γ表达,通过免疫调节降低细胞的炎症反应。该研究结果可为AR的临床治疗提供理论基础,但仍待进一步在动物模型中进行验证。

