二苯乙烯苷调控MAPKs信号通路诱导大肠癌SW116细胞凋亡
雷 锐,刘 艳
0 引言
大肠癌(Colorectal cancer)是常见的消化道恶性肿瘤,由美国癌症协会发布的临床调查数据显示,全球大肠癌的发病率及死亡率占恶性肿瘤的第5位,且每年新出现的患者例数在不断增加[1-2]。目前大肠癌治疗的手段以手术为主,化疗是重要的辅助治疗方案。然而临床发现大多数化疗药物效果不佳,毒副作用较多,术后患者生存率较低[3-4]。细胞外信号调节蛋白激酶(ERK)、c-Jun 氨基末端激酶(JNK)、p38 MAPK是丝裂原活化蛋白激酶家族(MAPKs)的3个成员,介导肿瘤细胞的增殖、凋亡等多个生物过程[5]。MAPKs是连接细胞膜表面受体和基因表达的重要信号调节酶,已发现哺乳动物肠道组织细胞内至少存在4种MAPKs,即ERK、c-Jun氨基末端激酶(JNK1/JNK2)和p38 MAPK(α,β)和ERK5/BMK1,并且上述信号途径还参与大肠肿瘤细胞增殖、分化、侵袭及迁移等生物学过程[6]。二苯乙烯苷(2,3,5,4′-etrahydroxy stilbene-2-O-β-D-glucoside,THSG)主要来源于蓼科蓼族植物何首乌,属于一种具有天然生物活性的抗毒素,其在抗氧化、抗炎症方面发挥着重要的生物学作用[7-8]。此外,THSG在抗肿瘤方面也有较高的生物活性,包括通过调节PI3K/Akt信号通路抑制乳腺癌细胞增殖[9];通过调节MAPKs信号通路抑制黑色素瘤细胞增殖[10]。本文以大肠癌SW116细胞为研究对象,探讨了THSG对SW116细胞增殖、凋亡及MAPKs信号通路的影响。
1 材料与方法
1.1 主要试剂 大肠癌SW116细胞购自ATCC;DMEM培养基购自Invitrogen公司;胰蛋白酶、胎牛血清购自Gibco公司;二苯乙烯苷购自上海宝曼生物科技有限公司,批号:6634-52-6;Western blot试剂购自武汉谷歌生物有限公司;CCK8试剂盒购自上海工程生物公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物有限公司,批号:KGA106;兔抗p38、ERK、JNK、p-p38、p-ERK、p-JNK、Pro-caspase 3、Cleaved-PARP和β-actin抗体购自英国Abcam公司;JNK特异性抑制剂(SP600125)、p38特异性抑制剂(SB203580)和ERK特异性抑制剂(U0126)购自美国Sigma公司。
1.2 SW116细胞培养 将冻存于液氮中的SW116细胞株进行复苏,待细胞贴壁饱和至适当密度后进行传代培养,具体操作如下:从培养箱中取出培养瓶至超净工作台,无菌PBS清洗2遍,加入适量浓度的胰蛋白酶消化至细胞变圆,然后加入新鲜培养液终止消化,将细胞吹散后转移至离心管中,1 000 r/min离心5 min,加入含10%胎牛血清的完全培养液吹散分装于2个培养瓶中,置于5% CO2、37 ℃恒温条件下培养。
1.3 CCK8实验检测细胞增殖 把生长良好的细胞消化、重悬、接种于96孔板中,每孔加入200 μl细胞混悬液,边缘孔用200 μl PBS填满后培养过夜。细胞贴壁后,加入含不同浓度THSG (0、5、10、20、40、80、120 mmol/L)的培养液处理SW116细胞24、48、72 h后,取出96孔板,弃上清,每孔加入20 μl CCK8溶液,孵育2 h后采用酶标仪检测450 nm处的吸光度OD值,并计算细胞活力。
1.4 流式细胞仪检测细胞周期 把生长良好的细胞消化、重悬、接种于6孔板中,每孔加入2 ml细胞混悬液培养24 h,加入含不同浓度THSG (0、10、20、40 mmol/L)的培养液处理SW116细胞24 h后,收集细胞,悬浮细胞直接转移至离心管,贴壁细胞胰酶消化后转移至离心管,再用PBS清洗细胞3次,5 000 r/min离心6 min,收集细胞;将细胞重悬后分别加入5 μl Annexin V和 PI避光染色,利用流式细胞仪检测各组细胞凋亡率。
1.5 Western blot分析蛋白表达 把对数生长期细胞消化、重悬、接种于6孔板中,每孔加入2 ml细胞混悬液培养24 h,加入含不同浓度THSG (0、10、20、40 mmol/L)的培养液处理SW116细胞24 h后,收集细胞,加入裂解液冰上充分裂解30 min,经超声破碎后离心取上清,100 ℃煮沸5 min使蛋白充分变性。蛋白经SDS-PAGE胶分离后将其转移至NC膜上,5%脱脂牛奶室温封闭2 h。TBST洗膜2次后孵育一抗,4 ℃过夜。TBST洗膜3次,每次10 min,室温孵育二抗1.5 h;TBST洗膜3次,每次10 min,ECL发光液浸泡3 min后进行曝光。
1.6 特异性抑制剂实验 取对数期细胞接种于6孔板,待细胞贴壁生长至60%左右时,加入p38、JNK、ERK特异性抑制剂SB203580 (10 μmol/L)、SP600125 (5 μmol/L)和U0126 (8 μmol/L)单独干预细胞1 h,然后THSG (20 mmol/L)处理24 h,流式细胞仪检测细胞凋亡率,Western blot分析相关蛋白表达。

2 结果
2.1 THSG抑制SW116细胞增殖 CCK8实验发现THSG能明显抑制SW116细胞增殖,见图1。
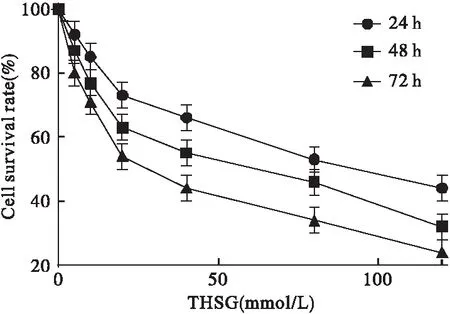
图1 THSG对SW116细胞增殖的影响
由图1可见,THSG浓度在5~120 mmol/L范围内,能够明显抑制SW116细胞的增殖,其抑制作用呈现剂量依赖性。对于同一剂量的THSG而言,随着干预时间的延长,细胞的存活率降低,表现出时间依赖性。
2.2 THSG诱导SW116细胞凋亡 流式细胞仪检测SW116细胞凋亡情况,见图2。不同剂量(0、10、20、40 mmol/L)THSG处理SW116细胞24 h后,细胞凋亡率分别为2.6%±1.2%、7.9%±1.8%、29.4%±5.1%、47.4%±5.6%,各药物处理组与对照组相比差异有统计学意义(P<0.05)。

图2 THSG对SW116细胞凋亡的影响
2.3 THSG对SW116细胞中凋亡相关蛋白Pro-caspase 3和Cleaved-PARP表达的影响 Western blot检测SW116细胞中凋亡相关蛋白Pro-caspase 3和Cleaved-PARP表达水平,见图3。发现THSG对SW116细胞中Cleaved-PARP蛋白表达有诱导作用,而对Pro-caspase 3蛋白表达有抑制作用,与对照组相比差异有统计学意义(P<0.05)。
2.4 THSG对SW116细胞中MAPKs信号通路的影响 THSG干预组与对照组比较,SW116细胞中p-ERK的相对表达水平显著降低,而p-p38和p-JNK的相对表达水平显著升高(P<0.05),变化程度表现出浓度依赖性。见图4。
2.5 抑制剂改变THSG对MAPKs信号通路及细胞凋亡 分别采用p38、JNK和ERK的特异性抑制剂SB203580、SP600125和U0126单独干预SW116细胞1 h,之后THSG处理24 h。实验结果发现SB203580、SP600125可以减弱THSG对p38、JNK磷酸化的诱导作用,U0126则增强了THSG对ERK磷酸化的抑制作用,见图5。采用流式细胞仪对细胞凋亡率进行检测,发现各组药物干预细胞的凋亡率如下:对照组(3.4%±1.3%)、THSG组(30.7%±5.6%)、SB203580组(6.4%±1.8%)、SP600125组(4.6%±1.4%)、U0126组(37.6%±5.8%)、THSG+SB203580组(15.3%±4.2%)、THSG+SP600125组(18.7%±4.7%)、THSG+U0126组(46.9%±6.2%),其中THSG组与THSG+抑制剂组相比差异有统计学意义(P<0.05)。
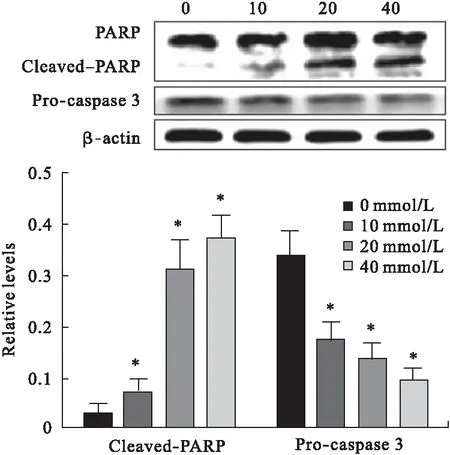
图3 THSG对SW116细胞中凋亡蛋白表达的影响
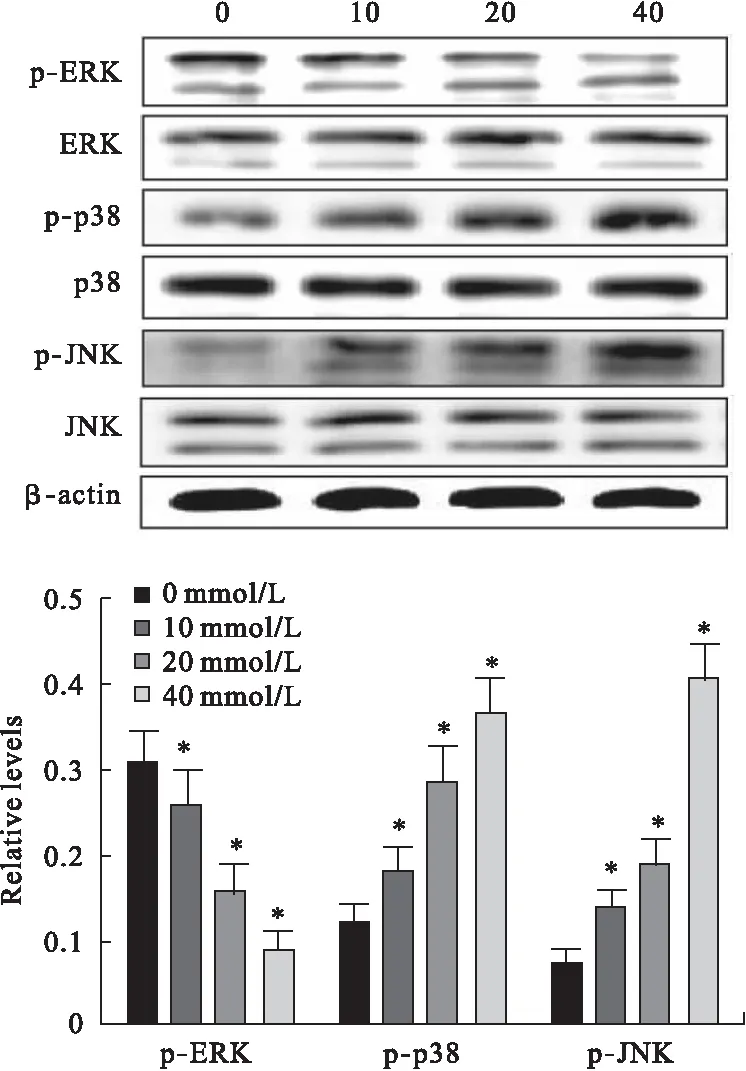
图4 THSG对SW116细胞MAPKs信号通路的影响
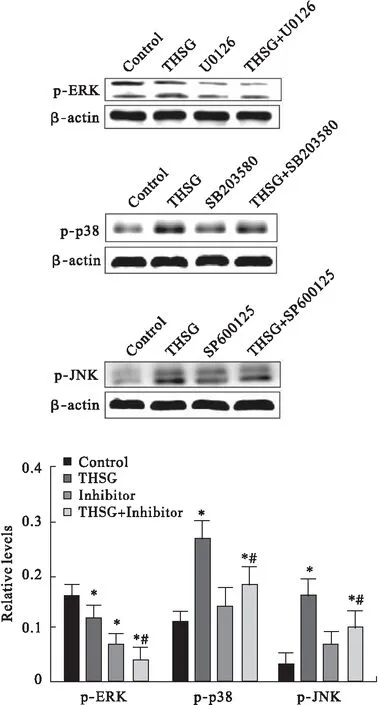
图5 特异性抑制剂对p38、JNK和ERK信号途径活化的影响
3 讨论
大肠癌在肿瘤致死亡数中所占比例较高,术后5年生存率为60%,若出现肿瘤细胞转移,患者5年生存率不到10%[11-12]。早期较多研究发现,中药具有多种药理作用,如联合化疗药物可增敏减毒、降低肿瘤的复发转移等,在大肠癌的治疗中也表现出较高的生物活性[13]。其中二苯乙烯苷(THSG)的药理活性主要表现在抗炎和抗氧化等方面,近年来亦有THSG抗肿瘤活性的研究[9-10]。
本文采用大肠癌SW116细胞为体外研究对象,考察了THSG对SW116细胞增殖凋亡的影响。CCK8实验发现,THSG在5~120 mmol/L范围内对SW116细胞的增殖活性均有抑制作用,在THSG浓度低于50 mmol/L时,细胞增殖抑制率低于50%,并且没有发现明显的萎缩等生长不良现象,因此,后续实验采用10、20、40 mmol/L的THSG处理细胞。CCK8实验结果发现,THSG呈时间和浓度依赖的方式抑制SW116细胞增殖;流式细胞仪分析SW116细胞的凋亡率发现,THSG处理SW116细胞后,大肠癌细胞的凋亡率均有不同程度的增加。PARP和caspase 3蛋白表达调控着细胞凋亡过程,在肿瘤细胞凋亡发生过程PARP的切割显著增强,而Pro-caspase 3的表达亦因切割而明显降低[14-15]。本实验结果也发现,THSG能显著诱导PARP切割,抑制Pro-caspase-3蛋白表达,促使SW116细胞凋亡发生。
ERK、JNK和p38 MAPK属于MAPKs家族的3个成员,介导着肿瘤细胞的增殖、凋亡及迁移等多个生物过程[5-6]。有关报道证实JNK和p38 信号通路激活能够导致细胞凋亡[16],然而ERK信号传导活化可以诱导细胞增殖及分化,属于细胞存活的正向调节子[17]。然而,已有研究提出,THSG能够通过调节MAPKs信号通路抑制肿瘤细胞增殖[10]。使用p38、JNK和ERK的特异性抑制剂SB203580、SP600125和U0126抑制MAPKs信号通路活化,也可以证实p38、JNK和ERK信号传导途径参与肿瘤细胞凋亡过程。本研究发现,THSG干预SW116细胞后,细胞中ERK的磷酸化水平显著降低,而p38和JNK的磷酸化水平显著升高,而且ERK、p38和JNK磷酸化水平变化与THSG的用药剂量呈正相关。为了进一步证实MAPKs信号通路确实介导了THSG诱导大肠癌细胞的凋亡,本实验采用p38、JNK和ERK特异性抑制剂阻断MAPKs信号传导,流式细胞仪观察SW116细胞凋亡情况。结果发现,阻断p38、JNK磷酸化可以部分逆转THSG诱导大肠癌细胞凋亡;ERK特异性抑制剂能增强THSG诱导大肠癌细胞的凋亡。总之,THSG通过激活p38和JNK信号传导,抑制ERK信号途径,诱导大肠癌SW116细胞凋亡。

