丙型肝炎病毒单基因型感染与非单基因感染患者基因型分析
石玉如,岳莉,姚余有,赵长城,谷妍,刘杨,王云,戚应杰
(1.安徽省立医院感染病院,安徽 合肥 230022;2.安徽医科大学,安徽 合肥 230032)
丙型肝炎病毒(hepatitis C virus, HCV)属于黄病毒科肝炎病毒属,是引起全球慢性丙型肝炎、肝硬化甚至肝细胞癌的重要因素之一[1-2]。HCV 基因组为单股正链RNA,易变异,目前可分为7 种基因型及数十种不同的基因亚型[3]。据文献报道,不同HCV 的基因分型在临床诊断、治疗和预后康复方面具有重要的意义[4-5]。为讨论不同HCV 基因分型与HCV 载量、肝功能、凝血及自身抗体之间的关系,本文对114 例HCV 基因型分布及相关血清学指标进行分析,现报道如下。
1 资料与方法
1.1 临床资料
选取2015年7月—2018年4月安徽省立医院感染病院接诊的慢性丙型肝炎患者114 例。其中,男性53 例,女性61 例;平均年龄51.8 岁。入选患者均符合我国2015年版《丙型肝炎防治指南》[6]的诊断标准,通过相关检测,排除其他血液病及肝炎重叠感染病例。
1.2 仪器与试剂
美国应用生物系统公司ABI-7300 基因扩增仪,厦门安普利生物工程有限公司9800 全自动医用PCR系统及全自动核酸提取工作站,日本日立公司7180生化分析仪,北京赛科希德科技股份有限公司SF-8100 血凝仪、迈瑞医疗国际有限公司BC-6900 全自动血球仪,江苏浩欧博生物医药股份有限公司全自动化学发光纳米磁微粒自身抗体检测仪。丙型肝炎分型核酸提取试剂及基因分型检测试剂盒由泰普生物科学(中国)有限公司提供,其余试剂均选用原厂配套试剂。
1.3 检测方法
1.3.1 样本准备 收集患者空腹静脉血4 份,每份5ml。其中2 份血样置于促凝管中,经4000r/min 离心10min,取上层血清分别用于HCV-RNA 含量、HCV 基因型检测、肝功能指标检测以及自身抗体检测;另外1 份血样置于枸橼酸钠抗凝管中,经3000r/min 离心8min,取上层血浆用于凝血酶原时间(PT)、凝血酶 原活动度(PTA)检测;最后1 份血样置于EDTA 抗凝管中,混匀后用于血细胞计数测定。
1.3.2 HCV 基因分型检测 HCV-RNA 提取采用硅胶膜过柱纯化技术,从血清样本中提取病毒RNA,提取后的RNA 运用一步法逆转录聚合酶链反应(RTPCR)技术和Taqman 探针技术,实时检测荧光信号,可判断样本为HCV 1b、2a、3a、3b 和6a 亚型单独感染或混合感染,试剂盒检测下限为1000copy/ml。
1.3.3 HCV-RNA 定量检测 HCV-RNA 提取采用安普利全自动核酸提取工作站及配套试剂,提取后的RNA,利用安普利9800 全自动医用PCR 系统进行定量分析。线性范围为1×102~5×107copy/ml;定量结果超过线性范围(>5×107copy/ml)以5×107copy/ml计算。
1.3.4 相关血清学指标检测 肝功能检测:谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转移酶(GGT);凝血功能检测:PT、PTA、血小板(PLT);自身抗体检测:抗核抗体(ANA)、抗U1 小核糖核蛋白抗体(抗RNP)、抗狼疮细胞抗体(抗Sm)、抗52 kD 的多肽条段(抗Ro-52)、着丝粒蛋白B 抗体(抗CENP B)、M2 型线粒体抗体(AMA-M2)、抗肝/肾微粒体1 型抗体(LKM1)均按厂家说明书进行操作,上机检测,质控均在控。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以中位数和四分位数[M(P25,P75)]表示,比较用秩和检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 HCV 基因分布情况
对114例丙型肝炎患者HCV进行基因分型。其中,1b 型92 例,占80.70%;2a 型8 例,占7.01%;6a 型2 例,占1.75%;2a+6a 型5 例,占4.39%;3a+3b 型6例,占5.26%;未分型1 例,占0.88%(见图1)。单基因型102 例,非单基因型11 例,未分型1 例。
2.2 HCV 基因分型与HCV-RNA 病毒载量的比较
单基因型组与非单基因型组HCV-RNA 比较,差异无统计学意义(Z=0.343,P=0.732)。见表1。
2.3 HCV 单基因型感染患者与非单基因型感染患者相关肝功能指标的比较
HCV 单基因型感染患者与非单基因型感染患者ALT 结果比较,差异有统计学意义(P<0.05),非单基因型组比单基因型感染患者高。而两者AST 与GGT比较,差异无统计学意义(P>0.05)。见表2。
2.4 HCV 单基因型感染患者与非单基因型感染患者相关凝血指标的比较
单基因型感染患者与非单基因型感染患者PLT、PT、PTA 结果比较,差异无统计学意义(P>0.05)。见表3。

图1 HCV 基因分布图

表1 不同基因型HCV 病毒载量的比较 [copy/ml,M(P25,P75)]
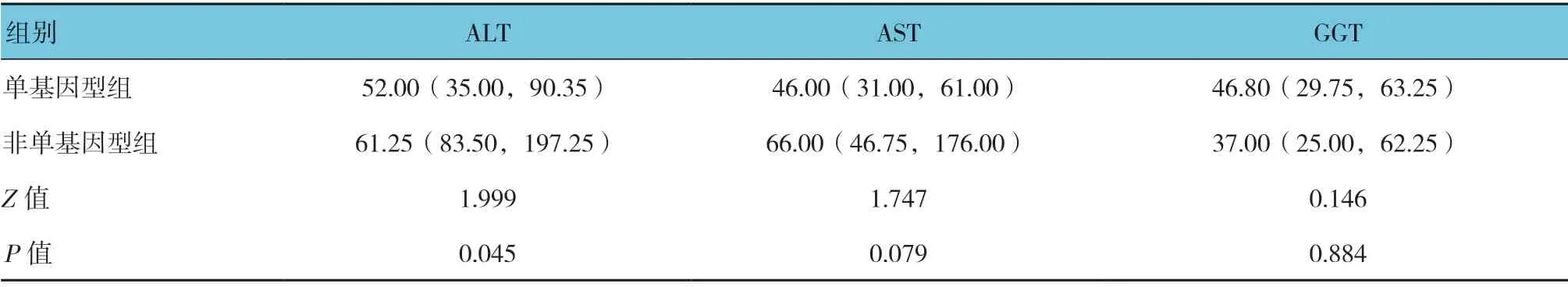
表2 单基因型感染与非单基因型感染患者的相关肝功能指标的比较 [IU/L,M(P25,P75)]

表3 单基因型感染与非单基因型感染患者的相关凝血指标的比较 M(P25,P75)
2.5 HCV 单基因型与非单基因型感染患者自身免疫抗体的比较
只要有一个自身抗体指标为阳性的患者,就将其定义为阳性。结果显示:单基因组阳性率4.9%(5/102)与非单基因组阳性率36.4%(4/11)比较,差异有统计学意义(χ2=13.408,P=0.000)。
另外,对114 例样本进行自身免疫抗体分析后发现,单基因型组以抗R0-52 为主,占阳性率的25%,非单基因型组以抗CENPB 为主,占阳性率的40%。
3 讨论
全球范围内,HCV 的感染率为3.8%。我国HCV的感染率约为3.2%[7]。由于HCV基因具有高度变异性,不同基因型其治疗方案、疗效、疗程和预后相差很大,据相关文献报道,1b 亚型患者中进展为肝硬化和肝癌的比例高于其他基因型[8],并且对干扰素的反应不如2、3 型好,更易发展为慢性[9]。因此,HCV 基因分型检测意义重大。
在我国HCV 基因型分布呈多样化特征,其中1b较为常见,2a 次之[10],这与本研究结果相似。可能与地域分布及感染途径有关,SILBERSTEIN[11]研究发现1b 通过输血传播,在全球范围的感染率很高,70%以上为HCV 感染患者;2a 和2b 占全球感染患者的10%~30%,主要分布在北美、欧洲和日本;1a 基因型与静脉注射毒品有关,主要分布在美国和欧洲。另外,本研究的114 例慢性丙型肝炎患者中,发现11 例非单基因型感染、102 例单基因型感染和1 例未分型。单基因型与非单基因型患者血清中HCV-RNA 浓度无差异,这与SCHIJMAN 等[12]研究一致。表明HCVRNA 浓度高低与是否被HCV 单基因型还是非单基因型感染无关。
肝功能是反映肝脏损害的最灵敏的指标之一。其中ALT、AST、GGT 是应用最多的肝脏代谢酶,其水平越高,肝脏组织损伤程度也就越严重。本研究通过对单基因型和非单基因型患者血清的ALT、AST、GGT 水平比较,发现HCV 非单基因型患者ALT 要高于单基因型,而AST、GGT 水平无差异,这可能是由于ALT 存在于胞质内,在肝细胞受到破坏后更易进入血循环中而被检测到。AST 位于线粒体内,需要进一步的破坏才会释放入血。而GGT,当肝细胞受损时,细胞膜通透性增加,GGT 释放出来,但是其敏感性依然不及ALT[13]。
肝脏是产生凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ、Ⅺ、Ⅻ和X Ⅲ的场所。当肝脏受损,会造成这些凝血因子减少;同时HCV 刺激机体免疫应答产生的免疫复合物会直接或间接损害造血干细胞,也会造成血小板计数偏低[14],从而影响机体凝血功能。本研究显示,HCV 单基因型和非单基因型之间,凝血功能无差异,表明HCV基因分型与肝脏凝血功能无关。有研究指出,这可能与丙型肝炎的发病机制有关[15]。
相关文献报道,病毒性肝炎患者血清中存在多种自身抗体,其中又以乙型肝炎、丙型肝炎多见,自身抗体中则以ANA 为主。对病毒性肝炎患者进行自身抗体检测有助于了解患者机体免疫状况,以便指导临床用药[16]。杨建军等[17]指出,Ib 型患者自身抗体阳性率高于其他型。同时国外研究学者KIRDAR 等[18]报道,Ⅰ型HCV 与自身免疫相关,Ⅰ型HCV 感染者ANA、ASMA、AMA 和LKM 分别占50.0%、16.7%、25.0%和8.3%,Ⅱ型感染者除ANA 外,均未检测到ASMA、AMA 和LKM。Ⅲ、Ⅳ型未检测到自身抗体。本研究发现HCV 非单基因型自身免疫抗体的检出率要高于单基因型。可能是由于自身免疫是HCV 损伤机体的一个重要方面[19],HCV 感染会引发免疫应答的产生[20]。而非单基因型病毒感染,更容易产生自身免疫抗体,给机体造成更强的免疫应答机制。同时本研究发现,单基因型以R0-52 为主,非单基因型以CENPB 为主。究其原因,还有待扩大样本量进行进一步研究。
综上所述,丙型肝炎分型对丙型肝炎的治疗,以及判断预后具有重要的意义。本地区以单基因型Ⅰb为主,但是非单基因型对肝脏的损伤及引起的自身免疫应答,应给予足够的重视。

