多孔BCP支架及其仿ECM涂层对MG63细胞功能的影响
陈代远,陈良建,2,郑景璞,易曼菲,邵春生,张博
(1.中南大学湘雅三医院,湖南长沙,410013;2.中南大学粉末冶金国家重点实验室,湖南长沙,410083)
理想的骨组织修复材料要求材料体系应具有优异的生物相容性、骨传导性、骨诱导性和可控降解性,结构体系应具有高孔隙率且相互连通的多孔结构,同时应具备与自然骨组织相匹配的力学强度。以磷酸钙为代表的生物陶瓷材料因其具备良好的生物相容性与骨传导性、降解产物无毒副作用,能在体液环境中与骨组织形成良好的骨性结合等优点[1],是骨修复支架材料的研究热点。不同的磷酸钙基生物材料,其生物活性、降解速率等表征不同,羟基磷灰石(HAp)在体液环境中稳定,降解性低;磷酸三钙(β-TCP)在体液环境中降解较快;由HAp 和β-TCP 组成的双相磷酸钙(BCP),降解性介于HAp 与β-TCP 之间,骨诱导性优于单纯的HAp 与β-TCP。研究发现,多孔BCP有利于血管长入,是较理想的骨修复支架基材[2]。高孔隙率且相互连通的多孔结构是骨长入支架的结构基础,本课题组前期采用冰模板法制备了层板状多孔HAp/BaTiO3复合材料,研究发现层板状排列的多孔陶瓷其力学强度明显优于无序多孔陶瓷,且层板状多孔结构有利于细胞黏附、增殖和分化[3-4]。细胞外基质(extracellular matrix,ECM)是体内细胞生长的微环境,对维持细胞的生理活动具有重要作用。胶原、透明质酸作为天然存在于细胞外基质中的生物高分子材料,具有极强的亲水性和极低的免疫原性。RGD 为精氨酰-甘氨酰-天冬氨酸组成的短肽序列,存在于多种生物细胞外基质中,具有特异性配体,能够通过介导受体-配体的结合来促进多种类型细胞的黏附[5],是细胞在ECM中附着和迁移的识别部位。在多孔BCP支架材料表面构建仿细胞外基质涂层,能否有利于细胞的黏附、增殖及分化尚有待于研究。本文作者通过改良冰模板法,制备具有仿生层板状结构的多孔双相磷酸钙支架,并在支架层板表面制备仿细胞外基质涂层,通过体外细胞实验研究支架结构及不同涂层对支架细胞相容性的影响。
1 材料和方法
1.1 多孔BCP支架材料的制备与性能评价
将粒径为1~5 μm 的HAp 和β-TCP 粉末按质量比为30:70 的比例机械球磨24 h,加入质量分数为1%助烧剂氧化镁粉、体积分数为4%黏接剂聚乙烯醇(PVA)、体积分数为0.9%表面活性剂聚丙烯酸胺,溶于去离子水中配置质量分数为15%的BCP浆料,改良传统冰模法,将底部冷源转为中心冷源,制定个性化模具,控制中心冷源温度在-25 ℃、外周温度1~4 ℃下冷冻2 h,制得的坯样经真空冷冻干燥后,置于箱式电阻炉中以1 ℃/min升温至550 ℃后保温3 h 脱酯,随后以5 ℃/min 升温至1 250 ℃烧制成型,保温2 h 后随炉冷却至室温。扫描电子显微镜(SEM)观察样品结构特征;阿基米德排水法检测样品孔隙率;万能力学性能试验机检测样品的力学性能。
1.2 多孔BCP支架仿ECM涂层的制备
1.2.1 明胶(gelatin,GEL)涂层制备
将1.0 g GEL 颗粒和49 mL 灭菌去离子水置于55 ℃恒温水浴箱中用玻璃棒搅拌溶解30 min,配制成质量分数为2%GEL 溶液,调节pH 至5.0 后,将试样完全浸于含GEL 溶液的灭菌培养皿中,并在37 ℃恒温水浴30 min,取出后置于37 ℃恒温干燥箱中干燥48 h,低温等离子消毒。
1.2.2 透明质酸(hyaluronic acid,HA)涂层制备
称取50 mg HA 粉末加入50 mL 灭菌去离子水中,玻璃棒充分搅拌30 min,配制成质量分数为0.1%的HA溶液,将试样完全浸于含HA溶液的灭菌培养皿中30 min,取出后置于37 ℃恒温干燥箱中干燥48 h,低温等离子消毒。
1.2.3 明胶-透明质酸(gelatin-hyaluronic acid,GEL-HA)涂层制备
将制备好GEL 涂层的BCP 支架移至含HA 溶液的灭菌培养皿中,并在浸泡30 min 后置于37 ℃恒温干燥箱中干燥48 h,低温等离子消毒。
1.2.4 明胶-透明质酸-掺RGD(gelatin-hyaluronic acid-RGD,GEL-HA-RGD)涂层制备
将5 mg RGD 加入盛有50 mL 灭菌PBS 溶液的烧杯中充分溶解30 min,称取50 mg HA 粉末加入烧杯后玻璃棒搅拌30 min,配制成质量分数为0.1%的HA-RGD 溶液,将预先制备好GEL 涂层的BCP 支架移至含上述HA-RGD 溶液的灭菌培养皿中,封口浸泡30 min后置于37 ℃恒温干燥箱中干燥48 h,低温等离子消毒。
1.2.5 SEM检测
用质量分数为75%,85%和100%酒精梯度脱水后临界点干燥、喷金,将未涂层的多孔BCP 及具有仿ECM涂层的多孔BCP试样置于扫描电镜下观察涂层表面形貌。
1.3 多孔BCP 支架及其仿ECM 涂层的体外性能评价
1.3.1 CCK8 法评价支架及其仿ECM 涂层对L929细胞的细胞毒性
1)浸提液的制备。设实验组为GEL 组(A 组)、HA 组(B 组)、GEL-HA 组(C 组)、GEL-HA-RGD 组(D组)和未涂层组(E组),将各组试样按3.0 g/mL的比例分别浸泡于含新鲜细胞培养基(1640细胞培养液和体积分数为10%的胎牛血清)的12孔细胞培养板中,封口后置于37 ℃、含5%(体积分数)CO2的细胞培养箱中培养72 h,取浸提液分别配制成体积分数为100%,50%和10%3个梯度的实验浸提液,于4 ℃保存。
2)细胞毒性实验。取处于生长对数期的L929细胞配制成5×104个/mL细胞悬液,按100 μL/孔接种于96 孔细胞培养板中,放置在37 ℃,CO2体积分数为5%的细胞培养箱中培养24 h 至贴壁完全。实验组分别用精密移液枪加入10 μL 各浓度浸提液,对照组(F 组)加入10 μL 含体积分数为10%胎牛血清的1 640 细胞培养液,阳性对照组(G 组)加入10 μL 苯酚溶液,并设空白孔(仅细胞培养基不含细胞),共8组,每组设3个复孔,后置于细胞培养箱中培养。分别于24 h和48 h 2个时间点在超净工作台内给每孔加入10 μL CCK-8 细胞毒性试剂,继续孵育2 h待细胞培养基显色后取出,用全自动酶标仪在波长450 nm 处测定每孔的吸光度,计算均值及标准差并计算细胞相对增殖率。
1.3.2 CCK8法评价支架及其仿ECM涂层对MG63细胞增殖能力的影响
分组同上,每组设3个复孔,将已传2代、处于生长期的MG63细胞经质量分数为0.25%胰酶消化后,用含体积分数为10%胎牛血清的1640 培养液配制成2×104个/mL细胞悬液,取2 mL细胞悬液接种于24 孔培养板内各组支架上,后置于细胞培养箱中培养,分别在共培养第1,3 和7 天根据CCK8细胞增殖检测试剂说明书操作,用全自动酶标仪在450 nm 波长处测定各孔吸光度并比较各组差异。
1.3.3 评价支架及其仿ECM 涂层对MG63 细胞黏附能力的影响
分组同上,每组设3个复孔,将已传2代、处于生长期的MG63细胞经0.25%胰酶消化后,用含体积分数为10%胎牛血清的1640 培养液配制浓度为2.0×104个/mL的细胞悬液,取2 mL细胞悬液接种于24 孔培养板内各组支架上,置于培养箱中共培养7 d 和14 d,同一时间点取出装入50 mL 离心管,加入4 ℃预冷的体积分数为2.5%戊二醛固定后置于4 ℃保存。梯度酒精脱水、干燥、喷金,SEM 观察MG63 细胞在各组支架表面的黏附形态及数量。
1.3.4 评价支架及其仿ECM 涂层对MG63 细胞分化功能的影响
分组同上,每组设3个复孔,将已传2代、处于生长期的MG63细胞经0.25%胰酶消化后,用含体积分数为10%胎牛血清的1640 培养液配制浓度为2.0×104个/mL的细胞悬液,取2 mL细胞悬液接种于24 孔培养板内各组支架上,置于培养箱中共培养3,7 和14 d,同一时间点吸取各孔的上清液置于EP 管中,于4 ℃保存。按人骨碱性磷酸酶(ALP)及骨钙素(BGP)测定试剂盒的说明书进行操作,用全自动酶标仪在450 nm 波长处测定各孔的吸光度并记录,分别比较各组ALP及BGP含量。
1.4 统计学分析
采用SPSS 20.0 统计软件,所有计量资料用均值(xˉ)±标准差(s)表示,组间差异比较采用方差分析,当P<0.05时,差异具有统计学意义。
2 结果
2.1 多孔BCP 及其仿ECM 涂层试样微观结构特征
采用改良冰模板法制备的多孔BCP 支架其基本结构如图1(a)所示,可见通过复制冰晶的生长方向支架结构呈现出层板状且具有显著的各向异性,该支架中心区是直径为2.5~3.0 mm 大孔,孔隙呈层板状,层板结构清晰且由内向外呈放射状排列,层板间可见间隔形成二级孔隙及多级孔隙(图1(b)箭头所示)、中心大孔与小孔之间互相连结贯通,层板间距离为88.15~89.61 μm,板层厚度为21.86~37.16 μm,孔隙短径为50~100 μm,长径与层板的长度一致(图1(a)红线所示);通过阿基米德排水法,以无水乙醇为介质测得的总孔隙率为71.0%±2.1%;支架压缩强度为(0.70±0.04)MPa。
具有仿ECM涂层的多孔BCP支架微观结构如图2所示。从图2可见:涂层在多孔BCP支架的层板表面均匀覆盖,层板间结构未见明显改变,各级孔隙清晰通畅,无明显杂质堵孔。其中,以明胶为主的涂层表面形貌呈微球状(图2(a)),而以透明质酸涂层为主的涂层表面形貌呈均质状(图2(b))。
2.2 多孔BCP 支架及其仿ECM 涂层的体外性能评价
2.2.1 多孔BCP支架及其仿ECM涂层对L929细胞的细胞毒性结果
用CCK8法检测各组试样细胞毒性,图3所示为各组试样浸提液与L929 细胞共培养48 h 后在倒置显微镜下照片。从图3可见:细胞均匀覆盖底壁,细胞间紧密相连,细胞呈三角形或多边形,伪足生长充分,贴壁良好,各实验组与对照组相比较,在细胞数量、形态方面无明显差异,阳性对照见细胞呈圆球形(图3(g)),已失去正常细胞形态及结构。
根据CCK8法测定24 h的吸光度如图4所示,由各组吸光度计算出相对增殖率(relative appreciation rate,RGR),并根据RGR 进行细胞毒性分级(CTS)。多孔BCP 支架及其仿ECM 涂层试样浸提液与L929 细胞共培养24 h 的相对增殖率见图5。由图5可见:多孔BCP及其不同涂层试样浸提液中细胞相对增殖率均大于75%,细胞毒性分级均为0或1级,说明本研究所制备的多孔BCP及其表面仿ECM 涂层对L929 细胞无毒性,符合GB/T 16886.5—2003中对材料的细胞毒性要求。

图1 多孔BCP支架结构扫描电镜图Fig.1 SEM images of porous BCP calcium phosphate pore structure

图2 具有不同涂层的多孔BCP支架扫描电镜图Fig.2 SEM images of porous BCP scaffolds with different coatings

图3 多孔BCP支架及其仿ECM涂层试样浸提液与L929细胞共培养48h倒置显微镜照片Fig.3 Inverted microscope Images of porous BCP scaffold and its ECM-coated sample extracts co-cultured with L929 cells for 48 h
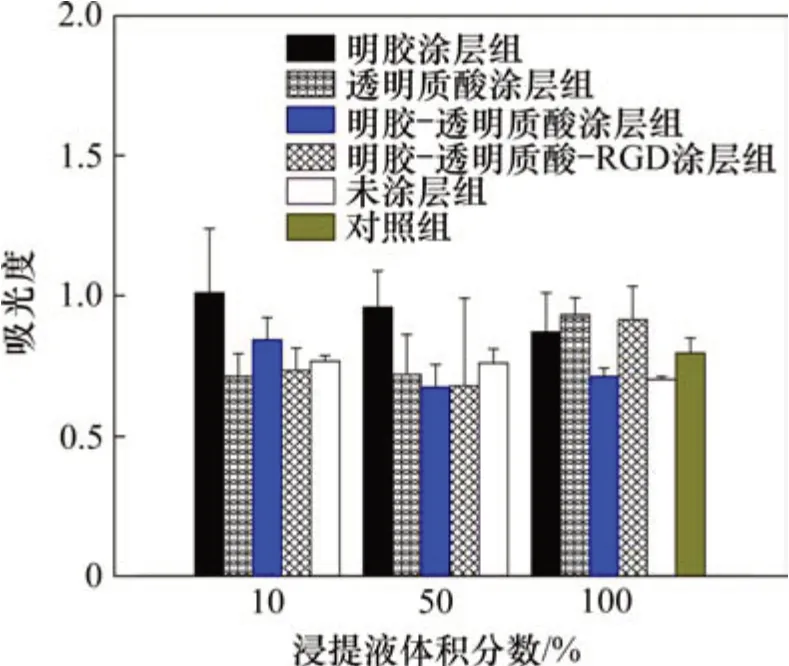
图4 多孔BCP支架及其仿ECM涂层试样浸提液与L929细胞共培养24 h的细胞毒性吸光度Fig.4 Cytotoxicity absorbance of porous BCP scaffold and its ECM-coated sample extracts co-cultured with L929 cells for 24 h
2.2.2 多孔BCP 支架及其仿ECM 涂层对MG63 细胞的细胞增殖影响
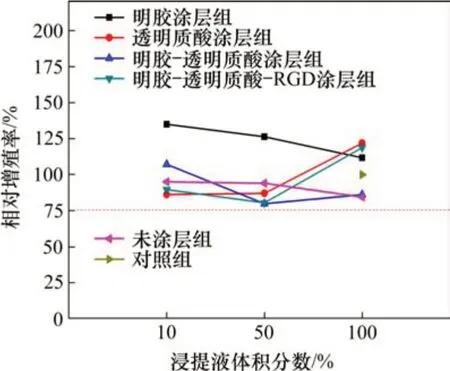
图5 多孔BCP支架及其仿ECM涂层试样浸提液与L929细胞共培养24 h的相对增殖率Fig.5 RGR of porous BCP scaffold and its ECM-coated sample extracts co-cultured with L929 cells for 24 h
图6所示为各组各时间点通过CCK8法所测得的吸光度及其比较,其中,ns 表示组与组之间无统计学差异,即P>0.05。从图6可知:1 d时各个实验组与对照组之间吸光度在统计学上无显著差异(P>0.05),4个实验组组内差异不显著(P>0.05),3 d 时明胶-透明质酸涂层组和明胶-透明质酸-RGD涂层组的吸光度较其余各组差异具有显著性,7 d时明胶-透明质酸-RGD涂层组的吸光度较其余各组差异具有显著性,结果表明,实验组与对照组均可促进MG63 细胞的增殖能力,其中2 种或2种以上膜材的复合涂层优于单一涂层,GEL-HARGD涂层组促进作用最佳。
2.2.3 多孔BCP 支架及其仿ECM 涂层对MG63 细胞的细胞黏附影响

图6 多孔BCP支架及其仿ECM涂层试样与MG63细胞共培养1,3和7 d的细胞增值吸光度(*P<0.05)Fig.6 Cell proliferation absorbance of porous BCP and its bionic ECM coating co-cultured with MG63 cells for 1,3 and 7 d(*P<0.05)
图7所示为各实验组与MG63 细胞共培养7 d的扫描电镜图。从图7可见:不同涂层细胞黏附形貌及黏附数目不同,E组试样表面MG63细胞呈长三角形或椭圆形,细胞伸展不充分,伪足少,细胞黏附数量少(见图7(e));A 组及B 组试样表面,MG63 细胞呈长梭型,伸长较充分,可见伪足延伸,但细胞间联系不紧密,伪足少,细胞黏附密度底(见图7(a)和(b));C 组及D 组试样表面,MG63 细胞充分伸展伪足,伪足末端与涂层融合,细胞聚集成团,或局部增殖伪足相互连接形成细胞网状生长,黏附于板层表面,细胞黏附密度比A,B和E组的高(见图7(c)和(d))。
2.2.4 多孔BCP 支架及其仿ECM 涂层对MG63 细胞分化功能的影响
图8和图9所示分别为多孔BCP 支架及其仿ECM 涂层在与MG63 细胞共培养3,7 和14 d 后对细胞分化功能的影响。由图8和图9可见:随时间延长,各组ALP 和BGP 的浓度均增加,其中具有仿ECM涂层的多孔BCP支架与未涂层的多孔BCP支架与各时间点上ALP 和BGP 的浓度比较均有显著差异(P<0.05),在4 种仿ECM 涂层组组间比较中,ALP 浓度从3 d 开始,C 组和D 组的吸光度较其余各组差异具有显著性,且D组显著性比C组的强(见图8);BGP浓度在3 d时各涂层组差异不显著(P>0.05),从7 d 开始C 组和D 组吸光度较其余各组差异具有显著性(P<0.05),且D组显著性比C组的强(见图9)。从上述结果可看出:4 种仿ECM 涂层在不同时间点对MG63 细胞分泌ALP 及BGP 的影响不同,4种涂层均能促进MG63细胞的分化功能,2种或2种以上膜材的复合涂层优于单一涂层,明胶-透明质酸-掺RGD涂层组促进作用最佳。

图7 多孔BCP支架及其仿ECM涂层试样与MG63细胞共培养7 d的电镜图Fig.7 SEM images of porous BCP and its bionic ECM coating samples co-cultured with MG63 cells for 7 d

图8 多孔BCP支架及其仿ECM涂层试样与MG63细胞共培养的碱性磷酸酶吸光度(*P<0.05)Fig.8 ALP absorbance of porous BCP scaffolds and its bionic ECM coated samples co-cultured with MG63 cells(*P<0.05)
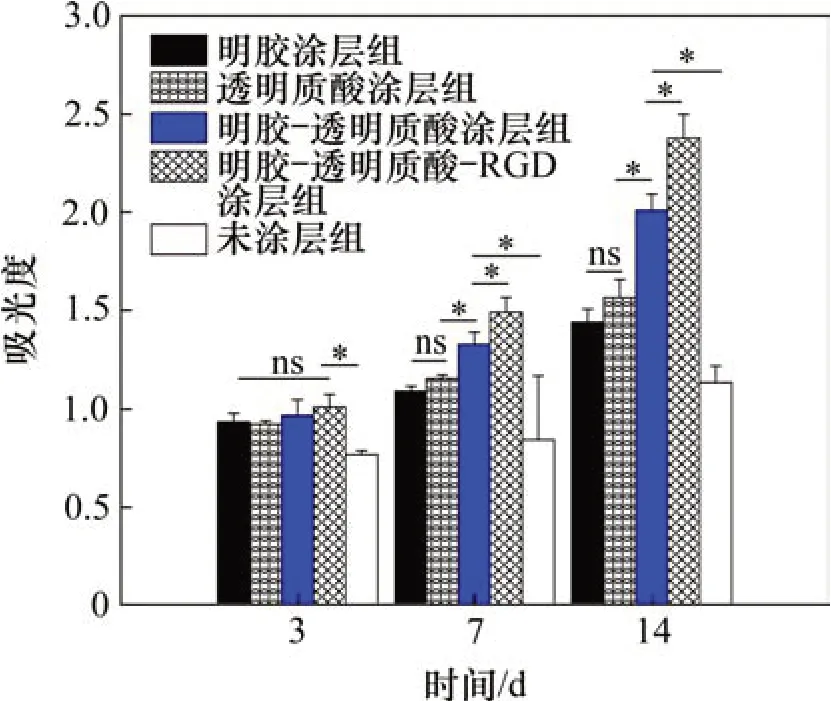
图9 多孔BCP支架及其仿ECM涂层试样与MG63细胞共培养的骨钙素吸光度(*P<0.05)Fig.9 BGP absorbance of porous BCP scaffolds and its bionic ECM coated samples co-cultured with MG63 cells(*P<0.05)
3 讨论
一般认为高孔隙率且相互连通的多孔结构是骨长入支架的结构基础,在天然骨组织中,小梁骨的高度互连的多孔结构赋予其独特的机械、生理和生物学特性。因此,具有高度连通结构的多孔骨修复支架材料是目前骨修复材料的研究热点。多孔结构、孔径、孔隙度都影响支架材料的力学性能及成骨效果,通常制备多孔磷酸钙的方法有造孔剂法[6]、发泡法[7]、有机泡沫浸渍法[8]、溶胶-凝胶法[9]和冰模板法等[10],各有其优缺点,如造孔剂法可制备各种孔隙结构的样品,但其孔隙均匀性差,孔隙率低;发泡法制备的样品多为闭孔结构;溶胶-凝胶法能制备孔隙分布均匀的样品,但孔径小;有机泡沫浸渍法能制备孔隙率高、孔径可调的样品,但不能控制孔隙的生成方向;冰模板法在多孔陶瓷制备方面有优势,可通过调节工艺参数来调控材料的孔隙度、孔径和孔隙方向,提高多孔材料的力学强度[11]。本研究根据自然骨结构特点,采用改良冰模板法,得到一种总孔隙率为71.0%±2.1%、压缩强度为(0.70±0.04) MPa、结构为中心大孔,孔隙呈板层状且由内向外呈放射状排列的仿生多孔磷酸钙支架,层板间可见间隔形成二级孔隙,多级孔隙、中心大孔与小孔之间互相连结贯通,层板间孔隙距离为88.15~89.61 μm,板层厚度为21.86~37.16 μm,孔隙短径为50~100 μm,长径与板层的长度一致。这种结构为支架内成骨提供了结构基础,研究表明:当磷酸钙支架的孔径为20~500 μm时,支架的蛋白质吸附能力增强[12];随着微孔数及多级孔隙的增加,磷酸钙支架蛋白吸附能力增强。另外,磷酸钙支架的孔径影响支架内成骨和血管的形成[13],研究发现在孔径约50 μm 或更大时,可见血管和骨组织向内生长[14]。然而,当孔径大于100 μm 时,会影响磷酸钙的机械强度和形状[15]。OTSUKI等[16]的进一步研究表明,相互连通的多孔结构为体液因子、细胞外基质沉积、氧气和营养物质的交换以及代谢物的排泄提供了良好结构条件,孔隙的相互连通性可能是骨骼向内生长的更重要因素。本实验获得了一种孔隙有序且相互连通、孔径可控的仿生支架,该支架在促进支架内成骨方面具有结构优势。
细胞外基质(ECM)是体内细胞生长的微环境,主要由纤维结构蛋白(如胶原蛋白)、多糖(如透明质酸)以及蛋白多糖等组成,对维持细胞的生理活动具有重要作用,细胞与ECM 的粘连受特定的细胞表面黏附分子如整合素的受体和配体(如RGD)的调节。为提高生物活性,尽量缩短材料骨整合时间,对骨修复支架材料表面进行细胞外基质仿生是合理并且必要的。本实验在多孔BCP 支架表面构建了以明胶、透明质酸为主的4 种仿ECM 涂层,其中明胶的肽链中富含氨基酸,具有羟基、羧基、氨基等多个活性基团,参与调节细胞迁移、黏附等,同时明胶能够促进成骨细胞的增殖、分化以及形成骨结节[17-18],透明质酸为酸性的黏多糖,作为细胞外基质的主要成分之一,具有非抗原性,其生理功能是吸附水分进入细胞间隙,在细胞周围形成含丰富营养物质的微环境,并能与液体环境中的蛋白质结合而形成蛋白凝胶、黏聚细胞的同时增大细胞接触面积,但因其自身特性又能使细胞之间保持独立,发挥细胞的正常代谢作用,并促进细胞增殖和迁移[19-20],本实验通过体外研究,发现具有仿ECM 涂层的试样对细胞增殖的作用均强于无涂层试样,明胶-透明质酸复合涂层试样对细胞增殖的促进作用强于单一涂层试样,提示复合涂层兼具两者特点,且可能存在协同效应。
成骨细胞的黏附与扩散的活力是细胞与支架表面相互作用第一阶段的初始因素,并且该阶段的质量将影响细胞在骨移植物上增殖和分化的能力[21]。孔隙率越高,比表面积越大,就能为细胞迁移和向内生长提供更多空间。研究发现粗糙的表面结构、良好的表面化学组成与亲水性、高表面能和适合的表面电荷有利于成骨细胞的黏附[22-23]。本研究发现具有仿生ECM 涂层的试样表面细胞黏附的数量、形态、伸展状况均优于未涂层的试样,且明胶-透明质酸涂层对MG63 细胞的黏附作用强于单一涂层,且明胶-透明质酸-掺RGD涂层更能促进细胞的黏附。其可能原因如下:明胶、透明质酸均具有良好的亲水性,涂层提高了多孔BCP材料的表面能,从而有利于支架对细胞的吸附作用[17,19]。明胶-透明质酸涂层兼具明胶、透明质酸的特点,因此优于单一涂层。而掺杂的RGD 位于复合涂层表面或包裹于两涂层间,直接发挥对细胞黏附的促进作用或随涂层降解发挥作用。
ALP 作为成骨细胞早期分化的标志,BGP 作为成骨细胞进入骨矿化阶段的重要指标,通过检测两者的含量可反映支架对细胞分化的影响。本研究发现,具有仿ECM涂层的试样其ALP和BGP的活性明显高于未涂层试样,明胶-透明质酸复合涂层试样对MG63细胞分化的促进作用均高于单一涂层组,且明胶-透明质酸-掺RGD 涂层试样MG63细胞分化的促进作用最佳,可能原因是:支架材料相互连通的多孔结构以及表面涂层构建了良好的微环境,且具有复合涂层的支架材料对细胞黏附、增殖能力的影响均优于单一涂层的支架,随着细胞黏附量的增加,细胞形态以及伸展情况的改变也能促进细胞的分化[22]。
从上述讨论得知:仿ECM 涂层支架对MG63细胞功能的作用优于未涂层支架,明胶-透明质酸复合涂层试样对MG63细胞功能的作用优于单一涂层,明胶-透明质酸-掺RGD 涂层试样对MG63 细胞增殖、黏附、分化功能的作用均优于其他各组。
4 结论
1)用改良冰模板法制备一种具有高孔隙率的、结构为中心大孔,孔隙呈板层状且相互连通的仿生多孔磷酸钙支架。
2)用浸润干燥法能在多孔BCP 孔隙内表面制备明胶、透明质酸、明胶-透明质酸、明胶-透明质酸-掺RGD 等仿ECM 涂层,以明胶为主的涂层表面形貌呈微球状,而以透明质酸涂层为主的涂层表面形貌呈均质状。
3)多孔BCP及其表面仿ECM涂层试样均无细胞毒性。
4)明胶涂层、透明质酸涂层、明胶-透明质酸涂层、明胶-透明质酸-掺RGD涂层的试样均可促进MG63 细胞的增殖、黏附与分化,且明胶-透明质酸-掺RGD涂层试样对MG63增殖、黏附与分化的促进作用最佳。

