不同硫酸盐对磷石膏转晶制备α-CaSO4·0.5H2O 的影响
应 翔,郭文程,肖 钧,赵 波,苏文康,崔 鹏
(合肥工业大学化学与化工学院,安徽合肥230009)
α-CaSO4·0.5H2O 是一种具有一定长径比的纤维状或针状的单晶体,具有耐高温、绝缘性好、抗化学腐蚀、强度高且与聚合物的亲和力强等诸多良好的理化性能[1-4]。相比其他无机盐晶须,该材料价廉环保,市场竞争力强,具有良好的发展前景。随着人们对α-CaSO4·0.5H2O研究的不断深入,制备的方法逐渐多样化。目前,产业化生产α-CaSO4·0.5H2O的方法主要有常压酸化法和水热法[5-6]。
水热法是将配制好的石膏悬浮液加到反应釜中,在饱和蒸汽压的作用下,二水硫酸钙溶解重结晶为细小的针状半水硫酸钙,此种方法相比常压酸化法工艺简单,转化率高[7-8]。
目前,人们对硫酸钙晶须的研究不断深入,管青军等[9]在水热反应过程中加入CuCl2·2H2O 作为转晶剂,制得了高长径比的α-CaSO4·0.5H2O;王宇斌等[10]利用钙离子的同离子效应对半水硫酸钙晶体的形貌进行调控,随着其浓度增大,可使晶体形貌由纤维状转变为柱状、板状和颗粒状;李帅等[11]以某中和渣为原料,采用水热法系统研究了硫酸铁对硫酸钙晶须形貌的影响机理;冯欣等[12]在氯化钙相变法下分析了几种酸式盐对转晶的影响。前人的研究主要集中在单一或复合转晶剂等方面,而对不同硫酸盐中的金属离子影响晶体形貌及粒径等相关方面的研究还不够全面。本文以磷石膏为原料,利用水热法制备α-CaSO4·0.5H2O,在前人研究基础上,确定反应温度、反应时间、料浆质量分数等制备工艺条件,重点研究不同浓度的硫酸根离子及金属离子对产物形貌及粒径的影响,同时探讨硫酸根离子与金属离子的作用机理。
1 实验部分
1.1 实验原料及反应仪器
磷石膏,安徽六国化工有限公司;硫酸钠,分析纯;硫酸钾,分析纯;硫酸镁(七水),分析纯;硫酸铁(十八水),分析纯;无水乙醇,分析纯;去离子水为实验室自制。
DZF-6050 型真空干燥箱;JE1002 电子分析天平;水热反应釜;DNG-92022A 型电热恒温干燥箱。
1.2 实验部分
以磷石膏为原料,采用水热法制备α-CaSO4·0.5H2O。按化学计量比称取原料,分别加入硫酸钠、硫酸钾、硫酸镁、硫酸铁溶液中配制悬浊液,然后加入水热反应釜中140℃、0.02 MPa 条件下水热反应4 h。反应结束后趁热抽滤,用无水乙醇洗涤三次,所得滤饼置于40℃烘箱中干燥24 h,制得样品。
1.3 分析与表征
采用奥林巴斯光学显微镜观察晶体形态;采用日本株式会社日立U8020 型发射扫描电子显微镜(SEM)进行晶体形貌和尺寸表征;采用荷兰Panalytical 分析公司X’Pert PRO MPD X 射线衍射仪(XRD)进行晶体晶型表征。
2 结果与讨论
2.1 不同质量分数Na2SO4 对产物晶体形貌及晶型的影响
在反应温度为140℃,料浆质量分数为5%,反应时间为4 h 条件下分别加入不同质量分数的Na2SO4,观察产物的形貌与长径比变化。图1 与图2 分别为加入不同质量分数Na2SO4时产物的SEM 图与XRD 图。

图1 加入不同质量分数Na2SO4 时产物的SEM 图Fig.1 SEM diagrams of products added with mass fractions of Na2SO4
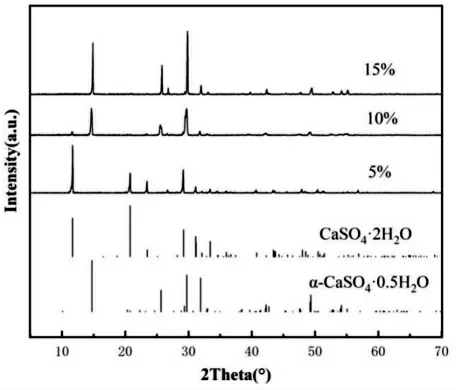
图2 加入不同质量分数Na2SO4 时产物的XRD 图Fig.2 XRD diagrams of products added with mass fractions of Na2SO4
由图1 和图2 可知,在考查的Na2SO4质量分数范围内,Na+对转晶过程无明显抑制作用,但对产物形貌及长度与长径比产生显著影响。当Na2SO4质量分数由5%升高到15%时,产物的形貌发生显著变化,晶须平均直径差别不大,长度明显减少,导致长径比随Na2SO4质量分数升高而减小。
2.2 不同质量分数K2SO4 对产物晶体形貌及晶型的影响
在反应温度为140℃,料浆质量分数为5%,反应时间为4 h 条件下,分别加入不同质量分数的K2SO4,观察产物的形貌与长径比变化。图3 为加入不同质量分数K2SO4时产物的SEM 图。

图3 加入不同质量分数K2SO4 时产物的SEM 图Fig.3 SEM diagrams of products added with mass fractions of K2SO4
由图3 可知,在考查的K2SO4质量分数范围内,随着K2SO4质量分数升高,产物平均直径逐渐减少,长度几乎不变,长径比随K+浓度升高而减小。又由XRD 分析可知,在加入K2SO4后,产物中的α-CaSO4·0.5H2O含量下降,因此K+对转晶过程存在抑制作用。
2.3 不同质量分数MgSO4 对产物晶体形貌及晶型的影响
在反应温度为140℃,料浆质量分数为5%,反应时间为4 h 条件下,分别加入不同质量分数的MgSO4,观察产物的形貌与长径比变化。图4 为加入不同质量分数MgSO4时产物的SEM 图。

图4 加入不同质量分数MgSO4 时产物的SEM 图Fig.4 SEM diagrams of products added with mass fractions of MgSO4
由图4 可知,在考查的MgSO4质量分数范围内,随Mg2+浓度增加,MgSO4对转晶过程产生抑制作用,产物形貌发生明显变化,从长针状向不规则板状、短柱状和颗粒状硫酸钙转变,平均直径增大,长径比减小,且易发生团聚现象。
2.4 不同质量分数Fe2(SO4)3 对产物晶体形貌及晶型的影响
在反应温度为140℃,料浆质量分数为5%,反应时间为4 h 条件下,分别加入不同质量分数的Fe2(SO4)3,观察产物的形貌与长径比变化。图5 为加入不同质量分数Fe2(SO4)3时产物的SEM 图。

图5 加入不同质量分数Fe2(SO4)3 时产物的SEM 图Fig.5 SEM diagrams of products added with mass fractions of Fe2(SO4)3
由图5 可知,Fe3+对晶须的生长有较强的抑制作用,所制备的产物长径比相对较小,数量较少,且形貌也多为颗粒状和板状等,Fe3+浓度越高,当Fe2(SO4)3质量分数达到10%及以上时,产物形貌变为板状、颗粒状,长径比减小,并容易发生团聚现象,分散性变差。
2.5 金属离子作用效果分析
金属离子对α-CaSO4·0.5H2O 结晶形态的影响主要有三种方式[13]:①改变溶液组成,从而改变溶液的过饱和度;②在晶体的某一结晶面上作选择性吸附,改变晶面的比表面自由能;③金属离子进入晶体结构内部,使晶体产生缺陷,发生晶格替代现象。由于晶体中Ca2+数量少于SO42-,相对更容易吸附阳离子,所以Na+、K+、Mg2+、Fe3+会吸附在晶体表面并以离子键的形式与晶面上的阴离子进行结合,这种吸附将改变该晶面的比表面能,并阻碍晶体生长基元在该晶面上的吸附,使得该方向上晶面生长速率降低[14],而其他晶面发育正常,最终使产物长径比降低。其中不同金属离子的电荷数、离子半径等与Ca2+不同,Fe3+更容易吸附于晶面,对该处后续生长基元的结合起到了更大的阻碍作用;Mg 与Ca 属同主族元素,Mg2+与Ca2+将产生同离子效应而降低二水硫酸钙溶解度,使反应溶液中Ca2+浓度过低,而SO42-浓度较高。随着Mg2+量的增大,这种抑制作用更为明显。由于Ca2+浓度较低,晶须成核数量相对减少,故所制备的产物生长时间大为延长,形貌也多为颗粒状和板状等形貌[15]。
2.6 SO42-作用效果分析
文献指出[16],α-CaSO4·0.5H2O结晶过程主要包括三个阶段:二水硫酸钙溶解、半水硫酸钙晶核形成和半水硫酸钙晶须生长。α-CaSO4·0.5H2O生长过程中,二水硫酸钙不断溶解于溶液中,溶液中存在SO42-和Ca2+,加入的硫酸盐完全电离成阳离子和SO42-,其中SO42-可产生同离子效应,溶液中SO42-浓度增大,导致二水硫酸钙溶解反应向反方向进行。由于同离子效应降低了二水硫酸钙的溶解度,使反应溶液中Ca2+浓度过低,而SO42-浓度较高。当Ca2+浓度不断降低时,晶须成核数量也相对减少[17],所制得的α-CaSO4·0.5H2O长径比相对较小。
3 结论
研究结果表明,随着SO42-浓度增大,产物长径比减小。而不同浓度的Na+、K+、Mg2+、Fe3+对晶须产物形貌及粒径影响不同,低浓度的Na+、Mg2+有助于获得小直径及高长径比的产物;K+、Mg2+、Fe3+对晶须的生长都有抑制作用,其中Mg2+、Fe3+浓度升高时,产物形貌发生明显变化,长径比减小。低浓度的Na2SO4和MgSO4作为转晶剂可获得小直径高长径比的α-CaSO4·0.5H2O;适量浓度的MgSO4或Fe2(SO4)3作为转晶剂可获得大直径低长径比的产物。

