理中枳术汤治疗便秘型肠易激综合征的疗效及对HPA轴的影响
周军惠,乔敬华
(上海市奉贤区中医医院,上海 201499)
肠易激综合征(IBS)是一种常见的功能性肠病,主要表现为反复腹痛,便秘,或者腹痛与便秘交替出现等一系列的排便习惯改变[1]。便秘型肠易激综合征(IBS-C)主要伴随大便干结,排便周期增长,排便困难,排便不畅等排便习惯改变[2]。其发病机制复杂,现有研究主要集中在肠道局部,对中枢神经系统的影响报道甚少。现有的研究认为IBS与脑-肠轴为基础的神经-免疫-内分泌(NEI)具有一定的联系,而小丘脑-垂体-肾上腺(HPA)轴是引起NEI紊乱的重要环节[3]。IBS-C的治疗主要西药为主,但效果仍不理想,而中医药对IBS具有一定的疗效。我院采用理中汤合枳术汤治疗IBS-C取得了一定的疗效,并发现可对HPA轴产生一定的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2017年1月—2018年12月在我院就诊并诊断为IBS-C患者112例,根据随机数表法将患者分为观察组和对照组,每组各56例。其中观察组男31例,女25例,年龄25~60(42.38±10.35)岁,病程1~12(6.32±2.15)年;对照组男33例,女23例,年龄25~60(41.95±9.46)岁,病程1~12(6.29±1.86)年。两组在性别、年龄和病程等一般资料方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准
西医诊断标准:1)IBS的诊断标准:症状出现至少6个月,并且近3月内至少有3天出现腹痛或者腹部不适的症状,并合并以下2条以上即可诊断:发病时具有排便次数改变(<3次/周)、排便形状改变(外观改变)、排便后缓解。2)IBS合并以下症状即可诊断为IBS-C:排便急迫感和排便不尽感;硬或者块状便不少于25%,水样便或者稀便小于25%;排便费时费力;腹胀腹痛。
中医诊断标准:主证:大便干,便出不爽,黏腻或者困难;纳呆;腹痛腹胀;次证:口干不喜饮;疲乏,肢冷;舌质淡,苔白腻;脉沉迟。符合主证2项以上,次证1项以上和舌脉征象,即可诊断。
1.3 纳入标准
符合西医诊断和中医诊断;入组前未接受治疗或者停止治疗的时间已经超过1个月以上;所有患者均签署知情同意书;经医院伦理委员会审核通过。
1.4 排除标准
胃肠道其他原因疾病;盆底性疾病,药物性便秘和器质性病变;腹部有手术史患者;心、肝、肾、肺等重要脏器功能障碍者;精神性疾病和智力障碍者;孕妇和哺乳期妇女。
1.5 治疗方法
对照组予以常规西医治疗,观察组在对照组的基础上予以理中汤合枳术汤治疗。
常规治疗:入院后多摄入纤维素,少食高脂肪和产气食物,对有焦虑和睡眠障碍的患者予以心理干预。予以马来酸曲美布汀 0.2 g 口服每天3次;并且予以双歧杆菌三联活菌肠溶胶囊 420 mg 口服,每日3次。
理中枳术汤组方:生白术60 g,枳实20 g,炙甘草、红参和干姜各10 g,伴随寒痛者加附子9 g,呃逆或者嗳气者加10 g,每日1剂,由我院煎药室统一煎煮,400 mL分早晚2次服用。治疗4周为1个疗程,2个疗程后进行疗效评价。
1.6 疗效评价标准
两组均治疗2个疗程后进行疗效评价。症状消失为痊愈;症状改善超过80%为显效;症状改善50%~80%为有效;症状改善不到50%为无效。
总有效率(%)=(痊愈+显效+有效)/总病例数×100%
1.7 症状评分
使用结肠问卷量表对中医症状积分进行评价,根据表格中的6个指标,分别为腹痛时间、腹痛次数、腹胀时间、排便异常比率、黏液便比率和排便通过异常比率。每项最高分为3分,无症状为0分,总分18分,分数越高,症状越严重。
1.8 血清标本的采集和指标检测
治疗前和治疗后6月后抽取空腹肘静脉血,约5 mL,所有静脉血放置在室温静置20 min,再通过离心机离心,离心半径15 cm,离心速度为3 000 r/min,离心10 min,分离出血清约3 mL,放置在冰箱-80 ℃待检测。促肾上腺皮质激素释放激素(CRH),促肾上腺皮质激素(ACTH)和皮质酮(CORT)采用酶联免疫吸附法进行检测,采用上海基免实业有限公司试剂盒,按照使用说明书进行操作,主要步骤为:将生物素标记二抗和酶标试剂加入标准品和样品,反应60 min,温度37 ℃。洗板后,再加入显色液AB反应10 min,反应温度在37 ℃;再加入终止液,在15 min内检测吸收密度值;通过Elecsys软件定标曲线计算出CRH、ACTH和CORT水平。
1.9 观察指标
比较两组治疗后的疗效,两组治疗前后自主排便、完全自主排便、中医症状评分、血管活性肠肽、胃动素、生长抑素、CRH、ACTH和CORT水平的变化。
1.10 统计学分析
所有的数据输入到Excel表,采用SPSS15.0软件表进行统计分析。正态资料的计量资料采用均数±标准差表示,治疗前后比较采用配对t检验,独立因素两组比较采用t检验。计数资料采用率表示,两组率的比较采用χ2检验。检验水准α=0.05,P≤0.05为差异有统计学意义。
2 结果
2.1 两组治疗后临床疗效的比较
从表1可知观察组的总有效率89.28%,明显高于对照组的66.07%(χ2=7.415,P<0.05)。
表1两组治疗后临床疗效的比较
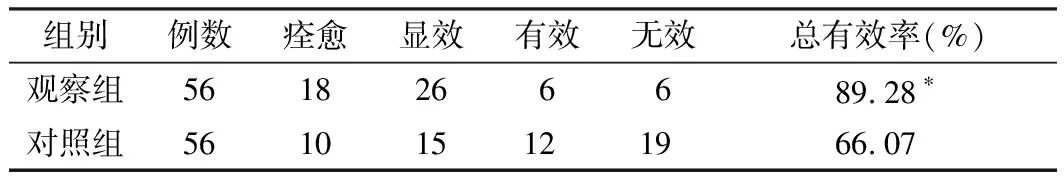
组别例数痊愈显效有效无效总有效率(%)观察组5618266689.28∗对照组561015121966.07
注:与对照组比较,*P<0.05。
2.2 两组治疗前后自主排便、完全自主排便和中医症状评分的比较
从表2可知两组治疗前自主排便、完全自主排便和中医症状评分差异无统计学意义(P>0.05),治疗后两组自主排便和完全自主排便均较治疗前明显升高(P<0.01),而中医症状评分较治疗前明显降低(P<0.01),且观察组优于对照组(P<0.01)。
2.3 两组治疗前后血管活性肠肽、胃动素和生长抑素水平的比较
从表3可知,两组治疗前血管活性肠肽、胃动素和生长抑素水平差异无统计学意义(P>0.05),治疗后血管活性肠肽和生长抑素较治疗前明显降低(P<0.01),而胃动素较治疗前明显升高(P<0.01),且观察组优于对照组(P<0.01)。

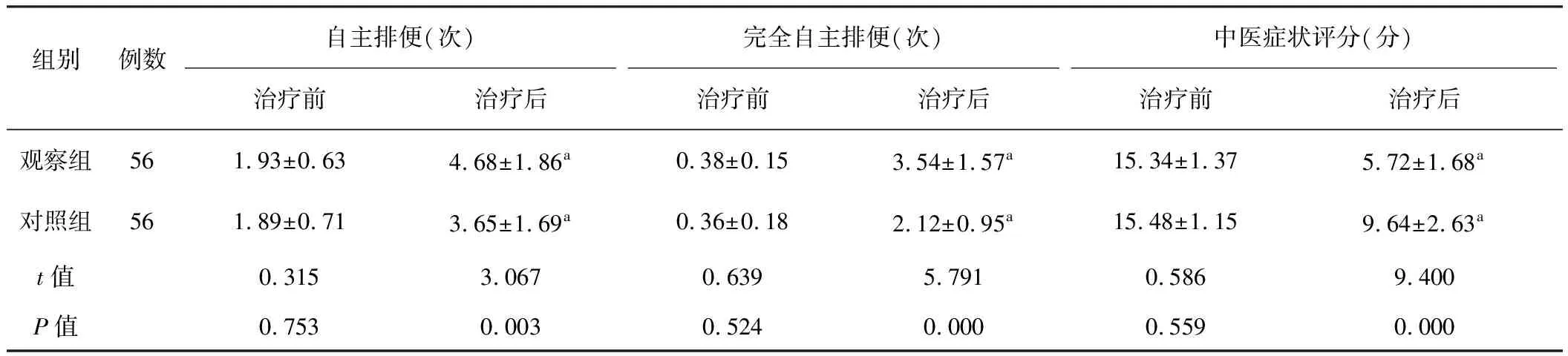
组别例数自主排便(次)完全自主排便(次)中医症状评分(分)治疗前治疗后治疗前治疗后治疗前治疗后观察组561.93±0.634.68±1.86a0.38±0.153.54±1.57a15.34±1.375.72±1.68a对照组561.89±0.713.65±1.69a0.36±0.182.12±0.95a15.48±1.159.64±2.63at值0.3153.0670.6395.7910.5869.400P值0.7530.0030.5240.0000.5590.000
注:与本组治疗前比较,aP<0.01。

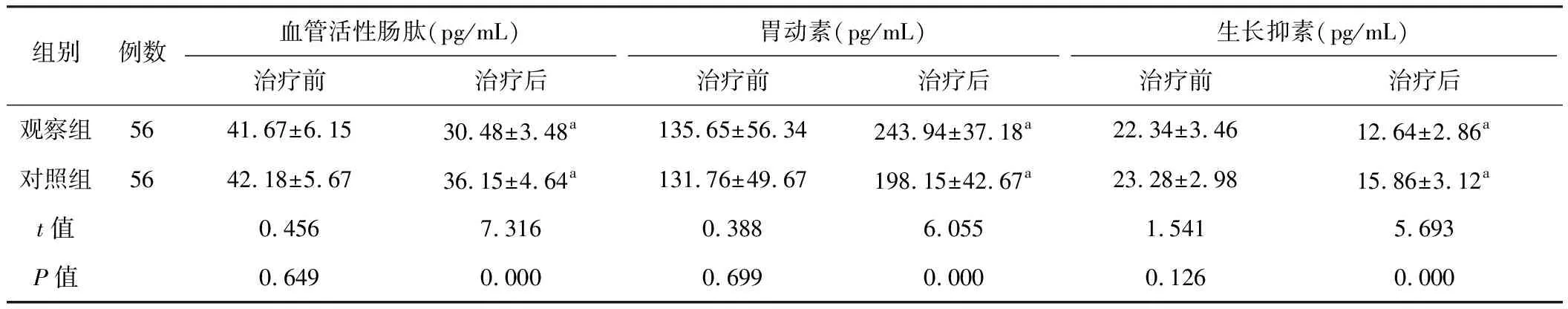
组别例数血管活性肠肽(pg/mL)胃动素(pg/mL)生长抑素(pg/mL)治疗前治疗后治疗前治疗后治疗前治疗后观察组5641.67±6.1530.48±3.48a135.65±56.34243.94±37.18a22.34±3.4612.64±2.86a对照组5642.18±5.6736.15±4.64a131.76±49.67198.15±42.67a23.28±2.9815.86±3.12at值0.4567.3160.3886.0551.5415.693P值0.6490.0000.6990.0000.1260.000
注:与本组治疗前比较,aP<0.01。
2.4 两组治疗前后血清CRH、ACTH和CORT水平的变化
从表4可知两组治疗前血清CRH、ACTH和CORT水平差异无统计学意义(P>0.05),治疗后两组均较治疗前明显降低(P<0.01),且观察组优于对照组(P<0.01)。

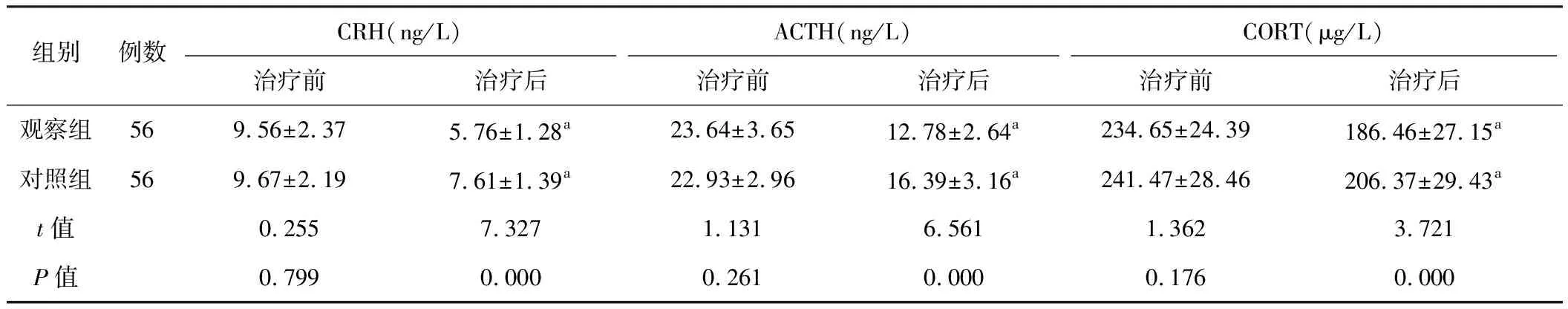
组别例数CRH(ng/L)ACTH(ng/L)CORT(μg/L)治疗前治疗后治疗前治疗后治疗前治疗后观察组569.56±2.375.76±1.28a23.64±3.6512.78±2.64a234.65±24.39186.46±27.15a对照组569.67±2.197.61±1.39a22.93±2.9616.39±3.16a241.47±28.46206.37±29.43at值0.2557.3271.1316.5611.3623.721P值0.7990.0000.2610.0000.1760.000
注:与本组治疗前比较,aP<0.01。
3 讨论
IBS-C发病机制复杂,大多数专家认为其与内脏感觉和胃动力发生异常等相关,目前主要集中在调节内脏感觉,导泻和促进胃肠动力方面的治疗。马来酸曲美布汀具有双向调节胃肠道动力作用,通过提高胃肠道平滑肌的兴奋,作用肌间神经丛的阿片受体,促进乙酰胆碱的释放,促进胃肠运动和减轻胃肠功能的失调[4]。研究发现,肠道菌群失调与IBS-C发病具有密切关系,益生菌在肠道菌群失调方面已经被逐渐重视,临床研究证实益生菌能够改善IBS-C症状,可能与益生菌为肠道内的原籍细菌,具有产酶能力强,繁殖能力较强的特点有关,能够很快适应肠内环境[5]。目前单纯西药治疗取得了一定的疗效,但长期疗效仍不理想,容易复发,而中医药治疗IBS-C得到一定的认可,尤其联合西药治疗IBS-C取得了初步疗效。本研究观察理中枳术汤联合西药治疗IBS-C,其疗效明显优于对照组,并且发现观察组在提高自主排便和完全自主排便次数,降低中医症状评分明显优于对照组,说明理中枳术汤具有提高疗效,改善IBS-C的症状。生白术的主要成分为苍术酮和白术内酯等成分,现代药理学认为其具有促进胃肠排空,小肠推进作用;枳实具有行气、散结、化痰和除痞的功效,现代药理学认为其对在体胃肠平滑肌具有兴奋作用,对幽门螺杆菌具有杀灭作用,具有抗疲劳、镇痛和镇静作用;炙甘草主要成分甘草酸、甘草苷等成分,具有抗炎、解痉、抗酸和肾上皮质激素样作用,调节免疫和抗心律失常作用;红参的化学成分主要为皂苷和挥发油,现代药理学认为具有提高脑和体力活动能力,增强抗应激、抗肿瘤、抗疲劳和抗衰老等作用;干姜主要化学成分为挥发油和姜辣素,现代药理学认为其具有杀菌、抗氧化、抗血小板,提高免疫力,调节肠张力,节律和蠕动的作用,可以调节消化道机能[6-9]。
本研究显示,理中枳术汤联合西药治疗IBS-C能够明显降低血清血管活性肠肽,说明理中枳术汤能够明显降低IBS-C患者中的血管活性肠肽。血管活性肠肽主要分布在胃肠道的神经丛和平滑肌层中,对胃肠道平滑肌具有一定的舒张作用[10],在针对IBS-C研究中发现,血管活性肠肽参与了IBS-C的发生发展过程,高水平的血管活性肠肽通过神经递质释放,对肠蠕动起到抑制作用[11]。同时本研究发现,理中枳术汤联合治疗能够明显降低IBS-C血清生长抑素,说明理中枳术汤通过降低血清生长抑素水平,从而达到治疗效果。生长抑素广泛分布于中枢神经系统和胃肠道神经丛中,对胃肠道生理功能具有一定的抑制作用,具有抑制胃肠道运动和胃肠道激素的分泌,促进营养物质和电解质的吸收,从而达到治疗的目的[12]。本研究还发现理中枳术汤联合治疗可升高IBS-C患者血清胃动素水平,胃动素是多肽型胃肠激素,能够加快胃肠道营养和电解质的转运,在胃动素缺乏时胃肠道功能受到明显抑制[13]。说明理中枳术汤通过降低血管活性肠肽和生长抑素水平,提高机体的胃动素水平,从而达到治疗IBS-C的目的。
理中枳术汤联合西药治疗IBS-C能够降低CRH、ACTH和CORT水平,说明理中枳术汤治疗IBS-C疗效与机体激素CRH、ACTH和CORT水平降低有关。IBS-C的发病机理仍不清楚,可能与多种机制相互关联,均是以脑肠轴为基础的NEI,在这些重要的神经网络中,以HPA轴最为重要,各种致病因素引起中枢和外周神经系统汇集到下丘脑,引起CRH从小丘脑释放到垂体门静脉系统,作用于垂体前叶,导致垂体是释放ACTH释放入血,引起更多的CORT释放入血[14]。故CRH、ACTH和CORT水平是反映HPA轴的激活状态,HPA过度激活状态是应激过程的重要特征,IBS-C疾病中HPA激活是应激反应激活的特征性表现,多种HPA轴相关的激素大量释放入血。肾上腺皮质是HPA轴的靶组织,机体处于应激时,垂体分泌大量的ACTH作用与肾上腺皮质,导致机体合成大量的CORT释放入血,从而对糖脂代谢和稳定溶酶体膜的作用[15];同时垂体激活后同样也导致大量的CRH释放。可见理中枳术汤联合西药治疗IBS-C能够降低机体的CRH、ACTH和CORT水平,调节HPA轴的激素紊乱,改善胃肠道的高敏状态,从而起到治疗IBS-C作用。
总之,理中枳术汤治疗IBS-C疗效显著,具有改善症状,纠正胃肠激素紊乱,稳定HPA轴的作用。

