冠心苏合制剂微生物限度检查方法研究
程龙,陈霞
(成都市食品药品检验研究院,四川 成都 610041)
冠心苏合丸和冠心苏合胶囊均由苏合香、冰片、醋乳香、檀香和土木香制成,具有理气、宽胸、止痛的功效,用于寒凝气滞、心脉不通所致的胸痹,症见胸闷、心前区疼痛;冠心病心绞痛见上述证候者[1]。二者均为口服给药制剂,按照2015年版《中国药典》四部非无菌药品微生物限度标准规定,应对需氧菌总数、霉菌和酵母菌总数、大肠埃希菌、耐胆盐革兰阴性菌和沙门菌等5项微生物指标加以控制[2]。由于其处方中冰片、乳香和苏合香都有抗菌消炎的作用[3-5],故进行微生物限度检查时,应消除样品的抑菌活性,建立一种可靠有效的,适用于本品的方法[6-7]。本文按照2015年版《中国药典》非无菌产品微生物限度检查法,对冠心苏合制剂上述5项微生物指标的检查方法加以验证,以确保所用微生物限度检查方法的科学性、准确性和完整性,并能通过该方法正确检验出制剂受污染的情况,保证药品质量安全[8]。
1 仪器与试剂
1.1 仪器
全自动微生物分析系统(Vitek 2 compact,生物梅里埃);生物安全柜(BHC-1000ΙΙA/B3,苏净集团安泰公司);隔水式恒温培养箱(GHP-9270,上海一恒科学仪器有限公司);生化培养箱(LRH-250,上海一恒科学仪器有限公司);高压灭菌锅(HVA-110,HIRAYAMA);微量移液枪(BRAND)等。
1.2 菌种
大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、枯草芽孢杆菌[CMCC(B)631001]、铜绿假单胞菌[CMCC(B)10104]、乙型副伤寒沙门菌[CMCC(B)50094]、白色念珠菌[CMCC(F)98001]和黑曲霉[CMCC(F)98003]均来源于中国药品生物制品检定所,以上菌种均为第4代培养物。
1.3 培养基
胰酪大豆胨液体培养基(批号:160912)、胰酪大豆胨琼脂培养基(批号:170321)、沙氏葡萄糖液体培养基(批号:150914)、沙氏葡萄糖琼脂培养基(批号:1705042)、麦康凯液体培养基(批号:160801)、麦康凯琼脂培养基(批号:1608303)、RV沙门增菌液体培养基(批号:151012)、肠道增菌液体培养基(批号:1702162)、紫红胆盐葡萄糖琼脂培养基(批号:1702142)、木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:171011)和pH值7.0无菌氯化钠-蛋白胨缓冲液(批号:161130)均来自于北京三药科技开发公司。
1.4 样品
冠心苏合胶囊(批号:171004,河北万岁药业有限公司);冠心苏合丸(批号:1706137,哈药集团世一堂制药厂)。
2 方法与结果
2.1 菌液制备
按照2015年版《中国药典》制备上述菌种的菌悬液。
2.2 供试液制备
取样品10 g,加胰酪大豆胨液体培养基90 mL,45 ℃水浴保温,用匀浆仪混匀,得1∶10供试液,再10倍梯度稀释得1∶100和1∶1 000供试液。
2.3 计数方法适用性试验
2.3.1 试验组
平皿法:取1∶10、1∶100和1∶1 000供试液10 mL至试管中,分别接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和黑曲霉,使每毫升供试液含菌量不大于100 cfu。取菌悬液1 mL至平皿,平行制备2个平皿,倾注胰酪大豆胨琼脂培养基,培养计数。再从接种白色念珠菌和黑曲霉的供试液试管中,取悬液1 mL至平皿,平行制备2个平皿,倾注沙氏葡萄糖琼脂培养基,培养计数。
薄膜过滤法:取供试液1 mL,按薄膜过滤法过滤,用0.1%蛋白胨水溶液冲洗3次,每次100 mL。在最后一次冲洗液中分别加入小于100 cfu/mL的5种菌悬液,过滤。将过滤后的滤膜贴于琼脂培养基平板表面,培养计数。
2.3.2 供试品组
除不加试验菌外,其他同试验组。
2.3.3 菌液组
分别取上述5种试验菌悬液1 mL至平皿中,平行制备2个平皿,倾注相应的琼脂培养基,培养计数。
2.3.4 回收率计算
冠心苏合胶囊计数方法适用性试验回收率见表1,冠心苏合丸计数方法适用性试验回收率见表2。
回收率(%)=(试验组菌落数-供试品组菌落数)/菌液组菌落数×100%
2.4 控制菌检查方法适用性试验
2.4.1 大肠埃希菌
试验组:取1∶10供试液10 mL及不超过100 cfu/mL的大肠埃希菌悬液1 mL加入到100 mL的胰酪大豆胨液体培养基中,33 ℃培养24 h。吸取1 mL培养物接种至100 mL 麦康凯液体培养基中,43 ℃培养24 h。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,33 ℃培养24 h,观察是否有菌生长。挑取单菌落分离纯化,经革兰染色后用Vitek 2 compact进行生化鉴定。
表1冠心苏合胶囊微生物计数方法适用性结果
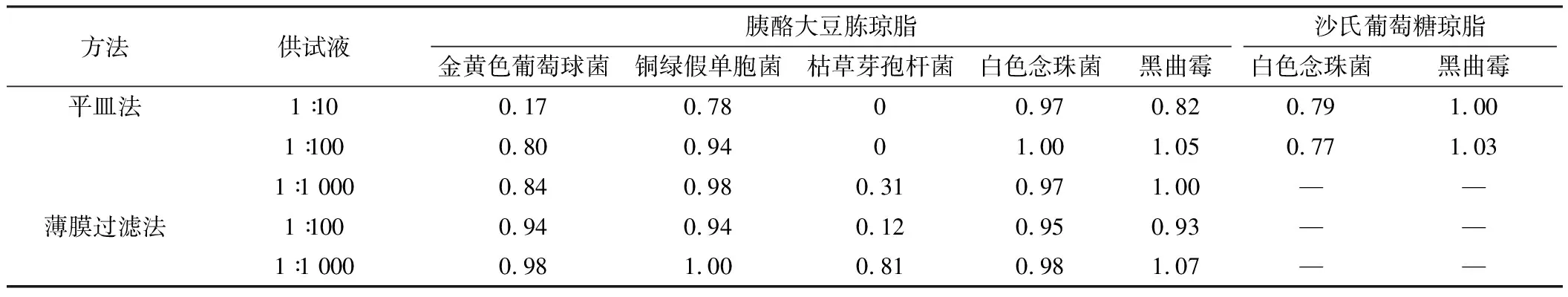
方法供试液胰酪大豆胨琼脂沙氏葡萄糖琼脂金黄色葡萄球菌铜绿假单胞菌枯草芽孢杆菌白色念珠菌黑曲霉白色念珠菌黑曲霉平皿法1∶100.170.7800.970.820.791.001∶1000.800.9401.001.050.771.031∶1 0000.840.980.310.971.00——薄膜过滤法1∶1000.940.940.120.950.93——1∶1 0000.981.000.810.981.07——
表2冠心苏合丸微生物计数方法适用性结果
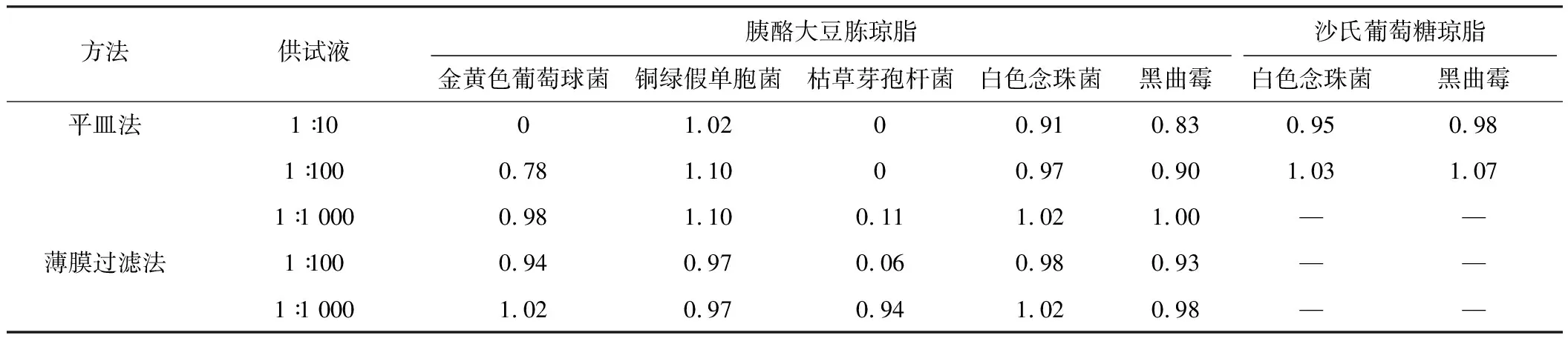
方法供试液胰酪大豆胨琼脂沙氏葡萄糖琼脂金黄色葡萄球菌铜绿假单胞菌枯草芽孢杆菌白色念珠菌黑曲霉白色念珠菌黑曲霉平皿法1∶1001.0200.910.830.950.981∶1000.781.1000.970.901.031.071∶1 0000.981.100.111.021.00——薄膜过滤法1∶1000.940.970.060.980.93——1∶1 0001.020.970.941.020.98——
供试品对照组:除不加大肠埃希菌外,其他同试验组。
阳性对照组:除不加供试液外,其他同试验组。
阴性对照组:用10 mL胰酪大豆胨液体培养基代替供试液,同时不接种大肠埃希菌,其他同试验组。
方法适用性结果见表3,常规法可用于检查大肠埃希菌。
2.4.2 沙门菌
试验组:取供试品10 g及不超过100 cfu/mL的乙型副伤寒沙门菌悬液1 mL到200 mL的胰酪大豆胨液体培养基中,33 ℃培养24 h。吸取0.1 mL培养物接种至10 mL RV沙门增菌液体培养基中,33 ℃培养24 h。取上述培养物划线接种于木糖赖氨酸脱氧胆盐琼脂培养基平板上,33 ℃培养24 h,观察是否有典型菌落生长。挑取典型单菌落分离纯化,经革兰染色后用Vitek 2 compact进行生化鉴定。
供试品对照组:除不接种乙型副伤寒沙门菌外,其他同试验组。
阳性对照组:除不加供试品外,其他同试验组。
阴性对照组:用10 mL胰酪大豆胨液体培养基代替供试品,同时不接种乙型副伤寒沙门菌,其他同试验组。
方法适用性结果见表3,常规法可用于检查沙门菌。
2.4.3 耐胆盐革兰阴性菌
试验组:取1:10供试液10 mL及不超过100 cfu/mL的大肠埃希菌悬液和铜绿假单胞菌悬液各1 mL加入到100 mL的肠道增菌液体培养基中,33 ℃培养24 h,划线接种于紫红胆盐葡萄糖琼脂培养基平板上,33 ℃培养24 h,观察是否有菌落生长。挑取典型单菌落分离纯化,经革兰染色后用Vitek 2 compact进行生化鉴定。
供试品对照组:除不接种上述两种试验菌外,其他同试验组。
阳性对照组:除不加供试液外,其他同试验组。
阴性对照组:用10 mL胰酪大豆胨液体培养基代替供试液,同时不接种两种试验菌,其他同试验组。
方法适用性结果见表3,常规法可用于检查耐胆盐革兰阴性菌。
表3控制菌检查方法适用性检查结果

剂型检查项试验组阳性对照组供试品对照组阴性对照组结论冠心苏合胶囊大肠埃希菌检出检出未检出未检出方法可行沙门菌检出检出未检出未检出方法可行耐胆盐革兰阴性菌检出检出未检出未检出方法可行冠心苏合丸大肠埃希菌检出检出未检出未检出方法可行沙门菌检出检出未检出未检出方法可行耐胆盐革兰阴性菌检出检出未检出未检出方法可行
3 讨论
冠心苏合胶囊和冠心苏合丸对细菌具有一定的抑制作用[8],由于二者的处方一致,其抑菌作用没有显著差异。在需氧菌计数方法试验中,二者1∶10供试液对革兰阴性菌如铜绿假单胞菌基本没有抑制作用,但对金黄色葡萄球菌和枯草芽孢杆菌抑制作用较强。当供试液稀释至1∶100和1∶1 000时,仍对枯草芽孢杆菌有较强的抑制作用。使用薄膜过滤法处理时,1∶10供试液黏稠度较高,药渣较多,难以通过滤膜,而1∶100供试液仍有较多的药渣残留在薄膜上,枯草芽孢杆菌的回收率仍不能达到50%,最后选用1∶1 000供试液采用薄膜过滤法才能消除样品的抑菌活性,5种菌的回收率均超过50%。而在霉菌和酵母菌总数计数以及控制菌检查试验中,常规法既可达到要求。
冠心苏合制剂中主要抑菌成分为乳香和冰片,其中乳香可抑制细菌生长,尤其对金黄色葡萄球菌有一定的抑菌作用[9-10],对枯草芽孢杆菌也有较强的抑制做用,有研究表明需采用1∶500乳香供试液通过薄膜过滤法才能保证枯草芽孢杆菌的回收率[4],这与本文的试验结果相一致。另有研究表明冰片对表皮葡萄球菌、金黄色葡萄球菌等革兰阳性菌有一定抑制作用[11-12],同时对白色念珠菌也有抑制作用[13],但从本次白色念珠菌的回收试验来看,未见本品对白色念珠菌有显著抑制作用。
此前,曾有研究者按照2010年版《中国药典》建立冠心苏合胶囊微生物限度检查的方法证,离心沉淀取上清按薄膜过滤法处理[8]。随着中国药典的日益完善,微生物限度检查方法适用性试验也有很大改变,首先从消除抑菌活性的方法来看,2015年版《中国药典》标示的方法有稀释法、中和法和薄膜过滤法,去掉了2010年版《中国药典》中推荐的离心沉淀法[14-15]。另外一个很大改变是计数试验中加菌时间点,从倾注平皿前加菌改为供试液中加菌,对于无抑菌作用的样品来说,这两种方法回收率差异不大,但对于有抑菌作用或有杀菌作用的样品,两种方法收率则有很大差异[16]。这两点改变导致按2010年版《中国药典》建立的方法未必能通过2015年版《中国药典》的验证。所以,各生产企业应与时俱进,及时进行方法适应学试验,以准确检查出药品中微生物污染状况,保证药品质量安全可靠。

