二倍体马铃薯基因编辑载体快速验证体系的建立
(云南师范大学马铃薯科学研究院, 昆明 650500)
对植物的基因组进行定点编辑是研究基因功能和作物遗传性状改良的重要方法。CRISPR/Cas 9系统是目前最新一代的基因组编辑技术,其工作原理是核酸酶Cas 9蛋白在向导RNA(short guide RNA,sgRNA)的引导下,对目的基因进行切割,导致双链断裂,双链DNA在修复时会引入碱基的插入、缺失等变异,从而实现目的基因的定点突变[1]。相比于其他基因组编辑系统,CRISPR/Cas 9系统具有构建简单,成本低廉,易于在实验室实现等显著优势,因此目前已广泛应用于拟南芥(Arabidopsisthaliana)、烟草(Nicotianabenthamiana)、水稻(Oryzasativa)、小麦(Triticumaestivum)、玉米(Zeamays)以及番茄(Solanumlycopersicum)[2-8]等多种植物的基因组编辑。
马铃薯是全球第四大粮食作物,遗传资源丰富,其中超过70%为二倍体马铃薯,是马铃薯作物遗传改良的珍贵资源[9]。二倍体马铃薯相对于四倍体基因组简单、易于转化,因此在二倍体马铃薯材料中利用基因敲除等工具验证基因的功能更容易实现。2015年,Wang等[10]在双单倍体DM中实现了对StIAA2的定点敲除;2017年,Andersson等[11]在四倍体马铃薯的原生质体中通过对StGBSS的定点突变再经过原生质体再生,获得了富含支链淀粉的马铃薯株系;2018年,Ye等[9]通过对二倍体马铃薯S.tuberosumgroup Phureja S 15-65中的S-RNase的定点突变获得了可自交的种质,这说明基因组编辑技术在马铃薯中的应用已经相当成熟。然而,稳定的遗传转化是基因功能验证的必要手段,根癌农杆菌介导的二倍体马铃薯遗传转化耗时较长,且存在基因型带来的显著差异,因此建立一套快速验证基因组编辑载体的遗传转化体系十分必要,不仅可以对载体的效率以及靶点的稳定性进行判断,也为后期的稳定遗传转化提供有效的保证。
发根农杆菌(Agrobacteriumrhizogenes)可以侵染植物并在受伤部位诱导产生毛状根,也叫发状根。发状根具有生长迅速、周期短、多分枝等优点,因此发根农杆菌转化系统被广泛地应用于生产重要次生代谢产物、根发育相关基因的功能验证及植物与微生物间的互作等领域[12]。发根农杆菌相较于根癌农杆菌对于材料的选择较为广泛,对于侵染的材料以及材料的基因型没有特异性选择。更重要的是相较于根癌农杆菌,发根农杆菌分化出发状根的时间更短,更利于遗传转化后的瞬时验证。虽然发根农杆菌侵染马铃薯已有报道[13],但将CRISPR/Cas 9编辑系统应用于马铃薯发状根尚未见报道。首先CRISPR/Cas 9系统在载体的设计上易出现错误,实验操作中也容易出现难以察觉的碱基突变,对于载体的工作有很大影响;其次对于不同靶点编辑效率,CRISPR/Cas 9系统也有很大的差异性,而利用传统的根癌农杆菌进行遗传转化不仅实验周期慢长,遗传转化效率低。所以用根癌农杆菌遗传转化来验证靶点的设计与分子实验的误差,就加大了整个实验的工作量,延长了实验周期。所以需要一套快速基因编辑载体检测系统,对基因靶点的编辑效率来进行验证,以证明CRISPR载体的适用性。马铃薯StCDF1(CYCLINGDOFFACTOR)是控制成熟期(熟性)的重要基因,当其和LOV蓝光受体蛋白StFKF1和生物钟核心蛋白StGI相互作用的结构域发生突变时,可促使马铃薯的块茎提早形成[14]。因此,本试验选取StCDF1作为靶基因,通过构建基于CRISPR/Cas 9系统的基因编辑载体,并利用发根农杆菌侵染马铃薯,建立了CRISPR/Cas 9介导的发根农杆菌遗传转化系统,验证了StCDF1基因敲除载体的高效性,同时通过根瘤农杆菌(Agrobacteriumtumefaciens) 稳定转化产生了StCDF1基因编辑的植株,为后续研究StCDF1基因的调控网络提供了宝贵的遗传材料。
1 材料与方法
1.1 试验材料
本实验所选用的所有植物材料均为二倍体材料S. tuberosum group Phureja S 15-65下文简称为CIP-65,从国际马铃薯中心引进,编号CIP 703541。发根农杆菌菌株为Ar. Qual。
1.2 试验方法
1.2.1二倍体马铃薯无菌苗的培养
CIP-65采用MS 30培养基(4.43 g·L-1MS粉末+20 g·L-1蔗糖+7 g·L-1琼脂,pH=5.8)进行培养。无菌苗培养条件如下:温度(19±1)℃,整体组培屋光照强度为2 000~3 000 lx,16 h的光照培养,8 h黑暗培养。
1.2.2马铃薯外植体的预培养
马铃薯无菌苗培养4周后,切取不带腋芽的茎段,茎段选择偏粗绿健壮,置于预培养基(MS 30+1.0 mg·L-1玉米素+2.0 mg·L-1奈乙酸)中进行预培养。预培养的光照条件培养温度与无菌苗的培养条件相同。
1.2.3CRISPR/Cas 9-StCDF1载体的构建
根据测序后拼接的StCDF1基因序列,在此序列上设计了1个敲除位点。将靶点序列的5'加上ATTG,它的反向互补序列的5'加上AAAC的BsaI的酶切位点合成引物。2条sgRNA的引物分别是F:ATTGGATTCATGATCCAAATGAAG;R:AAACCTTCATTTGGATCATGAATC。所用的载体为PKSE 402,该载体包含有GFP表达元件,载体构建的方法参考文献[15]。

注:从左到右特美汀浓度分别为0 mg·L-1、2 mg·L-1、4 mg·L-1、6 ml·L-1图1 生根培养基上特美汀浓度的筛选

注:a为自然光下的发状根;b为荧光下的发状根(白色箭头标注的为疑似荧光根)。图2 用荧光手电筒对转化的发状根进行初步筛选
1.2.4发根农杆菌的转化和侵染
每100μL的发根农杆菌感受态加入0.05μg质粒,质粒的转化采用冻融法。经PCR验证的阳性菌落保存于-80 ℃冰箱中。侵染前先将菌液培养至OD=0.05,摇好的农杆菌用高速低温离心机,转速5 000 r·min-1,离心10 min,去上清,再用MS 20液体重悬制备成发根农杆菌侵染液。在经过48 h培养后,将预培养的茎段收集,将茎段放入侵染液,缓慢摇晃侵染的茎段,让农杆菌与茎段接触充分,当侵染结束后,先把菌液沥干,将外植体置于3层无菌滤纸上吸干多余菌液。农杆菌菌液吸干后把外植体转入加上一层无菌滤纸上的培养基中于黑暗条件下共培养2 d,置于培养箱中培养,培养温度为28 ℃。
1.2.5发根培养基的抗性筛选
将暗培养培养了48 h的茎段收集好后,挑选40个外植体分别平均转移至发根培养基(MS 30+特美汀),特美汀设置了4种浓度,分别为0 mg·L-1,2 mg·L-1,4 mg·L-1,6 mg·L-1。培养温度(19±1)℃,整体组培屋光照强度为2 000~3 000 lx,16 h的光照培养,8 h黑暗培养。
1.2.6荧光根的筛选
培养8 d后,取下发状根放置于MS 30固体培养基的培养皿上,用荧光手电筒进行初步筛选。经过初步筛选后,将有荧光的根切下,放入MS固体培养上,再进行荧光显微镜的镜检。
2 结果与分析
2.1 生根培养基的优化
为了防止农杆菌溢出,保证发状根的正常生长,本实验探索了合适浓度的特美汀。共设计了4个浓度梯度,分别为0 mg·L-1、2 mg·L-1、4 mg·L-1、6 mg·L-1。在4个培养皿内分别放置10个左右的外植体,利用相同浓度的发根农杆菌侵染外植体,侵染时间也相同的处理条件下,不同浓度的特美汀的培养皿中外植体的状况不同。从图1可以看出,不加特美汀的培养基上农杆菌有溢出现象,不利于发状根的产生,而特美汀浓度过大则会抑制发状根的生长。本实验又采用相同的外植体,重复以上实验,结果均是2 mg·L-1的特美汀浓度下的发状根生长最迅速,发状根的数量最多。因此,在本试验体系中,2 mg·L-1的特美汀浓度既可以抑菌,也可以保证发状根的正常生长,最快8 d即可以进行DNA的提取验证。
2.2 基因编辑载体的验证
为了方便筛选转基因根,在载体中包含了绿色荧光蛋白。对转化农杆菌的发状根,首先用荧光手电筒进行了初步筛选(图2)。有荧光的发状根进一步在荧光显微镜下进行拍照,可以明显的观察到阳性根的荧光发亮程度远大于其自发荧光(图3)。
二倍体马铃薯发根农杆菌的遗传转化总共进行了3批,每批侵染外植体40个,每1批的40个外植体中可以筛出40条荧光根,再从每批次40条荧光根中随机抽取10条荧光根进行测序。分析测序结果发现3次编辑的荧光根分别为7条、8条、8条,证明CRISPR/Cas 9-StCDF1载体能够进行高效的基因编辑。测序结果验证了荧光筛选的可靠性,说明了二倍体马铃薯遗传转化体系可以依靠荧光筛选对载体的工作效率进行快速判断。
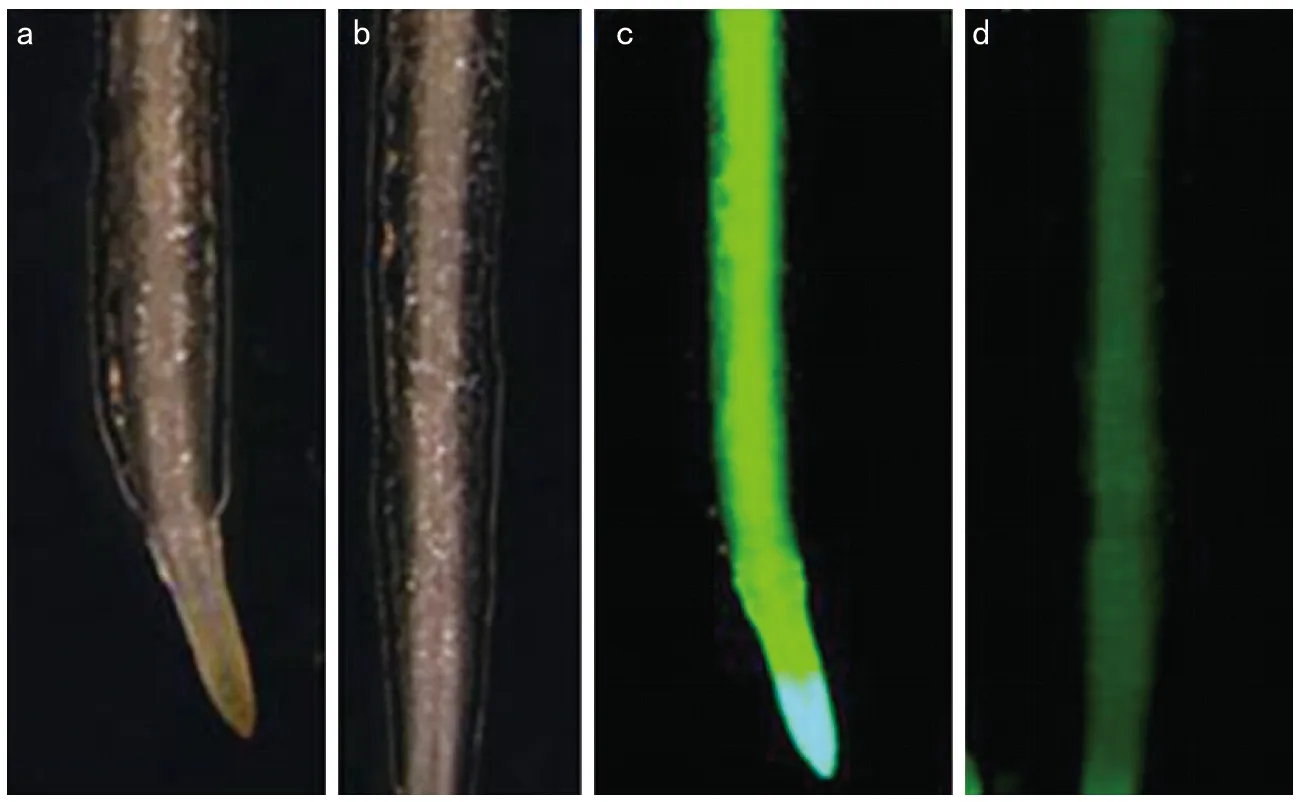
注:a为明场下观察转化阳性发状根;b为明场下观察转化阴性发状根;c为GFP 荧光通道下观察转化阳性发状根;d为GFP荧光通道下观察转化阴性发状根。图3 荧光显微镜下对转化的发状根进行筛选
2.3 阳性转基因植株的获得
发根农杆菌体系验证了CRISPR/Cas 9-StCDF1载体能够工作,将该载体转化根癌农杆菌并侵染马铃薯茎段。共侵染了200个茎段,经过抗生素筛选、及编辑靶点测序后,最终获得1株杂合突变体,之后经过进一步将PCR产物回收并连接T载体测序分析,发现该突变植株为野生和缺失5 bp的杂合突变体(图5)。

图4 基于发根农杆菌遗传转化的发状根 基因组的编辑类型

图5 基于根癌农杆菌遗传转化的植株 基因组的编辑情况
3 讨 论
本试验以马铃薯熟性基因StCDF1为靶标,建立了二倍体马铃薯基因编辑载体的快速验证办法。该方法相较于目前主流的原生质体遗传转化,首先发根遗传转化平台对于实验材料的状态要求较低,其次没有较多的精细繁琐的实验操作。在操作的时间上可以快速(约8 d)判断出编辑载体是否工作以及估算出选择靶点的适用性。且发根农杆菌遗传转化平台比原生质体转化平台更有优势的是—其验证的CRISPR载体是最终的双元载体也就是稳定转化的终载体,而原生质体遗传转化则不能,其只能检测中间载体的工作效率,检测后还需要进行进一步的载体改造后才能作为最终载体。为了进行高通量的筛选,建议首先使用荧光手电进行粗筛选,再将筛选到的根用荧光显微镜,进行仔细鉴别,排除自发荧光的干扰。此种筛选途径,可以满足高通量的大批阳性转化根的筛选,又保证了筛选的准确性。
马铃薯原产于南美洲安第斯山脉(Andes)中部西麓、濒临太平洋的秘鲁和玻利维亚区域,受到光周期的影响,许多马铃薯品种在短日照条件才能正常结薯[16]。根据之前的研究,调控开花途径中的一些元件如光敏色素B(PHYB)、CONSTANS(CO)、FLOWERING LOCUS T(FT)、CDF转录因子等在马铃薯响应光周期变化调控块茎形成的途径中起着关键作用[16],然而它们之间的调控网络研究的还不是很清楚,本研究创制的StCDF1缺失5 bp的杂合突变体为研究这一科学问题提供了宝贵的材料。
此外,除了快速验证载体,发根农杆菌系统也可被用于研究参与次生代谢产物途径的基因。植物中数量巨大的次生代谢产物与作物的风味、营养品质等性状密不可分,例如,马铃薯的块茎在贮藏过程中易积累龙葵素,产生令人不悦的苦涩味[17]。通过CRISPR/Cas 9编辑龙葵素合成代谢途径基因,转化发根农杆菌,可直接检测发状根中代谢产物的变化,有利于快速鉴定基因的功能。

