一株溶磷菌的抗逆促生特性及对种子萌发的研究
(贵州大学生命科学学院, 贵阳 550025)
红壤广泛分布于我国南部和中部的热带和亚热带地区,面积113万km2,占全国面积的11.8%,是我国南方典型土壤类型,由于其特殊的成土过程,土壤中粘粒和氧化铁、铝含量均较高,土壤“酸”、“瘦”、“板”、“结”的自然特点使得土壤磷素水平较低[1]。微生物具有极强的适应能力,因而从红壤中分离获得具有溶磷特性的微生物成为可能。溶磷菌能使土壤中难溶性或不溶性的磷转化为可溶性磷形式,加速土壤中无效磷的有效化,以利于植物对磷的吸收和利用[2]。高效溶磷菌的筛选不但可以解决土壤磷素缺乏,又能预防红壤退化和水源污染[3]。戴沈艳等[4]从江西鹰潭红壤中分离获得一株高效解磷菌T 4,其溶解磷酸铝、磷矿粉的能力较高,经鉴定为伯克霍尔德氏菌属,田间施用该菌株可以提高水稻产量。郑文波等[5]从江西红壤花生地中筛选出3株产吲哚乙酸(indoleacetic acid,IAA)的菌株,其中巨大芽孢杆菌菌株ZH 5具有较强的解磷能力,对于磷酸三钙的溶磷量达164.73 mg·L-1。而从盐碱地和贫瘠的岩石中生长的嗜盐野草根部筛选到具溶磷能力的PGPR菌株,作为拌种剂能促进鹰嘴豆的生长[6]。本研究采集红壤进行溶磷菌的分离,研究其抗逆促生特性,并对花生和辣椒种子进行浸种处理,探讨该菌株的促生效应,为进一步研制微生物菌肥奠定基础。
1 材 料
1.1 供试土样及种子
分离菌株土样来自于贵州省遵义市宽阔水自然保护区土壤(107°9′E,28°13′N),取10~20 cm土层样品,保存于无菌采样袋中。该区域为红壤,间有岩石,上有杂草及灌木丛生,土壤pH值5.5。供试花生及辣椒种子均为当地市售种子。
1.2 培养基
NBRIP培养基[7]:采用国际植物研究所磷酸盐生长培养基,成分为葡萄糖10 g,MgCl2·6 H2O 5 g,Ca3(PO4)5 g,MgSO4·7 H2O 0.25 g,KCl 0.2 g,(NH4)2SO40.1 g,蒸馏水1 000 mL,pH值为7.0,115 ℃灭菌30 min。固体培养基则加入2%琼脂。
LB培养基:酵母膏5 g,蛋白胨10 g,NaCl 10 g,蒸馏水1 000 mL,pH值为7.0,121 ℃灭菌20 min。
TSB培养基[8]:葡萄糖2.5 g,大豆胨3 g,胰蛋白胨17 g,NaCl 5 g,K2HPO42.5 g,蒸馏水1 000 mL,pH值为7.1~7.5,115 ℃灭菌30 min。
DF培养基[9]:KH2PO44 g,MgSO4·7 H2O 0.2 g,Na2HPO46 g,葡萄糖2 g,葡萄糖酸钠2 g,柠檬酸2 g,(NH4)2SO42 g,组分一、组分二溶液各0.1 mL,蒸馏水1 000 mL,pH值为7.2,115 ℃灭菌30 min。其中组分一为H3BO310 mg,MnSO4·H2O 11.19 mg,ZnSO4·7 H2O 124.6 mg,CuSO4·5 H2O 78.22 mg,MoO310 mg,溶于100 mL灭菌蒸馏水中;组分二为FeSO4·7 H2O 100 mg溶于10 mL灭菌蒸馏水中。
ADF培养基:将ACC(1-氨基环丙烷-1-羧酸)溶于超纯水,过滤灭菌,加到不含(NH4)2SO4的灭菌DF培养基中,终浓度为3.0 mmol·L-1。
1.3 主要试剂及仪器
细菌DNA提取试剂盒,Omega公司;16 SrRNA基因扩增引物27 f/1492 r合成及Taq聚合酶,大连TaKaRa公司;其余试剂均为国产分析纯。S 1000快速梯度PCR仪及Gel-DocXRS+凝胶成像系统,Bio-Rad公司;UV 8000紫外分光光度计,上海元析仪器有限公司;ZWYR-D 2403三层恒温振荡摇床,上海智城仪器有限公司。
2 方 法
2.1 溶磷菌菌株的分离
称取土壤10.0 g于装有90 mL无菌水的三角瓶中,充分振荡制备土壤悬液,经10倍倍比稀释,选择适当的稀释度涂布于NBRIP固体培养基平板上,30 ℃恒温培养箱中培养3 d,挑取水解圈大的菌落进行纯化并保种,点种法测定所分离菌株的水解圈直径及菌落直径。
2.2 溶磷菌菌株溶磷能力的动态测定
将菌株于LB培养基中过夜活化后,转接入NBRIP液体培养基中,置于30 ℃条件下、150 r·min-1摇床振荡连续培养9 d,以不接菌的相同培养基为空白对照,每个处理重复3次。培养过程中,每隔24 h取样,培养液经4 000 r·min-1离心25 min,取上清液测定pH值及可溶性磷含量,可溶性磷含量采用钼蓝比色法进行测定[10]。
2.3 溶磷菌菌株的分子鉴定
将保存菌株于LB液体培养基中过夜活化后,利用细菌DNA提取试剂盒提取菌株总DNA。以细菌总DNA为模板,细菌16 SrRNA基因扩增通用引物27 f/1492 r进行PCR扩增。PCR反应体系为25 μL,包括2×PremixTaq12.5 μL,10 μmol·L-1引物各1.0 μL,模板DNA 1.0 μL,双蒸水补足;PCR条件为:95 ℃10 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,35个循环;72 ℃ 7 min[11]。扩增产物经琼脂糖凝胶电泳,有目的大小条带者(1 500 bp左右)送至上海英骏生物工程有限公司测序。测序获得的菌株16 SrRNA基因序列使用BLAST进行同源性比较,联合EzTaxon-e数据库进行分子鉴定。
16 SrRNA基因通用引物序列为:27 f:5’-AGAGTTTGATCMTGGCTCAG-3’,1492 r:5’-TACGGYTACCTTGTTACGACTT-3’[12]。
2.4 溶磷菌菌株的抗逆能力研究
选择温度、酸碱性及盐浓度进行菌株的抗逆能力研究。温度设置了20 ℃、30 ℃、37 ℃、45 ℃及50 ℃共5个梯度,将菌株活化后转接于LB培养基中,经不同温度下摇床150 r·min-1振荡培养24 h后测定菌体生长量(OD600值);酸碱性设置了pH值为4.0、5.0、7.0、9.0、10.0和11.0等6个梯度,活化菌液分别转接于不同pH值的LB培养基中,30 ℃条件下摇床振荡培养24 h后测定OD600值;设置培养基中NaCl浓度分别为1%、2%、5%、7%和10%共5个盐浓度梯度,接种菌株后定时测定OD600值;每个处理均设3次重复。
2.5 不同盐浓度胁迫下对菌株溶磷能力的影响
以NBRIP为基础培养基,分别添加NaCl至终浓度为0%、2%、5%、7%和10%,以不接菌的相同培养基为空白对照,每个处理均设3个重复。活化菌株转接于含不同NaCl浓度的NBRIP培养基中,于30 ℃、150 r·min-1振荡培养8 d后测定培养液pH值及上清液可溶性磷含量。
2.6 溶磷菌菌株分泌ACC脱氨酶活性的测定
菌株经60 mL TSB培养基中30 ℃摇床振荡培养24 h后、8 000 r·min-1离心10 min,菌体沉淀用DF培养基洗涤2次、重悬于24 mL ADF培养基中培养24 h;菌体经离心收集后用0.1 mol·L-1Tris-HCl缓冲液(pH值为7.6)洗涤2次,并重悬于600 μL 0.1 mol·L-1Tris-HCl缓冲液(pH值为8.5)中,加入30 μL甲苯混合振荡30 s以破碎细胞,测定所获粗酶液的蛋白浓度及ACC脱氨酶活性。利用考马斯亮蓝法测定蛋白浓度,ACC脱氨酶的测定是将20 μL 0.5 mol·L-1ACC加入200 μL粗酶液中,30 ℃水浴15 min后,以0.56 mol·L-1HCl(1 mL)终止反应;离心取上清加入800 μL相同浓度HCl及300 μL 2,4-二硝基苯肼(0.2%,以2 mol·L-1HCl溶解),继续水浴30 min后,加入2 mol·L-1NaOH混匀后测定OD540值。ACC脱氨酶活的表示方法为反应条件下,每毫克菌体蛋白每小时催化ACC脱氨形成ɑ-丁酮酸的微摩尔数,单位μmol·(mg·h)-1[11,13]。
2.7 溶磷菌菌株对花生种子萌发及幼苗生长的影响
用20%过氧化氢溶液对花生种子消毒20 min,无菌蒸馏水清洗3~4次后浸泡6~12 h,置于经LB培养基过夜活化的溶磷菌菌液中(OD600=1.0)浸种2 h,待风干后再放置于铺有无菌滤纸的培养皿中,30 ℃条件下3 d,期间保持滤纸湿润,统计花生发芽率;随后移栽于装有300 g土壤的育苗盆中,常规培育30 d后测定幼苗株高、鲜重及根长。以经未接菌的空白LB培养基浸种2 h的花生为对照组,设3组重复,每组25粒;盆栽实验设3组重复,每组6株幼苗。
2.8 溶磷菌菌株对辣椒种子萌发及幼苗生长的影响
用3%NaClO溶液对辣椒种子消毒10 min,蒸馏水清洗多次,于溶磷菌菌液中(OD600=1.0)浸种2 h,对照经未接菌的空白LB培养基相同条件处理;再置于铺有滤纸的培养皿中,30 ℃黑暗条件下放置15 d,统计辣椒发芽率;之后移栽于育苗盆中常规培育,30 d后测定幼苗生长指标,以经未接菌的空白LB培养基浸种2 h的辣椒种子为对照组,种子及幼苗重复设置同上。
2.9 数据分析与处理
采用SPSS 20.0软件对数据进行统计分析。
3 结果与分析
3.1 溶磷菌菌株的分离及溶磷能力
经过对采集土样进行溶磷菌的分离及纯化,获得具有溶磷水解圈的菌株24株,点种法测定在NBRIP固体培养基上的水解圈及菌落大小,获得一株溶磷能力最强的细菌菌株HGD 12,溶磷水解圈/菌落直径之比为3.81(图1)。

图1 HGD 12菌株在NBRIP培养基上的溶磷水解圈
追踪HGD 12菌株在NBRIP培养基中的溶磷动态(图2),结果发现,随着培养时间的延长,上清液中的可溶性磷含量逐渐上升,而培养基pH值呈逐渐下降趋势,至培养8 d达到最高值;此时,该菌株培养液的可溶磷含量达248.04 μg·mL-1,pH值为4.28,下降了2.26个单位,表现出较强的溶磷能力。
3.2 溶磷菌菌株的分子鉴定
提取HGD 12菌株的总DNA,以通用引物27 f/1492 r扩增该菌株的16 SrRNA基因序列,测序结果显示与BacillusflexusGD 12(NCBI登录号:MH 393213)以及B.flexusXh 8(NCBI登录号:MK 012676)菌株的16 SrRNA基因同源性分别为99.64%和99.50%,初步鉴定HGD 12菌株为芽孢杆菌属(Bacillussp.)。
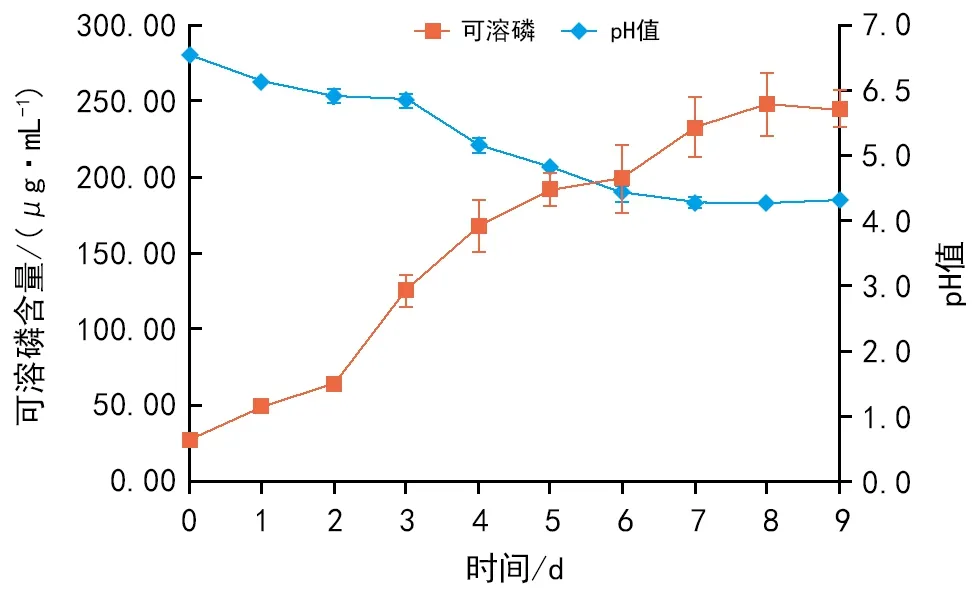
图2 HGD 12菌株在NBRIP培养基中的溶磷动态
3.3 溶磷菌菌株生长的抗逆性
将HGD 12菌株置于不同的环境条件下测定菌体的生长量,结果(图3,图4)表明,该菌株的最适生长条件为30 ℃、pH值为5.0~9.0;在20~37 ℃、pH值为10.0~11.0、低于7% NaCl范围内生长良好,温度高达45 ℃时仍有一定的生长;而当培养基中的NaCl浓度为10%时,菌株经24 h适应期后仍可缓慢生长,体现出HGD 12菌株具有较强的耐热、抗酸碱和抗盐的特性。

注:小写字母代表不同处理之间差异显著(p<0.05)。图3 HGD 12菌株在不同温度及pH条件下的生长量

图4 HGD 12菌株在不同盐浓度下的生长曲线
3.4 不同盐浓度胁迫下菌株的溶磷能力
以8 d培养上清液中的可溶磷含量为指标,分析了HGD 12菌株在不同NaCl浓度中的溶磷性。结果(图5)发现,当培养基中添加NaCl时,溶磷能力显著降低,10%盐浓度下不具溶磷性;培养基中的盐浓度为1%时,可溶磷含量为113.94 μg·mL-1,是无盐胁迫时的46.26%;但在2%~7%盐浓度范围内,溶磷能力变化不大,可溶磷含量维持在60.65~81.03 μg·mL-1之间,表明HGD 12菌株在高盐胁迫下仍具有一定的溶磷能力。

图5 HGD 12菌株在不同NaCl浓度下的溶磷能力
3.5 菌株分泌ACC脱氨酶活性的能力
1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)是乙烯合成的前体物质,ACC脱氨酶可以把ACC分解为氨和α-丁酮酸以减少乙烯合成,提高植物对逆境的抵抗能力[14]。经过测定,HGD 12菌株分泌的ACC脱氨酶活性为0.27μmol·(mg·h)-1,由于ACC脱氨酶通常与抗逆能力直接相关,这也与该菌株的耐酸碱、耐盐及高盐浓度下仍具溶磷特性相一致。
3.6 溶磷菌菌株对花生及辣椒种子萌发及幼苗生长的影响
利用HGD 12菌株的培养液对花生种子进行浸种处理后,种子发芽率较对照提高了21.34%,呈显著差异。移栽至育苗盆中继续培育30 d后测定花生幼苗的生长性状,发现HGD 12菌株的浸种处理可以显著提高花生植株的鲜重、株高及根长(p<0.05);其中,处理组花生较对照的鲜重、株高及根长分别增加了25.47%、12.62%和56.73%,对根长的影响效果尤为突出(表1)。
表1 HGD 12菌株浸种处理对花生种子萌发及幼苗生长性状的影响

处理发芽率/%鲜重/g株高/cm根长/cmHGD12浸种90.67±5.00b5.32±0.70b32.94±1.94b8.04±1.87bck69.33±1.89a4.24±0.15a29.25±2.94a5.13±0.53a
注:小写字母代表接种组和对照组差异显著(p<0.05)。下同。
表2 HGD 12菌株浸种处理对辣椒种子萌发及幼苗生长性状的影响

处理发芽率/%鲜重/g株高/cm根长/cmHGD12浸种94.67±1.89b0.14±0.01b3.09±0.21b8.96±0.38bck70.67±5.00a0.11±0.01a2.22±0.19a4.10±0.40a
对辣椒种子进行浸种处理后,与对照相比,不仅种子的萌发明显加快和提前,且发芽率较对照提高了24.00%(p<0.05)。后续培育30 d后对辣椒幼苗的生长指标进行测定,结果发现,与对照相比呈显著差异,浸种处理辣椒的鲜重、株高及根长分别增加了31.5%、39.20%和118.40%,根长增加极为显著(表2);而且,图上可以明显看出HGD 12处理组的辣椒幼苗根长明显,根系更为发达(图6)。显然,HGD 12菌株的浸种处理对于花生、辣椒种子的萌发及幼苗的生长均有显著的促生作用,尤以对根长的影响更为明显。

图6 HGD 12菌株浸种处理对辣椒幼苗的促生效应
4 结论与讨论
溶磷菌是一类能将土壤中难溶态的磷转化为可供植物直接吸收利用的可溶性磷的一类特殊的微生物功能类群。不同的溶磷菌能降解的难溶性磷化合物存在很大差异,而降解磷的过程极其复杂。有研究表明,呼吸作用放出CO2、质子、蛋白质和胞外多糖等代谢产物都能起到增强菌株溶磷的作用[15]。在自身代谢的过程中,大多数的溶磷菌可以释放出有机酸类物质而使环境pH值降低,或者溶磷菌也可通过NH4+的同化作用释放质子而降低pH值,都可导致难溶性磷的可溶化[16-17]。HGD 12菌株在溶磷定性检测和定量测定中,均表现出较强的溶磷特性,且动态测定结果也显示随着溶磷量的增加,培养液中的pH值呈逐渐下降趋势,在培养8 d后较对照下降了2.26个单位,这个结果也预示着该菌株的溶磷机制与有机酸的产生或质子的释放有关。
近年来,利用具有促生作用的微生物作为添加基质或拌种处理的报道逐渐增多。Arvind等研究表明,不动杆菌菌株BIHB 723具有溶解无机磷和有机磷的特性,拌种能促进豌豆、鹰嘴豆、玉米、大麦的生长[18]。而采用拌土和喷雾方式配套使用根际促生菌制剂YHN,可以显著增加番茄和茄子的株高、叶面积、根部鲜重和地上部鲜重[19]。谭石勇等[20]从苎麻根和根围土壤中分离获得2株伯克霍尔德氏菌菌株,具有溶磷解钾、产铁载体、IAA和产氨能力等多种促生特性,种子萌发和盆栽实验表明均能显著促进苎麻种子的萌发和植株的生长。赵伟进等[21]从西藏黑青稞根际筛选到的4株菌株对青稞种子发芽促进作用显著,且部分菌株可促进幼苗地下部分的生长。丁琳琳等[22]从石油污染土壤中获得的克雷伯氏菌D 5 A菌株,产ACC脱氨酶的比活力为0.084 U·mg-1,在9%NaCl条件下可生长,pH值为4~10的LB培养基中生长良好;在含一定NaCl浓度的条件下,浸种处理可以显著提高高羊茅种子的发芽率和芽长。本研究从贵州红壤分离到的芽孢杆菌属细菌菌株HGD 12,具有较高的溶磷活性,培养液的可溶磷含量可达248.04 μg·mL-1;且还可以分泌ACC脱氨酶;该菌株对于热、酸碱及盐浓度具有较强的抗性,在45 ℃、pH值为5.0~11.0及10%NaCl浓度下均可以生长,且7% NaCl浓度下的溶磷量仍为60.65 μg·mL-1,是一株具有抗逆促生能力的优良菌株。对辣椒和花生种子的浸种及盆栽实验表明,HGD 12菌株显著地促进了辣椒和花生种子的萌发,对辣椒和花生幼苗植株的鲜重、株高及根长均有显著的促生作用,研究结果为下一步研制拌种剂应用于田间提供了功能菌株。
在利用根际促生菌菌株进行种子萌发的影响研究中,文献报道浸泡处理的时间一般为1~4 h[21,23-26]。浸种时间过短,菌液的影响作用较弱;浸种时间过长、过高的菌液浓度,菌株自身的繁殖生长可能会消耗种子发芽时需要的足够氧气,反而会抑制种子的发芽[27]。在前期研究中,利用1 h的浸种处理后,发现辣椒和花生种子的萌发较对照仅略有提高;而当浸种时间延长至2 h后,发芽率明显提高,表明不同的促生菌菌株对植物种子萌发的影响效应存在差异。
在辣椒育苗上,常规辣椒种子常因成熟度不够、采种技术不当或贮藏方法等原因造成种子发芽率降低,苗弱且生长缓慢,进而影响其后期的生长及产量,给辣椒产业造成难以估量的经济损失[28]。大部分的研究是利用药剂处理辣椒种子,研究发现,利用亚精胺处理辣椒种子,并置于15 ℃低温胁迫下萌发,可以提高种子萌发率及幼苗的生长能力[29]。张扬等的研究表明,枯草芽孢杆菌NJAU-G 10菌株具有分泌IAA和ACC脱氨酶的特性,利用该菌液添加的生物基质进行辣椒育苗,对其生长有显著的促进作用[30]。本研究中,利用HGD 12菌株的培养液对辣椒种子进行浸种处理,有效地提高了种子活力,使得种子萌发率明显提高,而且还促进了幼苗生长。
乙烯作为一种植物激素,广泛地存在于植物根、茎、叶、花、果实和种子等器官和组织中。高盐、干旱、水涝、重污染等环境胁迫会引起乙烯增加,乙烯过量产生将导致植物生长发育受阻或死亡,尤其是幼苗,乙烯可抑制根的延长、侧根的生长和根毛的形成[31]。对乙烯很敏感的植物,如辣椒、番茄等,ACC脱氨酶活性均可以极大程度地促进其生长发育。有研究报道,当ACC脱氨酶活性细菌附着在种子表皮时,能通过分解ACC来调节植物内源乙烯的水平,特别是在播种后的几天内,此种促生作用还可提高植物幼苗的成活率[32]。Li等研究表明,ACC脱氨酶活性细菌通过产生ACC脱氨酶调节乙烯水平,促进植物根伸长[33]。利用4株产ACC脱氨酶细菌悬液处理玉米和番茄种子,发现种子的生根长度较对照组均有明显增长,番茄的穴盘栽培实验也表明其中2株细菌可以显著促进其株高、根长及根系活力[34]。黄盖等[35]分离到的产气肠杆菌ACC 30菌株分泌的ACC脱氨酶活性为0.217 U·mg-1,利用菌液培养法与菌液浸种接种法对紫花苜蓿种子进行处理,可促进其幼苗根的伸长。本研究获得的HGD 12菌株也可分泌ACC脱氨酶,酶活性为0.27μmol·(mg·h)-1;该菌株处理的辣椒和花生幼苗的根长较对照分别增长了118.40%和56.73%,根长的显著增长与该菌株分泌ACC脱氨酶活性也存在一定的关系。

