一株毛红椿种腐病原菌JZF 02的分离鉴定及生物学特性研究
(1.江西农业大学生物科学与工程学院, 南昌 330045; 2.江西农业大学,江西特色林木资源培育与利用2011协同创新中心, 南昌 330045)
1 材料与方法
1.1 材 料
1.1.1毛红椿种子
毛红椿种子于2015年11月采自江西省龙南县九连山国家级自然保护区虾公塘保护站毛红椿大树,母树胸径62.4 cm,种子保存温度-18 ℃,千粒质量为9.16 g。
1.1.2病原分离样本
发芽试验中被真菌感染而发芽失败的毛红椿种子。
1.1.3培养基
孟加拉红培养基(虎红培养基);马铃薯葡萄糖培养基(PDA培养基);马铃薯蔗糖琼脂培养基(PSA培养基);胡萝卜琼脂培养基(CA培养基);玉米琼脂培养基(MA培养基);察氏培养基(CD培养基)。
1.2 方 法
1.2.1毛红椿种腐病原真菌的分离纯化
用接种针挑取染病毛红椿种子上的菌丝接种在孟加拉红培养基上,置于28 ℃恒温培养箱中培养,待长出菌落后再用孟加拉红培养基平皿进行划线分离[8],每皿为1个处理,3次重复,长出的单菌落及时挑取至PDA培养基上纯化培养,纯化好的菌株接种试管斜面于4 ℃冰箱中保存,备用。
1.2.2毛红椿种腐病原真菌的致病性检测
在盒内均匀铺上2 cm厚的脱脂棉,然后覆上1张滤纸,添加蒸馏水将脱脂棉及滤纸充分浸润,121 ℃灭菌30 min。选取颗粒饱满、无霉变的毛红椿种子,先用清水浸泡24 h,再用0.3%KMnO4水溶液浸泡30 min,然后用无菌水洗涤干净,用无菌镊子将种子置于发芽盒内。分离菌株斜面试管中加入10 mL无菌水制成菌悬液,取1 mL菌悬液用100 mL无菌水稀释,最后取5 mL稀释液均匀滴加到培养盒内的种子上,对照培养盒内加入5 mL无菌水。培养盒置于25 ℃的光照培养箱内培养15 d,每天观察种子发芽和病害发生情况,以子叶出现视为成苗。
成苗率(%)=(成苗种子数/供试种子总数)×100%;
种子霉变率(%)=(发霉种子数/供试种子总数)×100%。
1.2.3病原真菌的鉴定
1) 形态学鉴定。将斜面保藏菌种经平皿活化扩培后,取直径为9 mm的菌饼接种于PDA培养基,于28 ℃,黑暗条件下培养,8 d后观察菌落形态特征,采用Nikon Ni复合显微镜观察菌丝及孢子形态。
2) 分子生物学鉴定。采用CTAB法提取真菌总DNA。以提取到的总DNA为模板,采用Mix混合试剂(湖南擎科生物技术有限公司),以ITS 1(TCCGTAGGTGAACCTGCGG)和ITS 4(TCCTCCGCTTATTGATATGC)作为引物扩增Internal Transcribed Spacer (ITS)序列。PCR扩增条件为95 ℃预变性5 min,95 ℃变性40 s,50 ℃退火40 s,72 ℃延伸1 min,35个循环,72 ℃后延伸10 min。PCR 产物送至北京博迈德生物有限公司进行测序。将测得DNA序列提交NCBI的Genbank数据库后进行Blast检索,下载数据库中同源性较高的菌株DNA序列数据,与所测毛红椿病原真菌DNA序列一起组成数据集,然后采用MEGA 5.0软件中Clustal W进行多序列比对,采用邻接法构建系统进化树。
1.2.4病原真菌的生物学特性
1) 不同培养基对菌丝生长的影响。配置PDA、PSA、CA、MA、CD 4种培养基,将供试菌种点种于不同培养基的平皿中央,每种培养基为一处理,每处理3次重复,于28 ℃,黑暗条件下培养,5 d后用十字交叉法测量菌落直径。
2) 不同碳源、氮源对病原真菌生长的影响。以CD培养基作为基础培养基,分别用相等质量分数的葡萄糖、乳糖、麦芽糖、可溶性淀粉替代蔗糖作为碳源;以查氏培养基作为基础培养基,分别用相等质量分数的酵母膏、牛肉膏、蛋白胨、硫酸铵、硝酸铵替代硝酸钠作为氮源。配制不同碳源和氮源的固体培养基,将供试菌种点种于不同培养基的平皿中央,置于25 ℃的恒温培养箱内培养5 d,十字交叉法测量菌落直径。每处理3次重复。
1.3 温度对病原真菌生长的影响
以PDA培养基为供试培养基,设置0 ℃、15 ℃、20 ℃、25 ℃、30 ℃、40 ℃共6个处理,每个处理进行3次重复,于黑暗条件、各处理温度下培养,7 d后用十字交叉法测定菌株菌落直径。
1.4 pH对病原真菌生长的影响
以PDA培养基为供试培养基,分别用1 mol·L-1盐酸和1 mol·L-1氢氧化钠调节培养基pH至5、6、7、8、9、10、11、12 共8个处理,灭菌后测量并再次调节各处理培养基pH。接种供试菌,置于28 ℃的恒温培养箱内培养5 d, 十字交叉法测量菌落直径。每处理3次重复。
1.5 数据处理
采用DPS软件对数据进行单因素方差分析、多重比较(LSD法)。
2 结果与分析
2.1 病原真菌的分离及致病性
以霉变腐烂种子为材料(图1-A)分离得到1#和2#两株真菌,菌丝特征与霉变种子上白色菌丝特征一致的菌株,致病性检测如表1和图1所示。由表1可知,经1#和2#菌株处理的种子成苗率显著低于空白对照,幼苗存活率与对照无显著差异;2#菌株种子霉变率显著高于对照和1#菌株,达到90%;幼苗干重显著低于对照和1#菌株。2#菌株对种子的感染特征与样品中霉变种子相同,均为在种子上产生蓬松的白色菌丝,最终种子失去发芽能力。1#菌株虽能显著降低种子成苗率,但种子霉变率较低,且感染特征与样品中霉变种子不相同,主要是在种子周围产生黑色霉点。以上结果表明,2#菌株为毛红椿种子的强致病菌,是样品种子腐烂的主要原因。因此,对2#菌株进行菌种鉴定和生物学特性研究。分离菌种保藏于江西农业大学菌种保藏中心,2#菌株编号为JZF 02。

注:A为对照;B为1#菌感染特征;C为2#菌感染特征。图1 分离真菌对毛红椿种子的感染特征

注:A为2#菌菌落正面;B为2#菌菌落背面;C为2#菌菌丝及厚垣孢子。图2 2#菌形态特征
表1 毛红椿病原菌对毛红椿种子的致病能力
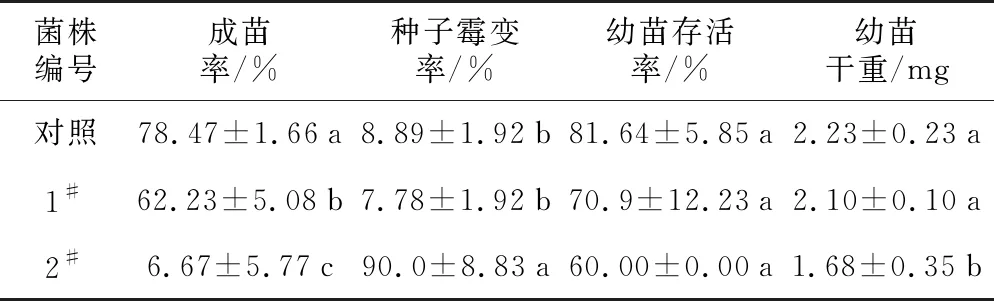
菌株编号成苗率/%种子霉变率/%幼苗存活率/%幼苗干重/mg对照78.47±1.66a8.89±1.92b81.64±5.85a2.23±0.23a1#62.23±5.08b7.78±1.92b70.9±12.23a2.10±0.10a2#6.67±5.77c90.0±8.83a60.00±0.00a1.68±0.35b
注:表中小写字母表示显著性差异(LSD法,p<0.05)。下同。
2.2 种带病原真菌的鉴定
2.2.1形态学特征
如图2所示,2#菌在PDA培养基上生长迅速,28 ℃黑暗培养7 d长满平皿(9 cm);气生菌丝发达,蓬松,呈白色絮状;培养初期菌落背面呈白色,随培养时间加长而逐渐变黄;菌丝透明,直径3~7.5μm,菌丝的顶端或中间部分膨大产生圆形或卵圆形厚垣孢子;菌丝末端可形成隔膜,断裂以形成分生孢子,直径8~27μm。
2.2.2分子学鉴定
真菌JZF 02(2#菌)的ITS 1 序列长502 bp。经过 NCBI BLAST 比对,与菌株Fusariumsp. H 5 LL-2016(321547.1)同源性高达 99%。选取真菌JZF 02(2#菌)的 前3 个近缘种的基因序列,以黑曲霉(Aspergillusniger)和Discostromafuscellum的基因序列作为对比来构建系统发育树。基于邻接法对病原真菌JZF 02的DNA序列进行进化分析。如图 3所示,真菌JZF 02与Fusariumchlamydosporum同处于一个聚类组中,说明真菌JZF 02与Fusariumchlamydosporum的进化关系最近,再结合形态学鉴定结果,真菌JZF 02鉴定为Fusariumchlamydosporum。
表2 病原菌JZF 02在不同培养基上生长的速率

培养基类型PDAPSACAMACD菌落直径/cm4.13±0.11b5.15±0.07a3.85±0.09c4.10±0.08b3.34±0.09d
表3 不同碳源对病原菌JZF 02生长的影响

指标碳源种类葡萄糖乳糖蔗糖麦芽糖可溶性淀粉无碳源菌落直径/cm6.66±0.20a6.53±0.18a6.92±0.51a7.21±0.29a7.21±0.07a0.74±0.15b气生菌丝稀疏稀疏稀疏稀疏浓密稀疏色素黄色无黄色淡黄色淡黄色无
表4 不同氮源对病原菌JZF 02生长的影响

指标氮源种类硝酸钠酵母膏蛋白胨牛肉膏硫酸铵硝酸铵无氮源菌落直径/cm5.97±0.61bc7.52±0.08a6.83±0.98ab 5.66±0.68bc4.53±0.26cd3.73±0.12d0.80±0.04e气生菌丝浓密浓密稀疏浓密稀疏浓密稀疏

图3 基于邻接法对毛红椿种腐病原真菌JZF 02 DNA序列进行进化分析
2.3 不同培养基对病原菌生长的影响
病原菌JZF 02(2号菌)在PSA培养基中培养菌落直径最大,达5.15 cm,在查氏培养基中培养菌落直径最小,只有3.34 cm。在PDA与MA 2种培养基之间菌落直径差异不显著,其他3种培养基之间菌落直径差异显著(表2)。菌丝在不同培养基上的生长速率表现为PSA>PDA/MA>CA>CD。
2.4 不同碳源对病原菌生长的影响
除不添加碳源的查氏培养基外,病原菌JZF 02在添加5种不同碳源的察氏培养基上菌落直径差异均不显著,在添加可溶性淀粉培养基上菌丝较浓密,且产生淡黄色色素(表3)。以上结果表明葡萄糖、乳糖、蔗糖、麦芽糖和可溶性淀粉均能被该菌利用,对菌丝生长速率没有显著不同的影响,但可溶性淀粉更适合该病原菌的营养条件。
2.5 不同氮源对病原菌生长的影响
病原菌JZF 02在酵母膏培养基上菌落直径最大,无氮源培养基上菌落直径最小,硝酸钠、牛肉膏、蛋白胨3种氮源之间菌落直径差异不显著,酵母膏菌落直径显著大于其他氮源,硝酸钠菌落直径显著大于硝酸铵和无氮源;硝酸钠、酵母膏、牛肉膏和硝酸铵菌落气生菌丝浓密,而其他氮源较稀疏(表4)。以上结果表明,不同氮源影响菌丝生长速率和菌丝分枝数,在以上几种氮源中,酵母膏是该菌最适氮源,该菌能够利用硝酸盐,但铵盐不适合该菌生长。
2.6 温度对菌株生长的影响
病原菌JZF 02在0~40 ℃均能生长,在25~30 ℃下培养菌落直径差异不显著,且在30 ℃下培养菌落直径最大,达到6.35 cm,0 ℃下培养菌落直径最小,只有0.21 cm(表5)。表明25~30 ℃为该菌的最适生长温度,温度过高过低均会抑制该菌生长。
2.7 pH对菌株生长的影响
病原菌JZF 02在pH 5~12均能生长,在pH 7~11的条件下培养菌落直径差异不显著,且在pH 8的培养条件下菌落直径最大,达7.56 cm,说明该菌pH适应范围较宽,嗜好中性偏碱条件。
3 结论与讨论
3.1 讨 论
厚垣镰孢菌(Fusariumchlamydosporum)是一种常见的植物病原菌,会引起苜蓿根腐病[8-9]、玉米茎腐病[10]和国槐溃疡病[11]等病害,因其对马唐等恶性杂草的强致病性,也作为生防菌被研究和利用[12];但从怀山药中分离的一株优势菌株厚孢镰刀菌 (FusariumchlamydosporumWollen)对怀山药不引起明显病害症状,其代谢产物和药材质量之间可能存在某些联系[13]。本试验分离鉴定的厚垣镰孢菌所致毛红椿病害,是国内首次报道。病原真菌菌丝能够穿透植物的表皮细胞侵染植株,同时真菌次生代谢产物可能会引起植物细胞生理生化性质的改变,其致病能力取决于环境因素,适宜的温度、湿度、pH等可以促进真菌孢子的萌发,菌丝的生长,从而导致真菌侵染引发植株病害[14]。本试验中病原菌JZF 02在0~40 ℃和pH 5~12均能生长,在过高或过低温度以及过酸过碱条件下,只是生长缓慢,说明该菌是一种适应性很强的菌种,对不良环境有较强的耐受力。该菌很容易随毛红椿种子扩散,并侵染种苗的各个阶段。病原菌JZF 02对不同碳源都具有一定的利用能力,可溶性淀粉更适合该病原菌的营养条件,这可能与该菌的分离基质——种子含大量淀粉有关。氮源是生物另一个重要的营养源,同一真菌对不同的氮源的利用能力不同,还会引起真菌次生代谢产物的改变。病原菌JZF 02能够利用硝酸盐,但利用硫酸铵和硝酸铵两种铵盐的能力较弱,其原理有待进一步研究。毛红椿种子低温保存也出现霉变现象,室温下活力更难以保存的现象与其所污染菌的种类有关。植物病害可能由多种真菌单独或复合侵染所致,因此,明确毛红椿种际真菌种类及其相互作用也是需要进一步研究的内容。
3.2 结 论
从九连山霉烂毛红椿种子上分离到2株真菌,其中JZF 02是引起种子霉烂的强致病菌,经鉴定为厚垣镰孢菌(F.chlamydosporum),该菌是一种适应性很强的菌种,对不良环境有很强的耐受力,该菌的感染是毛红椿种子活力丧失的原因之一。此研究为毛红椿种子活力的保存和病害的防治提供了理论依据。

