温度对双岛湾鳗草种子萌发的影响
(1.山东大学(威海)海洋学院, 山东 威海 264209)
鳗草(大叶藻,ZosteramarinaL.)是北半球温带海草的代表种[1],鳗草海草场在近海生物多样性的维持、水体自净和“蓝碳”储存中发挥着重要的作用[2-3]。然而近一个世纪来,该种群在全球范围内严重退化[4],其保护和修复研究已成为海洋生态系统恢复的主要内容[5]。种子是鳗草生活史中的重要环节,实生苗对于其种群扩张及修复等有重要的作用[6],温度是影响其种子萌发的重要因素[7]。中国对鳗草的研究仅有十几年历史,对其种子萌发特性的研究也较少。本研究以威海双岛湾鳗草种子为研究对象,探究野外环境鳗草种子的萌发时间和萌发温度以及室内低温保存时长和萌发温度对其萌发率和初始发时间等萌发参数的影响,以期为中国的鳗草研究以及该种群的区域保护和恢复提供参考。
1 材料与方法
1.1 种子收集
于2013年7月中旬在山东省威海市双岛湾海域(37°20.3′N,122°33.2′E)采集鳗草种子。将种子即将成熟散落的鳗草花枝装入20目的筛绢网兜中,扎紧网兜口后直接悬于该海域,于8月下旬收集自然脱落于网袋中的种子,部分种子就地用于野外萌发试验,剩余的就地清洗后装于天然海水中带回实验室进行室内种子萌发实验。
1.2 种子萌发
1.2.1野外种子萌发
2013年8月下旬,挑选健康、饱满、成熟的种子,分别种植于漏底的塑料花盆内(直径12 cm),花盆埋于威海双岛湾东侧潮间带底泥中。每个花盆50粒种子,共27盆,花盆外部用20目的筛绢网扎好,以防种子漏出,种子种植深度为2 cm。至2014年5月间每间隔30 d取出3盆进行发芽检验,并测量实生苗的枝长、叶片数、叶宽、根数和根长。实验期间用HOBO水温测定仪(美国Onset公司生产)测定水温。
1.2.2室内种子萌发
对带回实验室的种子立即进行挑选,选出健康、饱满、成熟的种子,进行如下萌发实验:先将种子在5 ℃天然海水(盐度约为33‰,以下同)环境中黑暗静置保存30 d、60 d和90 d后,转至不同温度梯度(5 ℃、15 ℃和25 ℃)的天然海水中进行萌发实验。
萌发前对供试种子做如下消毒处理:用灭菌海水冲洗3~5次;70% 乙醇浸泡15 s,灭菌海水冲洗3次;20%过氧化氢浸泡20 min,灭菌海水再反复冲洗3~5次。每个处理设5次重复,每个重复30粒消毒种子,种子置于含有50 mL海水的100 mL三角瓶中,于光照培养箱(上海博讯 SPX-250 B-G型)中进行黑暗静置培养,5 ℃处理在冰箱中进行。实验期间,每天观察种子萌发情况,每2 d换水1次,实验共持续30 d。当种皮开裂、露出下胚轴和子叶时即视为发芽[8]。
1.3 数据处理
室内实验通过每日观察种子萌发情况来计量种子最终萌发率、初始萌发时间和萌发高峰时间。累计萌发率(%)=(实验期间累计正常发芽种子粒数/供试种子总数)×100%;初始萌发时间为第一粒种子萌发所经历的天数,萌发高峰时间为种子累计萌发率达到高峰时的对应天数。野外实验每30 d统计种子萌发量,并计算种子萌发率。
统计检验在SPSS 17.0软件中进行。以单因素方差分析法对自然海域不同月份间种子萌发率进行组间差异分析,以双因素方差分析法对室内低温保存时长和萌发温度对种子萌发率的影响进行分析;若两因素交互作用显著,则对每一保存时长下不同萌发温度间和同一萌发温度下不同保存时长间分别进行单因素方差分析。单因素方差齐性时,采用LSD检验比较分析组间差异;方差不齐时,采用Dunnett’s T 3进行组间差异的多重比较。以p<0.05作为差异显著水平,p<0.001为差异极显著水平。数据整理和绘图在Excel 2013软件中完成,数据以均值±标准误表示。
2 结 果
2.1 自然海域鳗草种子萌发特征
埋于双岛湾海域的鳗草种子在2013年9月至2014年1月期间无萌发迹象,种子从2月末开始萌发, 2月、3月、4月和5月的种子累积萌发率分别为2.1%、6.8%、14.2%和20.6%,不同月份间萌发率差异显著,两两比较后,仅4月和5月间差异不显著(图1)。实验期间海域日均水温从8月13日的最高温(27.7 ℃)降至2月10日的最低温(-1.5 ℃),随后又逐渐升高至实验结束期的17.3 ℃(5月27日),期间日均温低于5 ℃的累计日数为64 d。实验期间双岛湾鳗草种子的萌发温度范围为4~17 ℃,2月下旬首次观察到种子发芽时水温为4.1 ℃,此时海域日均水温<5 ℃、5~10 ℃、10~15 ℃、15~20 ℃和>20 ℃的累计日数分别为53 d、30 d、25 d、22 d和71 d(图2)。可见,鳗草种子萌发前的确经历过一个较长的高温期和低温期。
实生苗在2月和3月水温较低(4~6 ℃)时仅有子叶,无真叶和根发出,枝长分别为1.3 cm和1.6 cm;4月底有根和真叶发出,且枝长显著增加,达4.2 cm;5月底时真叶数增至2.3片,枝长和根长快速增加,分别达10.4 cm和5.4 cm,但叶片数、叶宽和根数并无显著增加。4—5月期间实生苗开始快速生长发育时的水温为6~17 ℃(表1)。
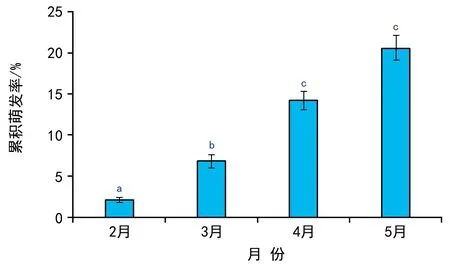
图1 双岛湾海域鳗草种子的累积萌发率
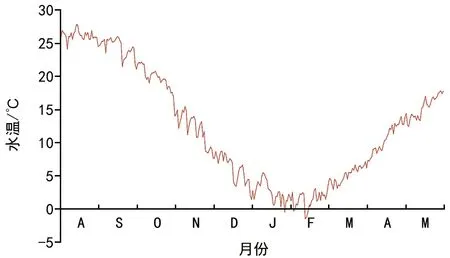
图2 双岛湾2013年8月至2014年5月日均水温
表1 双岛湾鳗草实生苗生长发育形态特征(n=4-30)
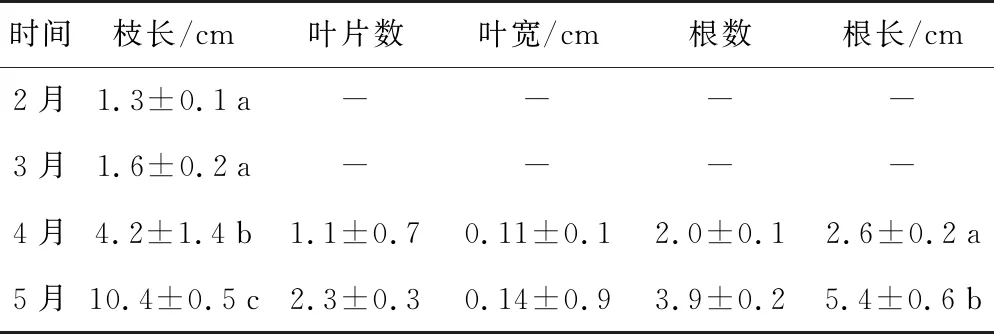
时间枝长/cm叶片数叶宽/cm根数根长/cm2月1.3±0.1a----3月1.6±0.2a----4月4.2±1.4b1.1±0.70.11±0.12.0±0.12.6±0.2a5月10.4±0.5c2.3±0.30.14±0.93.9±0.25.4±0.6b
2.2 温度对鳗草种子萌发的影响
5 ℃低温保存30 d的种子仅在25 ℃条件下有萌发,但萌发率极低,仅为1.2%;低温保存60 d和90 d后的种子在5 ℃、15 ℃和25 ℃条件下的萌发率分别为3.1%、8.7%、6.7%和8.3%、18.5%和13.6%(图3)。双因素方差分析表明,不同低温保存时长和萌发温度条件下的种子萌发率差异极显著(p<0.001),两因素的交互作用也极显著(p<0.001)。多重比较后发现,同一萌发温度下不同低温保存时长之间均差异显著(p<0.05),即低温保存时间越长,其萌发率越高;除了低温保存60 d后于15 ℃和25 ℃培养萌发率无明显差别外,同一保存时长后不同萌发温度的种子萌发率也差异显著(p<0.05),以萌发温度15 ℃条件下萌发率最高(图3)。可见,相较于萌发温度5 ℃,其余2个萌发温度均可有效提升种子的萌发率,但低温保存时间较短的30 d 种子萌发率最低,而保存90 d后15 ℃条件下的萌发率最高。进一步证明较长时间的低温保存可有效促进鳗草种子萌发,相较于5 ℃和25 ℃,15 ℃是其种子萌发的适宜温度。
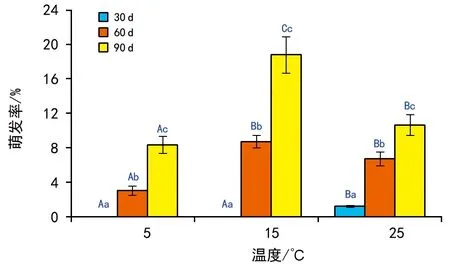
注:大写字母代表组间差异显著 (p<0.05), 小写字母代表组内差异显著 (p<0.05)。图3 5 ℃保存30 d、60 d和90 d后在3个温度条件下 鳗草种子的萌发率
鳗草种子的初始萌发时间和萌发高峰时间随低温保存时间的延长而显著变短,低温保存30 d后,25 ℃条件下的初始萌发时间和萌发高峰时间均为25.1 d;保存60 d后3个温度条件下的两指标均大于15 d;而保存90 d后3个温度条件下的初始萌发时间和萌发高峰时间则均小于3 d和8 d(表2)。
表2 萌发温度和低温保存时长对鳗草种子的初始萌发时间和萌发高峰时间的影响

萌发温度/℃保存时长/d初始萌发时间/d萌发高峰时间/d530--1530--253025.1±1.7a25.1±1.6a56018.5±3.3a20.5±1.9a156021.7±3.4a26.4±2.8a256015.5±0.3b19.4±4.4b5902.3±0.3c7.9±0.6c15902.6±0.2c4.2±0.5c25901.9±0.3c4.6±0.5c
3 讨 论
温度是影响植物种子萌发的主要生态因子之一,许多学者对鳗草种子萌发进行了野外调查和室内实验研究,重点关注了其初始萌发温度、萌发季节、萌发温度范围和最适萌发温度等(表3)。多数自然海域的鳗草种子于秋季开始萌发,萌发期一般跨越秋末、冬、春三季,萌发期可长达2~8个月,月萌发温度从0~20 ℃不等(表3)。加拿大Nova Scotia、韩国Jindong Bay、美国Chesapeake bay、美国Long Island和墨西哥Gulf of California 5个海域的鳗草种子初始萌发的时间(水温)分别为:10月(11 ℃)、11月(15 ℃)、9月末10月初(约18 ℃)、9月末(15 ℃)和10月(约20 ℃),它们的种子萌发温度范围(时间)分别为0~10 ℃(10—1月和4—5月)、5~15 ℃(11—3月)、3~18 ℃(10—5月)、10~13 ℃(9月末—5月)和16~20 ℃(11—12月)(表3);相较于以上这些海域,本研究地威海双岛湾和邻近的荣成天鹅湖的鳗草种子休眠期长达近7个月,萌发期较短(2月底—5月),初始萌发温度较低,仅为4 ℃。表3数据显示,鳗草种子萌发对高温和低温都有明显的规避现象,除北极圈附近外,其它海域的种子都存在夏季高温休眠期,以度过7—8月的25 ℃左右高温逆境,在一些冬季水温较低的海域,如中国黄海的威海双岛湾和荣成天鹅湖以及加拿大Nova Scotia海域,冬季最低水温低于0 ℃,鳗草种子除高温休眠外,还有冬季低温休眠现象,而水温未降到0 ℃以下的海域鳗草种子则无冬季休眠现象。
表3 全球不同海域鳗草种子的萌发期和萌发温度差异
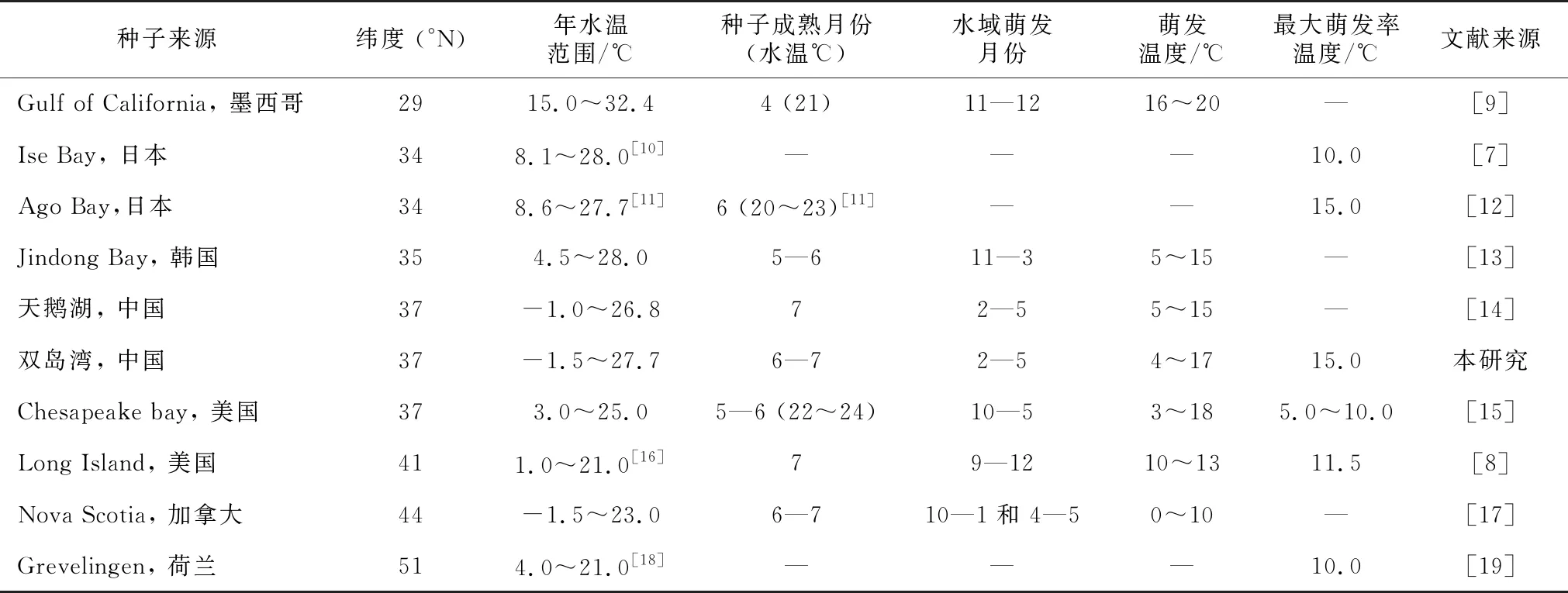
种子来源纬度 (°N)年水温范围/℃ 种子成熟月份(水温℃)水域萌发月份萌发温度/℃最大萌发率温度/℃文献来源Gulf of California, 墨西哥2915.0~32.44 (21)11—1216~20—[9]Ise Bay, 日本348.1~28.0[10]———10.0[7]Ago Bay,日本348.6~27.7[11]6 (20~23)[11]——15.0[12]Jindong Bay, 韩国354.5~28.05—611—35~15—[13]天鹅湖, 中国37-1.0~26.872—55~15—[14]双岛湾, 中国37-1.5~27.76—72—54~1715.0本研究Chesapeake bay, 美国373.0~25.05—6 (22~24)10—53~185.0~10.0[15]Long Island, 美国411.0~21.0[16]79—1210~1311.5[8]Nova Scotia, 加拿大44-1.5~23.06—710—1和 4—50~10—[17]Grevelingen, 荷兰514.0~21.0[18]———10.0[19]
虽然初始萌发温度各海域并不一致,但最适萌发温度却较为相近,均在10~15 ℃范围内。本研究与Xu等[20]和Pan等[21]的研究都证实,相较于5 ℃和25 ℃,15 ℃左右是中国黄海鳗草种子萌发的适宜温度;本研究结果与之相符。此外日本的Ise Bay和Ago Bay海域,鳗草种子萌发的适宜温度分别是10 ℃和15 ℃[6-7],美国Long Island和荷兰Grevelingen分别为11.5 ℃和10 ℃[8-19](表3)。10~15 ℃也是Setchell 经过长期多海域观测指出的鳗草最佳营养生长的温度范围[22],可见,鳗草种子的适宜萌发水温与其实生苗生长的水温相同。
鳗草在北半球分布广泛,从北极圈附近的挪威海岸等海域到亚热带边缘的墨西哥加利福尼亚湾,南北跨度约5 000 km,生存海域水温差异较大,所以不同海域的鳗草种子萌发对水温的季节变化有着不同的适应策略(表3),表现在以种子休眠来规避低温和高温逆境对实生苗生长的伤害。不同海域种子初始萌发水温和萌发温度范围要求不同、最适萌发温度也略有差异,充分说明不同海域的鳗草种群在长期适应各自生存海域的水温环境和季节变化中形成了独特的表现型、甚至基因型,乃至在常年处于10 ℃以下低温的格陵兰岛形成了成熟种子未萌发的适应特性[23]。不论何种形式的休眠,都是植物在长期的进化中,对于相对稳定的季节变化所形成的主动适应[24-25]。鳗草种子通过休眠,避开不利环境的迫害,在适宜温度条件下萌发,随后产生的幼苗在适宜温度下生长发育,也是其种群适应逆境和保护物种延续的一种策略。有关鳗草种子休眠的机制还不太清楚,不同种群、不同生活史表现型(或不同基因型)的鳗草种子均可作为探究该种种子休眠机制的最佳材料。
本研究结果表明,低温(5 ℃)保存可促进鳗草种子的萌发,支持了Tanner等[26]和Morita等[6]认为的鳗草种子低温保存刺激可有效打破鳗草种子休眠的观点,他们分别对美国Chesapeake和Ago海域的鳗草种子进行了4 ℃条件下32 d和7 ℃条件下28 d的低温处理,大大提升了种子的萌发率,其中Ago海域春化处理组的种子萌发率可达83%(未春化处理组仅40%)。本海域种子自然条件萌发前经历64 d的低温,且室内萌发更是低温保存时间越长,萌发率越高。可见,不同海域的鳗草种子可能存在不同的春化温度和春化时长,但有关其低温春化的温度和时长却尚不明确,值得进一步研究。

