三种常见抗病毒方案对成人HIV/AIDS初治患者血脂的影响
何溪,李凌华,朱媛媛,蔡卫平,洪文昕,陈劲锋,王建
(广州市第八人民医院感染病中心,广州医科大学,广东 广州 510060)
广泛开展高效联合抗逆转录病毒治使得艾滋病的发病率及死亡率明显下降。然而,越来越多的证据显示蛋白酶抑制剂(protease inhibitor,PI)与血脂异常之间有强相关性[1,2],特别是血脂升高方面,比如高甘油三酯血症和高胆固醇血症,从而增加心血管疾病的风险。目前很多研究证实,洛匹那韦/利托那韦(LPV/r)与高脂血症之间的关系[1,2],另外,还有研究报道依非韦伦(EFV)与血脂代谢有关[3],但目前尚未见常见抗病毒方案对艾滋病初治患者血脂影响的前瞻性研究。因此,本研究通过随机对照临床研究量化比较中国大陆最常见的3种抗病毒方案对艾滋病初治患者血脂的影响。
1 资料与方法
1.1 一般资料
选择2013年10月至2017年9月在广州市第八人民医院感染病中心艾滋病专科门诊就诊的HIV感染者作为研究对象,年龄18~65岁,均行HIV抗体检查,艾滋病诊断见参考文献[?4]。均排除细菌、真菌、有典型临床表现的机会性感染,急性HIV感染,肿瘤,肝硬化、中度以上肝功能异常,乙肝,严重慢性疾病史(如肾脏疾病及心脑血管疾病),血脂异常病史或正在接受降脂药物治疗,精神疾患、怀孕或哺乳女性、HIV经治患者等。本研究已通过广州市第八人民医院伦理委员会审查(编号:市八伦字20131056)。入组患者均签署知情同意书。
1.2 研究方法
采用双盲法随机选取初治的CD4+T淋巴细胞计数<250个/μL的HIV感染者300例,通过Spw-Pb网络数据平台按1:1:1随机分配为A、B、C组各100例。A组采用齐多夫定(AZT)/替诺福韦(TDF)+拉米夫定(3TC) +奈韦拉平(NVP);B组采用齐多夫定(AZT) /替诺福韦(TDF)+拉米夫定(3TC) +依非韦伦(EFV);C组采用齐多夫定(AZT) /替诺福韦(TDF)+拉米夫定(3TC) +洛匹那韦/利托那韦(LPV/r)方案。HAART药物使用的具体方案:AZT 300 mg,2次/d;TDF 300 mg,1次/d;3TC 300 mg,1次/d;NVP 200 mg,前2周导入期1次/d,2周后维持剂量为2次/d;EFV 600 mg,每天晚上1次;LPV/r 500 mg,2次/d。采用血清TG及TCHOL水平作为评价终点,将按治疗方案对各随访时间点(12、24、36和48周) 血清TG及TCHOL水平进行描述分析。在48周前更改治疗方案或者失访的患者不纳入统计。对治疗48周后CD4+细胞计数低于基线的患者进行艾滋病病毒载量检测,对结果>1000拷贝/uL的标本进行耐药检测。
血脂异常分层标准参照中国成人血脂异常防治指南(2016)[?5]。血胆固醇水平及甘油三酯水平采用标准酶活测定方法来测定(NMR LipoProfile,Raleigh,USA)。免疫细胞计数的检测采用美国BD公司FACS Canto流式细胞仪检测。依据BD公司TrucountTMTubes说明书,取相应数量Trucount-TMTubes编号,用已知总数的荧光微球作为标准内参,先后加入CD45 PerCP/CD3FITC/CD8PE/CD4APC四色荧光抗体、溶血素,应用流式细胞仪检测,并用FACanto软件分析计数。HIV筛查采用万泰生物公司生产的人类免疫缺陷病毒抗原/抗体诊断试剂盒(酶联免疫法),复检采用MP公司生产的人类免疫缺陷病毒抗体检测试剂盒(免疫印迹法)。
1.3 统计学分析
应用SPSS 19.0统计学软件进行分析,计量资料以Kolomogorov-Smirnov法进行正态性检验,符合正态分布的计量资料采用平均值描述集中趋势,多组比较采用One-way ANOVA;不符合正态分布以中位数M(Q25~Q75)描述集中趋势,采用Kruskal-Wallis秩和检验。计数资料的比较采用χ2检验;数据符合反复测量连续变量时,采用广义估计方程(GEE)模型进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
A组100例HIV感染者中,男74例,女26例;年龄37岁(32~42岁) (中位数加四分位间距描述);B组100例HIV感染中,男72例,女28例;年龄38岁(34~43岁); C组100例HIV感染中,男69例,女31例;年龄37岁(32~41岁)。3组患者性别、年龄、受教育程度、饮酒史、感染途径、体质量指数(BMI)、CD4细胞数等基线资料比较,差异无统计学意义(均P>0.05)。见表1。
2.2 血清甘油三酯及总胆固醇水平的变化
3组患者抗病毒治疗前血清甘油三酯、总胆固醇水平比较,差异均无统计学意义(均P>0.05)。入组300例感染者,280例按照原方案完成随访至48周,A组、B组、C组分别91例、94例、95例。3组血脂水平较基线均有升高(图1,2),其中C组甘油三酯曲线快速上升,升高幅度明显高于其他组,36周时达到高峰,高峰时甘油三酯水平为正常值上限的2倍,其他组未出现类似高峰;3组总胆固醇水平变化走势基本相同,前24周升高,24~48周时几乎呈水平状。48周时,C组血清甘油三酯及总胆固醇异常率分别为74.4%及30.2%,与A组比较,其血清甘油三酯异常率高31.3%,总胆固醇异常率低3.1%,与B组比较,其血清甘油三酯异常率高22.3%,总胆固醇异常率高3.7%。
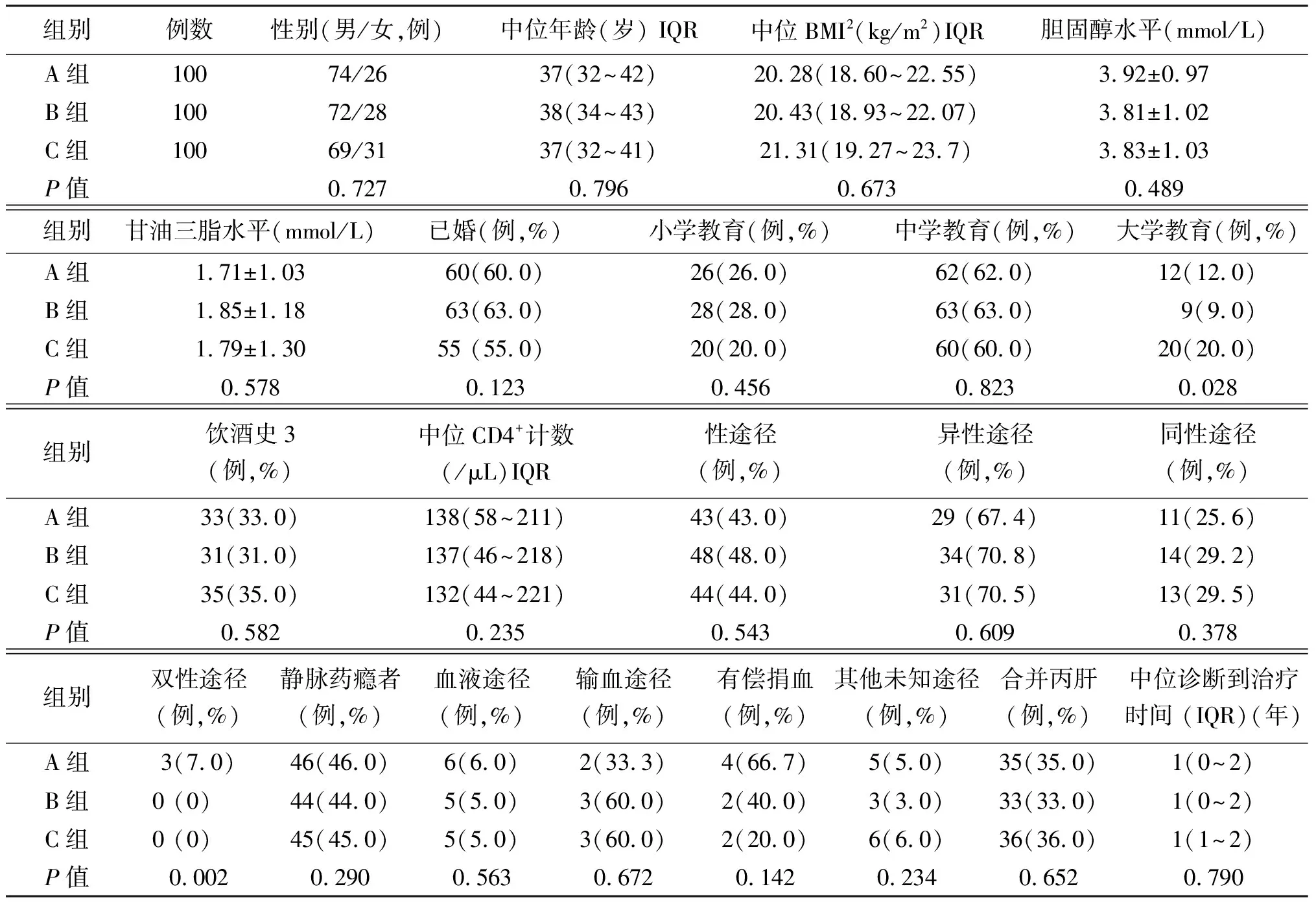
表1 3组初治HIV感染者基线资料(n=100)
注: IQR表示四分位间距; BMI表示体质量指数;饮酒史表示男性酒精摄入量不少于40 g/d,女性酒精摄入量不少于20 g/d,时间5年以上。
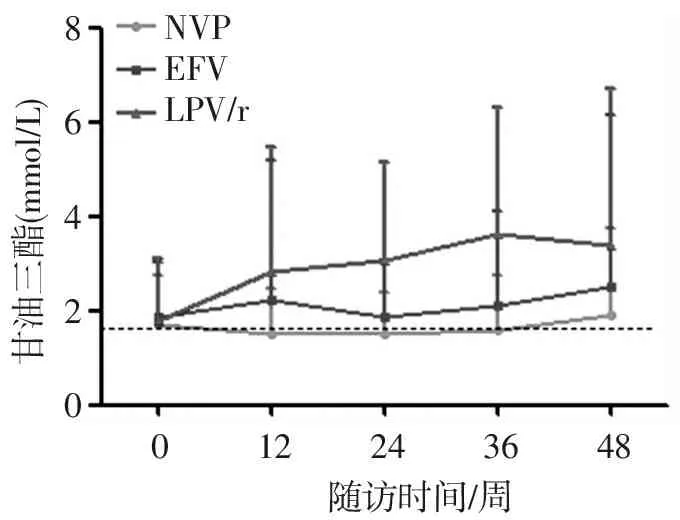
NVPEFVLPV/r甘油三酯(mmol/L)86420122436480随访时间/周
虚线为正常值上限1.69 mmol/L
图1 3组血清甘油三酯水平的变化
2.3 GEE统计学模型
通过GEE统计学模型把各个监测点情况纳入分析并校正后,结果显示:C组治疗48周后,甘油三酯水平比A组高1.07 mmol/L (P<0.01),比B组高0.69 mmol/L (P<0.01),见表2。C组治疗48周后,血清总胆固醇水平比A组高0.07 mmol/L (P=0.536),比B组高0.11 mmol/L (P=0.367),见表3。
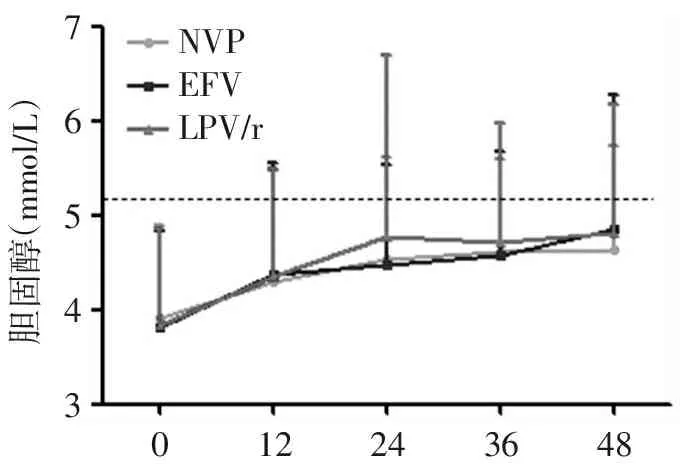
NVPEFVLPV/r76543胆固醇(mmol/L)122436480
虚线为正常值上限5.13 mmol/L
图2 3组血清总胆固醇水平的变化
2.4 不良反应与耐药性
除了前述血脂异常之外,其他常见的药物相关不良反应包括皮疹、中枢神经系统症状、恶心呕吐腹泻等消化道反应、转氨酶升高等。皮疹及转氨酶升高发生率最高的是A组,分别为18%、16%;中枢神经系统症状发生率最高的是B 组,主要为眩晕、恶梦等,比例高达54%;消化道反应发生率最高的是C组,主要为腹泻,分别为25%、59%。因不良反应而需要停药或调整用药方案的比例不高,为1%~4%。本研究失访率低,为1%~2%。对治疗48周后CD4+细胞计数低于基线的患者进行艾滋病病毒载量检测,对结果>1 000拷贝/μL的标本进行耐药检测,总检测标本数为38份,结果>1 000拷贝/μL有30份,其中2位患者检测出对3TC、NVP及EFV耐药。见表4。
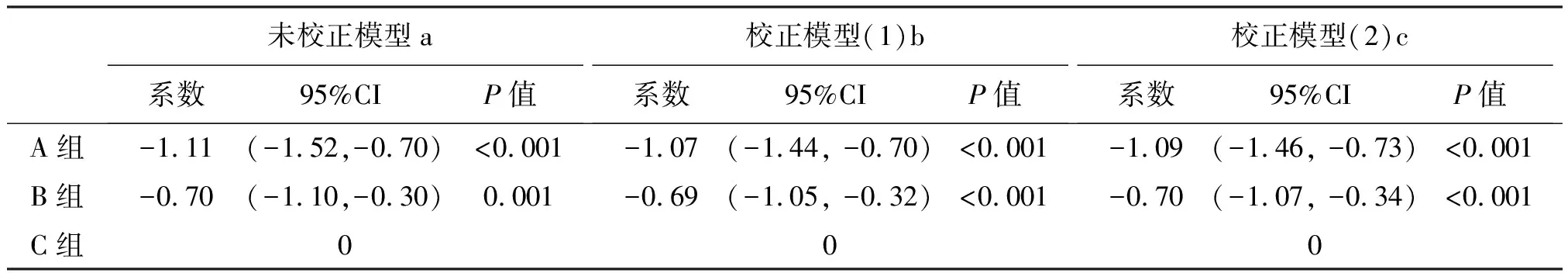
表2 GEE统计学模型量化比较3组甘油三酯变化
注:a:未校正GEE模型,QIC=5098.170,QIC-u=5073.954;b:校正模型1:对性别、年龄、教育情况、传播途径、感染诊断时长进行校正,QIC= 4989.748,QIC-u=4911.429; c:校正模型2:在校正模型1的基础上加上校正失访状态,QIC=4975.558,QIC-u 4892.404
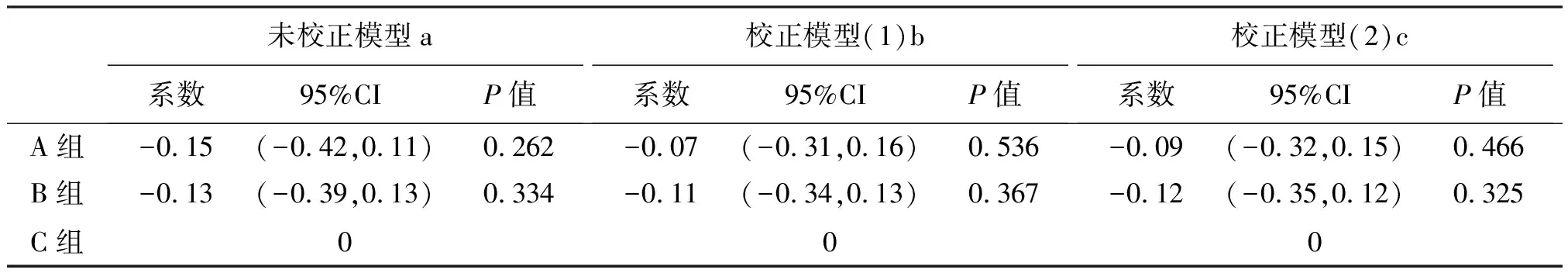
表3 GEE统计学模型量化比较3组总胆固醇变化
注:a:未校正GEE模型,QIC=2096.583,QIC-u=2071.762;b:校正模型1:对性别、年龄、教育情况、传播途径、感染诊断时长进行校正,QIC=1974.050,QIC-u=1844.282; c:校正模型2:在校正模型1的基础上加上校正失访状态,QIC=1970.014,QIC-u=1873.713。
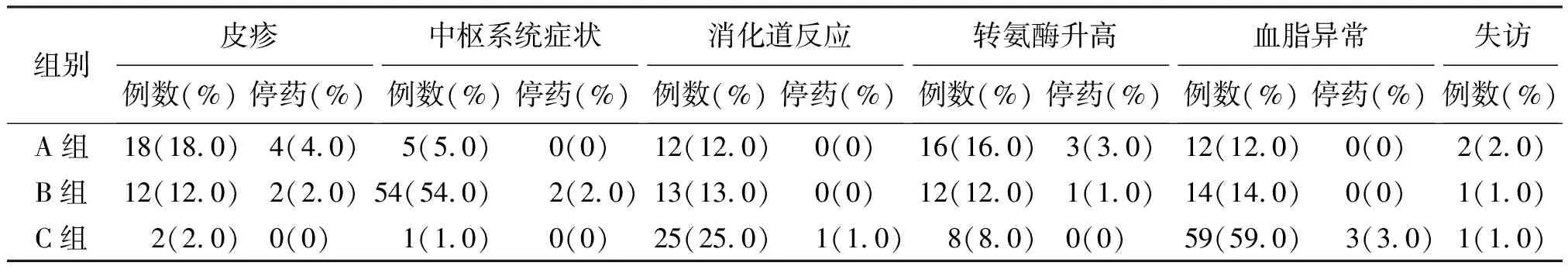
表4 3组不良反应与失访情况[例(%)]
3 讨论
如果说联合抗逆转录病毒疗法是艾滋病抗病毒治疗史上的一个里程碑,那么蛋白酶抑制剂,特别是LPV/r则开辟了一个新的纪元。虽然感染者本身比普通人群有更高的风险出现血脂异常[6],但自从LPV/r被应用于临床后,血脂异常得到越来越的关注。LPV/r在12年前被美国FDA批准用于成人感染者的抗病毒治疗,数月后被证实对6个月以上的儿童也是安全有效的[7]。无论对抗病毒初治患者还是经治患者,很多研究证实了包含LPV/r的抗病毒方案可导致西方国家的感染者血脂水平升高[1,8]。其中很多研究是比较几个蛋白酶抑制剂之间对血脂的影响[9],只有少数研究是在不同种类的抗病毒药物之间进行的[2]。
欧洲有研究表明,使用LPV/r抗病毒治疗的患者血脂异常率为13%~73%[10]。另外有部分研究表明大约有50%~70%感染者使用蛋白酶抑制剂治疗后出现高脂血症,60%~90%出现高甘油三酯血症,10%~50%出现高胆固醇血症[11-12]。Van等[13]于2004年进行了一个比较奈韦拉平与依非韦伦对血脂影响的研究,结果发现奈韦拉平组甘油三酯异常率及总胆固醇异常率分别为20.1%和26.9%,依非韦伦组为49% 和31%。本研究结果显示,LPV/r组血脂异常情况比奈韦拉平组及依非韦伦组严重得多,特别是对血清甘油三酯的影响。Hicks等[14]在2004年对初治感染者长期使用LPV/r抗病毒治疗的安全性及有效性进行了研究,在长达204周随访后,研究者发现中位血脂水平在治疗开始阶段出现升高后一直保持相对稳定的水平,甘油三酯及胆固醇在48周、96周、144周及204周均保持相对稳定的数值。本研究不仅提供了LPV/r治疗48周时血脂具体数值的变化情况,而且呈现了视觉上直观的变化曲线,结果显示LPV/r组的甘油三酯水平在36周时达峰,峰值的均值是基线水平的2倍。本研究还显示LPV/r组中胆固醇水平在治疗开始阶段出现缓和升高,在24周后维持相对稳定水平,这与Calza等[15]在2006年开展的一项研究的结果一致。Hicks等研究结果显示,总胆固醇的水平在LPV/r治疗24周后维持大致一样的水平,并在接下来的4年内都相当稳定。但是,Lafeuillade等[8]的研究指出只在使用含LPV/r的抗病毒方案治疗的第一个月内可以观察到甘油三酯及总胆固醇升高,此后维持相对稳定的水平。因此,应用LPV/r治疗的感染者在开始治疗的48周内应当密切检测血脂的变化,在治疗开始的36周内,临床医生应警惕甘油三酯水平的明显升高所致的自发性胰腺炎,尤其是在36周前后这个时间节点上,并且应当定期复查血清淀粉酶,特别是既往有胰腺炎病史的患者在接受LPV/r治疗后更加容易并发胰腺炎[16]。
一般来说,血甘油三酯水平大于11.3 mmol/L(1 000 mg/dL)时会增加罹患胰腺炎的风险[17]。本研究的结果与国外的研究结果基本一致,另外,本研究还展示了LPV/r导致血脂在48周内的详细波动情况,显示了初治感染者抗病毒治疗后最重要的血脂监测时间窗口为治疗后48周内,尤其是24周及36周这两个甘油三酯及胆固醇均可能急剧升高的时间节点。
我们采用GEE统计方法去量化每组对血脂影响的大小,由此我们可以更直观的明确各组对血脂影响的大小,尤其在抗病毒48周内。部分使用LPV/r导致高甘油三酯血症的患者在更改为NVP后可快速逆转,但更改成EFV时逆转效果差[18]。但暂时无其他研究像本研究一样对LPV/r和NVP及EFV对血脂的影响的对比作出量化。根据相关研究及推荐意见,在甘油三酯水平超过5.6 mmol/L时就应该给予干预措施[5,19]。经统计,在本研究中,LPV/r组中有5%~12%感染者需要进行降脂药物治疗,而EFV组及NVP组的需要进行降脂治疗的比例为3%~5% 和1%~2%,这个数据在既往的研究中亦未曾被提出过。
基于本研究结果,我们建议临床医生在进行抗病毒治疗前应该对感染者的血脂情况及既往病史进行评估。LPV/r对血脂尤其对甘油三酯的影响比EFV及NVP更大,对感染者启动抗病毒治疗后,尤其在启动抗病毒48周内及使用包含LPV/r的抗病毒方案时,应该严格制定随访时间表,密切监测血脂变化。在资源缺乏地区或国家,如中国或非洲国家,为了节省金钱和资源,我们可以分开监测甘油三酯及总胆固醇的水平,比如监测甘油三酯水平的间隔应该为每12周监测一次,直至48周,在48周以后,每24周监测一次,直至204周[16];监测总胆固醇水平时,应该每24周监测一次,直至204周[16]。Schambelan et al在2002年就已经建议在启动含蛋白酶抑制剂的抗病毒方案后3至6个月监测感染者血脂变化[23]。如果高脂血症发生后,首先应该进行低脂饮食及增加运动,然后才是更换抗病毒方案或者降血脂药物的治疗。
综上所述,在初治艾滋病感染者中,含LPV/r的抗病毒方案升高甘油三酯及胆固醇的程度比含EFV或NVP的抗病毒方案更为严重,应该警惕LPV/r引起的高脂血症及其可能带来的严重并发症。下一步还需要延长随访时间来观察血脂的进一步变化。

