血清γ谷氨酰基转移酶和尿酸水平与代谢综合征相关指标的关系分析
朱文奎,季蓉蓉,陈 洁,钱雅慧
·论著·
血清γ谷氨酰基转移酶和尿酸水平与代谢综合征相关指标的关系分析
朱文奎,季蓉蓉,陈 洁,钱雅慧
上海市浦东新区沪东社区卫生服务中心,上海,200129。
探讨γ谷氨酰基转移酶(GGT)和尿酸(UA)水平的变化对代谢综合征的影响及其相关关系。选取在社区卫生服务中心就诊的203例代谢综合征(MS)患者及231例非MS患者,比较两组间MS相关指标及其他各项检测指标的水平差异、GGT和UA异常率的差异,同时分析GGT和UA与MS相关指标之间的相关关系。MS组的GGT和UA的水平及GGT和UA异常率均明显高于非MS组。GGT与MS组分中腰围(WC)、空腹血清葡萄糖(FPG)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)相关,相关系数为0.092、0.092、0.173、-0.120;UA与MS组分中WC、TG、FPG、HDL-C相关,相关系数为0.253、0.150、-0.175、-0.256。GGT和UA为MS发生的重要危险因素,应加强社区MS患者GGT和UA水平的检测,积极干预,预防控制MS的发生发展。
γ谷氨酰基转移酶;尿酸;代谢综合征
进入21世纪以来,我们国家城镇化速度增快。伴随着城镇化进程,人们生活节奏变快,重体力劳动变少,饮食结构改变,导致我国成年人代谢综合征(metabolic syndrome,MS)的患病率正在逐年上升。有大型流行病学研究调查研究显示,我国大于60岁老年人MS的患病率高达25.5%[1]。MS与心脑血管疾病不良事件发病率的发病密切相关,已经逐步成为影响我国居民健康的重要危险因素。尽早的寻找出影响MS发生的危险因素,在早期发现预防MS以及MS的治疗中能发挥重要的作用。γ-谷氨酰转移酶(gamma-glutamyltransferase,GGT)为γ-谷氨酰基循环过程中重要的调节酶[2]。有研究[3]表明,GGT水平与机体的氧化应激水平有着密切的关系。尿酸(uric acid,UA)是核酸的代谢产物。有研究表明[4],UA水平增高,能降低体内一氧化氮(NO)浓度,同时还可以做为一种抗氧化剂参与到氧化应激过程中。而近年研究表明[5],氧化应激和炎症机制参是代谢综合征的发生发展的重要机制。临床上常用的两种指标GGT和UA与氧化应激密切相关。本研究通过对GGT和UA与MS相关性进行研究,寻找MS发展的相关危险因素,为社区MS患者的防治工作提供依据。
1 对象与方法
1.1 研究对象
选取2018年1—5月在上海市浦东新区沪东社区卫生服务中心门诊进行体检的MS患者203例,包括男性119例、女性112例,同时选取同期进行体检的非MS体检者231例作为对照组,男性108例,女性100例。通过问卷调查和实验室检查的结果进行排除,排除标准:①临床资料不健全,如年龄、腰围(waist circumference,WC)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、高血压治疗、饮酒史等资料不全;②肝酶异常升高超过临床参考范围2倍及以上者,肝、肾器质性病变;③恶性肿瘤、甲状腺功能亢进或减退、其他免疫系统疾病等;④有大量饮酒史;⑤服用过噻嗪类利尿剂,调脂药或降糖药等。
MS的诊断标准[2]:①中心性肥胖(我国居民的WC推荐切点为男性≥90 cm、女性≥80 cm);②血压升高:SBP≥130/85 mmHg,或者以往被确诊为高血压;③高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平下降:HDL-C< 1.04 mmol/L;④甘油三脂(triglycerides,TG)水平增高:TG≥1.7 mmol/L;⑤空腹血清葡萄糖(fasting blood glucose,FPG)水平增高:FPG≥6.1 mmol/L或糖耐量实验2 h血糖≥7.8 mmol/L,或者以往被确诊为2型糖尿病。
1.2 方法与试剂
收集被检查者的一般临床资料,包括年龄、性别、SBP、DBP等。所有对象均清晨空腹采集不抗凝静脉血5 mL,EDTA-K2抗凝全血1.5 mL。不抗凝静脉血,1760×g离心8 min,分离血清检测其FPG、GGT、UA、TG、HDL-C、胆固醇(cholesterol,CHOL)、尿素氮(urea nitrogen,Urea)、血肌酐(creatinine,Crea)等相关指标的检测,EDTA-K2抗凝全血进行糖化血红蛋白(glycosylated hemoglobin,HbA1c)的测定。
仪器和试剂:采用罗氏Cobos C501全自动生化分析仪及其配套的试剂和校准品进行FPG、GGT、UA、TG、HDL-C、CHOL、Urea、Crea水平分析;HbA1c水平应用TOSOH G8全自动分析仪及其配套的试剂和校准品采用高压液相方法进行测定。所有操作均严格按照试剂盒和仪器说明书进行。
1.3 统计学分析
使用SPSS 22.0软件进行数据统计,正态性检验采用Kolmogorov-Smirnova(K-S)检验,符合正态分布的计量数据,以(±)表示,均值比较采用方差分析,异常率比较采用卡方检验,相关性检验应用Pearson相关分析,<0.05表示差异有统计学意义。
2 结果
2.1 MS组与非MS组相关指标比较
MS组与非MS组两组间在年龄、性别间差异无统计学意义(>0.05)。MS组的WC、SBP、DBP、FPG、TG、HbA1c、UA、GGT和CHOL的水平均高于非MS组,差异有统计学意义(<0.05);MS组HDL-C的水平低于非MS组,差异有统计学意义(<0.05)。两组间Crea和BUN间的水平差异无统计学意义(>0.05)。见表1。
表1 MS组与非MS组相关指标比较(±s)
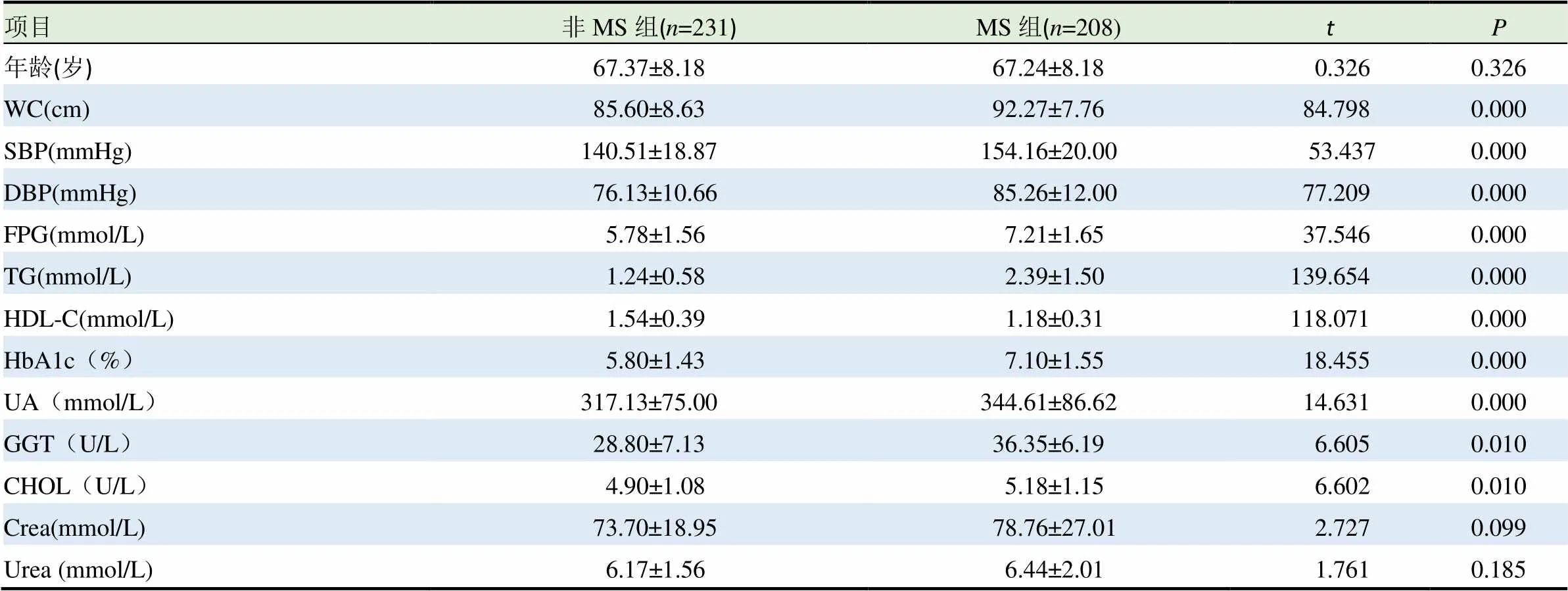
表1 MS组与非MS组相关指标比较(±s)
项目非MS组(n=231)MS组(n=208)tP 年龄(岁)67.37±8.1867.24±8.18000.3260.326 WC(cm)85.60±8.6392.27±7.76084.7980.000 SBP(mmHg)140.51±18.87154.16±20.000053.4370.000 DBP(mmHg)076.13±10.66085.26±12.00077.2090.000 FPG(mmol/L)05.78±1.5607.21±1.65037.5460.000 TG(mmol/L)01.24±0.5802.39±1.50139.6540.000 HDL-C(mmol/L)01.54±0.3901.18±0.31118.0710.000 HbA1c(%)05.80±1.4307.10±1.55018.4550.000 UA(mmol/L)317.13±75.00344.61±86.62014.6310.000 GGT(U/L)28.80±7.1336.35±6.19006.6050.010 CHOL(U/L)04.90±1.0805.18±1.15006.6020.010 Crea(mmol/L)073.70±18.95078.76±27.01002.7270.099 Urea (mmol/L)06.17±1.5606.44±2.01001.7610.185
2.2 两组人群GGT和UA水平异常率比较
MS患者组GGT和UA异常率分别为18.27%和28.85%,明显高于非MS组的6.93%和13.42%。两组患者GGT和UA水平的异常率差异有统计学意义(χ=22.925,<0.01;χ=15.850,<0.01)。
2.3 GGT和UA与MS相关指标分及其他指标的相关性分析
GGT与各项指标的Pearson相关分析结果显示:GGT与WC、FPG、TG、UA呈正相关;与年龄、HDL-C呈负相关,差异有统计学意义(<0.05)。UA与各项指标的Pearson相关分析结果显示:UA与年龄、WC、TG、UA呈正相关,与FPG、HDL-C、HbA1c呈负相关,差异有统计学意义(<0.05)。见表2。
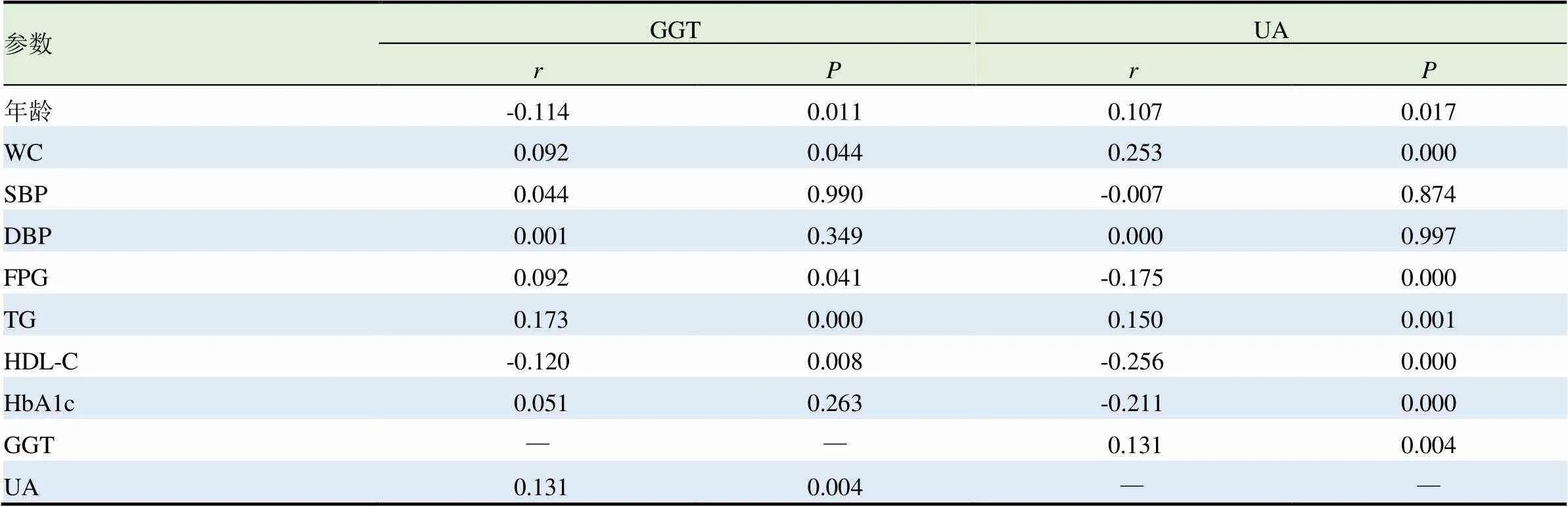
表2 GGT和UA与各指标的相关性检验
3 讨论
MS由于与不良心血管事件的发生率显著相关[7],近年来引起越来越多的关注,其囊括了腹型肥胖、血糖异常、血脂异常和血压升高,是一种由于机体代谢障碍引发的心血管风险因素聚集的综合征。MS的发病机制尚不明确,目前公认的MS的中心环节是胰岛素抵抗和中心性肥胖[8],而胰岛素抵抗和肥胖均与机体的氧化应激状态和慢性炎症密切相关[9]。MS患者长期处于代谢异常的状态,会导致机体的氧化应激增强,蛋白质和脂质的结构和功能发生变化,引起氧化反应增强,诱发血管内皮的损伤,导致心血管不良事件的发生[10]。
GGT目前临床上主要用作反映肝功能障碍和过度饮酒的可靠指标,是一种含有巯基的线粒体酶,为细胞外谷胱甘肽代谢过程中的关键酶[11]。细胞外还原性谷胱甘肽的主要作用是保护细胞免受代谢过程中所产生氧化剂的损伤,一旦机体内氧化应激反应增强,谷胱甘肽的需求量就会增加,导致GGT的异常变化。本研究结果显示,MS组GGT的水平和异常值检出率均高于非MS组,可能是由于MS患者体内的氧化应激反应增强,影响体内GGT的水平。同时,GGT与MS组中的中心性肥胖指标WC、TG和FPG呈正相关,与HDL-C呈负相关。一项大样本的调查研究[12]发现,体内GGT的水平与肥胖程度密切相关,血脂水平的异常与体内GGT水平相关可能是由于体内巯基化合物代谢紊乱引起氧化应激增强导致。体内的氧化应激增强导致胰岛β细胞的功能损害,产生胰岛素抵抗,进一步导致血糖水平的异常[13]。本研究结果发现,GGT与血压并没有直接的相关关系。有一项跟踪随访3年的研究[14]发现,GGT的水平与高血压的发病风险独立相关,可能与选择的人群和研究方法不同有关。
UA主要是体内细胞、食物在代谢过程中的核酸氧化分解产物,由于体内代谢酶的缺乏,UA生成过多或肾脏排泄能力下降都会导致体内尿酸的水平异常增高[15]。以往经常用作痛风和肾功能指标。研究发现,UA与肥胖和体内的代谢异常关系密切,UA通过氧化应激和激活炎症反应的机制,抑制胰岛信号通路从而导致胰岛抵抗[16],而胰岛素抵抗是MS发生发展的重要环节。本研究发现MS组的UA水平及UA异常发生率均明显高于非MS组。同时UA与MS组中的WC、TG、HDL-C相关。研究认为MS患者体内的高尿酸水平可能与胰岛素抵抗相关。由于MS患者脂代谢异常肝细胞内生成过多的游离脂肪酸,游离脂肪酸可导致氧化应激反应增强生成过多的氧自由基,过多的氧自由基可破坏胰岛功能,引起胰岛素抵抗影响肾脏功能,导致尿酸排泄减少,血UA水平增加。同时,由于肥胖患者摄入量大、消耗少,体内合成的UA相应的增加[17]。血UA水平与FPG,HbA1c水平呈负相关。有研究表明通过肾脏排泄的UA与血糖呈正相关。随着血糖水平的增高,血清中UA水平反而上升[18]。其主要机制为血糖水平升高引起的渗透性利尿以及肾小球的超滤引起机体对UA的清除增加。有研究表明UA水平与血压水平相关,与本研究有差异,可能与选择的研究对象不同有关。
综上所述,MS患者的血清GGT和UA水平高于非MS人群,同时GGT和UA的水平均与MS相关指标中的WC、TG、HDL-C和FPG密切相关。因此,在MS的社区防治工作中,除了关注MS本身的中心性肥胖、血糖、血脂和血压的同时,应积极的控制GGT和UA水平,以达到降低社区居民心脑血管疾病的发生率,同时改善预后。
[1] 丁存涛, 李静, 诸国华, 等. 老年原发性高血压患者血尿酸与代谢综合征各组分相关关系研究[J]. 中华老年心脑血管病杂志, 2018, 20(1):20-23.
[2] Kunutsor S K, Laukkanen J A, Burgess S. Genetically elevated gamma-glutamyltransferase and Alzheimer's disease[J]. Exp Gerontol, 2018, 106:61-66.
[3] 张越虹, 马义丽, 慈丽娟, 等. 血清γ-谷氨酰转移酶与冠心病影响因素及血管病变严重程度的相关性研究[J]. 现代生物医学进展, 2018, 18(19):3716-3719.
[4] 张红燕, 王强. 丙氨酸氨基转移酶、尿酸及白细胞检测用于分析和诊断代谢综合征的可行性研究[J]. 中国处方药, 2018, 16(10):131-132.
[5] 尹士男, 江华. 代谢综合征的诊治进展[J]. 中华老年心脑血管病杂志, 2018, 20(11):1121-1123.
[6] 中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38(4):292-344.
[7] 殷璐, 范慧洁, 董其涓, 等. 成年人脂质蓄积指数、内脏脂肪指数与代谢综合征的相关性[J]. 实用医药杂志, 2018, 35(11):989-991.
[8] 张月颖, 李云楚, 倪青. 代谢综合征的诊断与中西医治疗[J]. 中国临床医生杂志, 2018, 46(11):1271-1274.
[9] 赵越, 钱唯韵, 王东, 等. 代谢综合征联合高尿酸血症评估冠心病发病风险的价值[J]. 江苏大学学报(医学版), 2018, 28(5):418-422.
[10] 王燕, 郭佳. 高尿酸与老年2型糖尿病及心血管并发症相关性的研究进展[J]. 医学综述, 2018, 24(20): 4073-4077.
[11] 蒋凤秀,陆泽元,张晶,等.谷氨酰转肽酶与非酒精性脂肪肝在代谢综合征中相关性研究[J].包头医学院学报,2018,34(05):31-33.
[12] Hong N S, Kim J G, Lee Y M, et al. Different associations between obesity and impaired fasting glucose depending on serum gamma-glutamyltransferase levels within normal range: a cross-sectional study[J/OL]. BMC Endocr Disord, 2014, 12, 14:57 (2014-07-12) https://bmcendocrdisord.biomedcentral.com/track/pdf/10.1186/1472-6823-14-57. DOI:10.1186/1472-6823-14-57.
[13] 刘文慧, 白金娥, 张慧. 血清丙氨酸氨基转移酶及γ-谷氨酰基转移酶水平与2型糖尿病的关系[J]. 检验医学, 2018, 33(1):20-25.
[14] 刘良义, 王薇, 王彦存. 血清γ-谷氨酰基转移酶水平与高血压发病风险的相关性研究[J]. 吉林医学, 2018, 39(10):1848-1851.
[15] 周涛. 老年2型糖尿病患者血尿酸水平检测的临床意义探讨[J]. 临床检验杂志(电子版), 2018, 7(4):752.
[16] 李赓煦. 2型糖尿病患者血尿酸与非酒精性脂肪肝的相关性研究[J]. 世界最新医学信息文摘, 2018, 18(88): 1-4.
[17] 张宏, 赵茜, 孟岚, 等. 宁夏健康体检人群高尿酸血症与代谢综合征的关系[J]. 中国慢性病预防与控制, 2018, 26(9):660-663.
[18] 方元元, 江彤. 2型糖尿病患者合并高尿酸血症情况的最新研究进展[J]. 世界最新医学信息文摘, 2018, 18 (76):105-106
Correlation Between Changes of Serum γ-glutamyltransferase and Uric Acid Levels and Metabolic Syndrome
To investigate the effects of changes in gamma glutamyl transferase (GGT) and uric acid (UA) levels on metabolic syndrome and their correlation.A total of 203 patients with metabolic syndrome (MS) and 231 non-MS were selected as the control group in a community health service center. The difference of MS component and other indicators between the two groups and the difference of GGT and UA abnormalities were compared. At the same time, the correlation between GGT and UA and MS components was analyzed.The levels of GGT and UA and the abnormal rates of GGT and UA in the MS group were significantly higher than those in the non-MS group. GGT was related to waist circumference, fasting blood glucose, triglycerides and high density lipoprotein cholesterol in MS component, and the correlation coefficients are 0.092, 0.092, 0.173, -0.120. UA and MS components are related to WC, TG, FPG and HDL-C, and the correlation coefficient is 0.253. , 0.150, -0.175, -0.256.GGT and UA are important risk factors for MS. It is necessary to strengthen the detection of GGT and UA levels in community MS patients, and actively intervene to prevent and control the occurrence and development of MS.
Gamma -glutamyltransferase; Uric acid; Metabolic syndrome
10.16117/j.cnki.31-1974/r.201905015
朱文奎(1983—),男,江西南昌人,本科,主管医师,主要从事社区卫生保健工作,344478681@qq.com。
2019-05-22。

