胆固醇酰胺衍生物Langmuir复合膜自组装与纳米结构研究
贺 颖,王昭颖,余旭东,饶砚迪,李景红,佟 琦,焦体峰,*
(1.燕山大学 环境与化学工程学院,河北 秦皇岛 066004;2.燕山大学 河北省应用化学重点实验室,河北 秦皇岛 066004;3.河北科技大学 理学院,河北 石家庄 050018)
0 引言
近年来,胆固醇作为一种有机小分子单元,由于其官能团容易衍生且成本较低,已成为有机合成研究领域的一个有吸引力的初始材料或模型系统。另外,它是一种具有刚性、疏水性的环状分子,在堆积过程中可能会发生一定的空间错位。综合上述特性,在超分子化学领域中,胆固醇不同类型衍生物的应用,如液晶功能材料[1-3]、凝胶[4-7]、膜材料[8]等更是被多篇文献报道过。然而,胆固醇衍生物小分子在超分子气液界面自组装材料研究领域还鲜有报道。
气液界面为超分子自组装提供了很好的环境,Langmuir-Blodgett (LB)膜是具有单分子厚度的超薄有序膜。将亲水头和疏水尾的两亲分子分散在水面上,由水面的两端向中部逐渐施加压力,促使水面上的分子排列紧凑,在气/液界面处形成一层有序的不溶性单分子膜。Langmuir-Blodgett技术是一种能够在分子水平上精确控制膜厚度的制膜技术,以及将单分子界面(通常是空气-水界面)转移到固体表面并实现连续转移组件的技术[9-12]。
本研究使用两种不同胆固醇衍生物小分子,分别称作CH-1,CH-2,通过LB技术以纯水为亚相在气液界面上进行行为可控的分子界面自组装,制备了Langmuir复合膜。该复合膜的形貌和合成机理运用AFM、UV、IR、TEM和SEM等方法进行表征。本研究工作胆固醇衍生物复合LB膜超分子自组装为今后纳米材料的探索提供了新的思路和方向。
1 制备实验
1.1 实验试剂与仪器
本研究使用的胆固醇衍生物分子是根据文献报道方法合成,分别命名为CH-1、CH-2(如图1)。CH-1是通过Pang等[13]报道方法合成的一种带有多个氢键的胆固醇衍生物,依次通过两个酰胺键与4位溴原子取代的萘酰亚胺基团相连。CH-2分子的合成方法是依据Wang等[14]的报道,在CH-1分子的基础上引入了酰胺芳香基团。氯仿、无水乙醇等化学试剂,均购自秦皇岛化学试剂厂,使用之前不做任何处理。实验使用的水均为二次净化的超纯水。
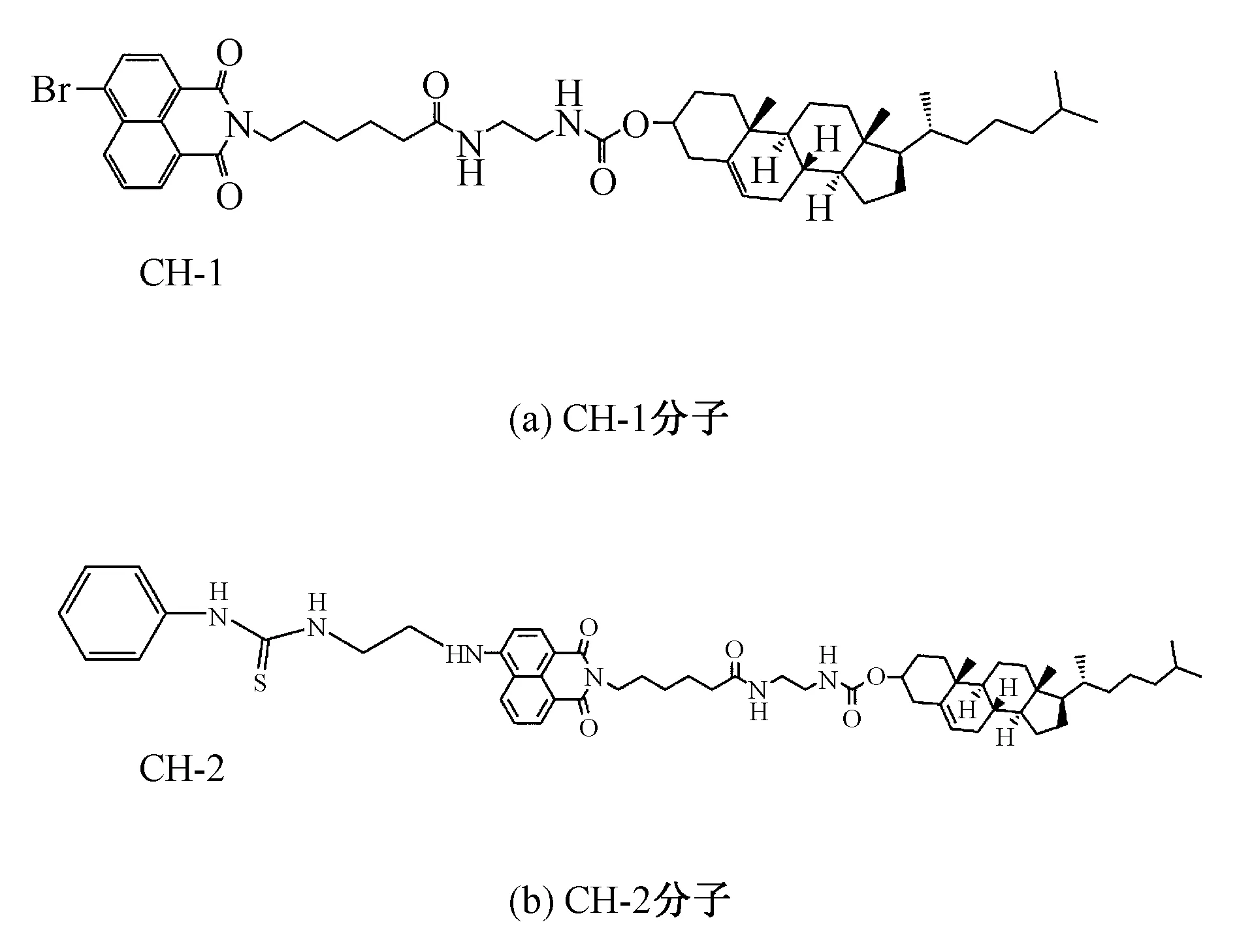
图1 胆固醇衍生物分子CH-1和CH-2的结构图
Fig.1 Structure of the cholesterol derivative molecules CH-1 and CH-2
使用KSV-NIMA MINI-trough LB系统进行表面压力-分子面积(π-A)等温曲线的测定和LB膜的制备。本研究Langmuir膜的IR测试是将膜沉积在CaF2底片上,采用傅立叶红外光谱仪(美国尼高力公司Nicolet Is10)进行测试。紫外光谱分析采用日本岛津公司UV-2550紫外可见分光光度计。原子力显微镜(AFM)采用Nanoscope Model Multimode 8(德国布鲁克公司)系统进行测试。扫描电镜分析(SEM)通过场发射枪FEI QUANTA FEG 250 (FEI Corporate, Hillsboro, OR, USA)进行扫描,所有的样品都被喷涂了金纳米颗粒。透射电镜分析采用(TEM, HT7700, High Technologies Corp.,Ibaraki, Japan)进行拍照观察。
1.2 实验过程
1)胆固醇衍生物分子均相溶剂的制备:用电子分析天平取CH-1样品分子6 mg,量筒量取10 mL氯仿溶液,混合超声分散,配制成0.6 mg/mL的CH-1氯仿溶液作为均相液。此处使用氯仿溶液的原因:由于胆固醇衍生物分子水溶性较差,氯仿能较好地溶解胆固醇衍生物分子,有利于形成均相液;氯仿作为挥发溶剂,有助于下一步制备过程中胆固醇衍生物分子更均匀地扩散在亚相表面。
2)制备Langmuir膜:首先,使用无水乙醇和超纯水把LB系统聚四氟乙烯材质的凹槽用清洗刷预处理,保持凹槽洁净。然后,将亚相(纯水)倒入凹槽,用微量玻璃进样器把30 μL的均相液逐滴扩散在水相表面。此时,为了确保氯仿溶剂充分地挥发以及均相液在水相表面均匀地扩散,静待30 min。随后,设置LB系统的各项参数,如:目标压力、膜压缩速度等,由此可获得π-A曲线。经分析选定合适目标膜压15 mN/m,重复上述步骤,在该确定压力下用垂直提升法或者水平附着法将得到的Langmuir薄膜沉积至云母片、石英片、CaF2片或玻璃片基底上。
制备单层Langmuir膜样品用于原子力显微镜测试。其基底是新鲜剥离的云母片,具体过程是把刚剥离的云母片在LB系统控制下,垂直浸入到水相界面以下,之后再扩散均相液。待氯仿溶剂挥发完全,同时达到系统设置的目标膜压时,以1 mm/min的速度将云母基片垂直从界面下向上提拉,最终成功转移单层Langmuir膜。而制备测试紫外-可见光谱样品的底片时采用石英片沉积多层膜的方法,即直接倒入亚相后铺展溶液,设置一定目标膜压,待溶剂挥发后,将膜压至目标压力下以达压力平衡,迅速将石英片水平附着到气-液界面,完成单层Langmuir膜的转移,每次达到压力平衡时重复该动作,即完成多层Langmuir膜的转移。红外光谱、透射电镜及扫描电镜测试样品制备基片的方法与紫外-可见光谱样品基片类似,均可得到多层Langmuir膜。
2 结果与讨论
2.1 π-A曲线分析
首先,表面压力-面积等温线可以显示形成了稳定的LB膜及其在气液界面中的分子取向和相变[15]。图2显示了在纯水相表面扩散的CH-1分子与CH-2分子π-A等温线。可以清楚地看到CH-1分子曲线随着压缩的进行,分子面积逐渐减小,表面压增加速率逐渐变大。值得注意的是,在16 mN/m处出现拐点,拐点之后继续压缩,表面压回落出现一平台,平台处随着压缩的进行表面压变化不大,这可归因于从膨胀液体到凝聚态的相变,或者归因于非单分子结构的形成[16]。因此,CH-1分子的图像表明了在16 mN/m表面压下发生相变,且该平台后膜变得更加致密。对于CH-2分子扩散在纯水相上的π-A等温线来说,它显示了在刚开始压缩的一段过程增加趋势与CH-1分子接近重合,但随着压缩进行未出现平台,表面压力的增加速率逐步增大,致使整个过程呈线性增加,由此得出膜的紧密程度随压缩过程的进行逐渐变大。而未出现平台阶段我们猜想可能与CH-2分子结构酰胺芳香取代基的取代效应有关。

图2 CH-1和CH-2纯水亚相表面压力-分子面积等温线
Fig.2 Surface pressure-area isotherms of CH-1 and CH-2 in pure water subphase
2.2 紫外光谱分析
两种不同分子的扩散膜可分别转移到石英基底上,并用紫外可见光谱对其进行表征。图3是将CH-1及CH-2分子分别以多层LB膜沉积在石英底片上测得的UV光谱。从图中可以看出,CH-1分子铺展水相表面时,在240 nm处的最强吸收峰为含有未共用电子对的溴原子,含有未共用电子对原子的饱和化合物都可能发生n→σ*跃迁而出峰[17]。此外,在346 nm处有一紫外吸收峰为含有不饱和键的胆固醇结构特征峰。CH-2分子在240 nm处的吸收峰消失,变为带有小吸收峰的平台,即为苯环的振动能级跃迁而产生的吸收峰,属于芳香族化合物的特征吸收峰[8]。从图中可以清晰地看到在300~500 nm范围内,CH-2分子的最大吸收波长向波长增大的方向移动,即:原近紫外光区的346 nm处吸收峰进入可见光区的446 nm处。这可能是由于CH-2分子相对于CH-1分子来说,引入了氮原子、硫原子(含未成键p电子的杂原子基团)以及苯环共轭体系,发生了电子转移,给电子基导致原含有萘酰亚胺基团和胆固醇结构的共轭体系电子云的流动性增大,分子中π→π*跃迁的能级差减小,从而向长波方向移动。

图3 CH-1和CH-2分子LB多层膜的紫外光谱
Fig.3 UV spectra of CH-1 and CH-2 molecular LB multilayer films
2.3 红外光谱分析
为进一步表征复合膜,分别将CH-1、CH-2分子的多层Langmuir膜转移在CaF2基片上进行了红外光谱的表征。在图4中可以观察到官能团区的主要吸收峰。对于CH-1分子,1 541 cm-1处峰归属于C—N伸缩振动,1 685 cm-1处的振动峰为酰胺基团的羰基伸缩振动[18],2 929 cm-1处为C—H伸缩振动峰,3 300 cm-1处是胆固醇的醇羟基缔合吸收峰。与CH-1分子相比,CH-2号分子在1 586 cm-1处对应的吸收峰有所增强,这可能是苯环骨架的伸缩振动峰,这也印证了CH-2结构中酰胺芳香基团的取代效应。并且,可以推测两种分子复合膜在3 500~3 000 cm-1之间出现的吸收峰可能与分子间氢键的形成有关,进而影响分子成膜的聚集状态。
2.4 原子力显微镜图分析
图5展示的是将两个不同分子在纯水亚相铺展的单层Langmuir膜转移到云母片上进行原子力显微镜观察的形貌。从图中可以看出,在CH-1分子基础上接入碳氮键相连的苯环后形成的CH-2分子形貌很明显与CH-1分子不同。CH-1分子可以较好地铺展在纯水表面,形成清晰的带有一定空隙的薄膜形貌。而CH-2分子铺展在纯水亚相上形成的复合膜表面呈现出长约7~10 μm,宽约0.3~0.6 μm的粗糙微米棒结构,且聚集体间有少量的重叠堆积。
这可能是由于CH-2引入酰胺芳香基团,增强了分子内/间氢键的作用[19],在表面压力作用下,促使分子形成棒状聚集态。

图4 CH-1和CH-2分子多层LB膜的红外光谱
Fig.4 Infrared spectra of CH-1 and CH-2 molecular multilayer LB films
2.5 透射和扫描电镜分析
为进一步研究界面组装的形貌,分别将两个分子在纯水亚相铺展的单层Langmuir膜转移到铜网上进行透射电镜下的形貌表征,及多层Langmuir膜转移到玻璃片上并喷涂了金纳米颗粒增强其导电性,从而进行扫描电镜下的形貌表征,如图6~7所示。
透射电镜下,CH-1分子可呈现较均匀的铺展膜状,且能明显看到薄片状的小分子。CH-2分子存在一定程度下的堆叠并含有特殊的棒状的结构,在一定程度上与原子力显微镜下的形貌相对应。为了方便在扫描电镜下观察到膜表面的形貌,转移了多层的Langmuir膜到玻璃基底上。图7(a)是扫描电镜下观察到的CH-1分子Langmuir膜基本形貌,可以看到该分子在水相界面扩散后的薄膜表面上呈现堆积重叠状分布。图7(b)展示出了CH-2分子Langmuir膜表面的基本形态,它呈现出纳米棒堆叠团聚的形态。

图5 CH-1和CH-2分子单层LB膜的原子力显微镜图像
Fig.5 Atomic force microscope images of CH-1 and CH-2 molecular monolayer LB films
综上所述,两种分子膜表面均出现累积排列的团聚。这可能是膜表面胆固醇、苯环结构以及酰胺取代基团发生共轭效应,分子间氢键的形成等都会影响分子分布与组装,从而促使Langmuir膜内形成不同的表面微纳米结构。同时,在外力压缩作用下,有利于多层膜基片紧凑叠加,使分子之间相互堆积程度增大[20]。

图6 CH-1和CH-2单层LB膜的透射电子显微镜图像
Fig.6 Atomic force microscope images of CH-1 and CH-2 monolayer LB films
图7 CH-1和CH-2多层LB膜的扫描电子显微镜图像
Fig.7 Scanning electron microscope image of CH-1 and CH-2 multilayer LB film
2.6 LB膜自组装示意图
结合以上实验数据,图8给出了利用CH-1分子,以纯水为亚相通过气液界面自组装制备Langmuir膜的过程示意图。对于CH-1分子在气液界面扩散的Langmuir单层膜,分子中的萘酰亚胺基团为亲水基团[21],故其具备的亲水基与另一端的胆固醇疏水基使得该分子能够在气液界面上形成稳定的Langmuir单分子层膜,在π-A等温线和原子力显微图像中证实了这一现象。在水相界面,CH-1分子随着压缩的进行,表面压不断增大,使得CH-1分子之间不断趋向更加紧密堆积排列,链状分子也因基团的相互紧密堆积而逐渐趋于直立。与CH-1分子不同的是,CH-2分子接入的苯环基团为疏水基团,即在界面自组装过程中,CH-2分子呈两端疏水,中部亲水的弯曲状态,这种结构导致CH-2分子在亚相表面铺展更佳。其余均与CH-1分子同理,可知CH-2分子的Langmuir膜制备过程。
3 结论
本研究工作设计利用两种不同胆固醇衍生物CH-1分子及酰胺芳香基团取代后的CH-2分子,以纯水为亚相,通过自组装机理,在气液界面上进行复合Langmuir膜的制备,并成功将单层或多层Langmuir薄膜沉积到不同固体基片上,运用多种分析表征技术研究其分子界面组装机理以及引入取代基后分子界面组装行为的变化。实验结果表明:
1)CH-1、CH-2分子均能在气液界面上形成稳定的单分子层Langmuir膜;
2)CH-2分子中酰胺芳香基团的取代效应,导致界面组装行为及复合Langmuir膜结构发生变化。
这项研究工作为今后胆固醇衍生物Langmuir膜的制备以及纳米结构的研究提供了新的思路与方向。

图8 CH-1分子界面LB膜自组装示意图
Fig.8 Schematic diagram of CH-1 molecular interface LB film self-assembly

