常压室温等离子体诱变筛选高产多糖猴头菌株的研究
杨 珊,杨 焱,李巧珍,吴 迪,杨瑞恒,汪文翰,张赫男*
(1农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,上海市农业科学院食用菌研究所,上海201403;2上海海洋大学食品学院,上海201306)
猴头菌(Hericium erinareus)是我国著名的食药用真菌,与熊掌、海参、鳖鱼翅并列为“四大名菜”,并有“山珍猴头,海味燕窝”的美称[1]。大量研究表明,猴头菌不仅对消化系统疾病具有疗效,还具有增强免疫、抗肿瘤、抗衰老、降血糖、保护神经和抗菌等作用[2]。猴头菌的化学成分非常复杂,有多糖、甾醇类、萜类、脂肪酸、酚类等化合物,其中多糖是研究最多的成分之一。猴头菌的主要活性物质为猴头多糖[3]。大量的药理、药效研究证明,猴头菌子实体多糖和菌丝体多糖都具有抗肿瘤、抗氧化、提高免疫力、降血糖、抗疲劳等功效[4-8]。猴头菌多糖现在主要来源于栽培的子实体和固体发酵菌丝体[9],但菌株的退化致使其多糖含量不高且不稳定,影响了猴头菌类产品的功效与质量,因此优良猴头菌株的获得尤为重要。
物理诱变技术是微生物育种中获得高效、高产菌株的重要方法之一[10]。利用物理诱变筛选高效菌株,在优化食品微生物性能、提高其产品质量方面具有广阔的应用前景[11]。目前,利用紫外诱变进行微生物诱变育种研究报道最多,但紫外诱变的材料易发生光修复[12],影响诱变结果,因此采用高效、新颖的诱变方法尤为关键。常压室温等离子体(ARTP)诱变技术是一种新型的诱变技术,具有诱变温度低、无需真空环境、等离子体射流均匀等特点,与传统微生物诱变相比,操作安全性高,且对环境无污染[13]。目前,该技术主要应用于酵母大肠杆菌及刺糖多孢菌等多种微生物的选育并取得了良好效果[14],但在猴头菌的选育中尚未有报道。本研究首次利用ARTP诱变技术对猴头菌原生质体进行诱变,以期获得性状稳定遗传、高产多糖的猴头菌株,为猴头菌类产品的深度开发和推广奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
供试猴头菌株0605由上海市农业科学院食用菌研究所提供。
1.1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,水1 000 mL,pH 5.5。种子培养基:马铃薯200 g,葡萄糖20 g,KH2PO42 g,MgSO4·7H2O 1 g,水1 000 mL。发酵培养基:酵母粉10 g,葡萄糖20 g,KH2PO42 g,MgSO4·7H2O 1 g,水1 000 mL。再生培养基:PDA培养基中加入甘露醇,使培养基中甘露醇浓度为0.6 mol/L。
1.1.3 试剂
溶壁酶购自广东微生物所;崩溃酶、Trolox、ABTS、TPTZ均购自美国Sigma公司;七水硫酸亚铁、氯化钠、Tris-盐酸、乙二胺四乙酸、苯酚、氯仿、异戊醇、甘露醇均购自国药试剂公司。
1.1.4 仪器
Ⅱ型ARTP诱变仪(无锡源清天木生物科有限公司)、ISG-180恒温培养箱(Thermo Scientic公司)、DKY-Ⅱ回转式恒温调速摇床柜(上海杜科自动化设备有限公司)、恒温混匀摇床(ZWY-240,上海智诚分析仪器制造有限公司)、Allegratm25R Centrifuge离心机(美国Beckman公司)、FA2004N分析天平(上海精密科学仪器有限公司)、SS-325高压蒸汽灭菌锅(TOMY公司)、Veriti PCR仪(基因有限公司)、DYY-GC电泳仪(北京市六一仪器厂)、G:BOX凝胶成像仪(Syngene)、Synergy HT多功能酶标仪(美国Bio-Tek公司)、微孔板发光检测仪(美国Bio-Tek公司)。
1.2 方法
1.2.1 猴头菌原生质体制备
取PDA平板上生长旺盛的猴头菌菌丝,接种于种子培养基中,26℃黑暗静止培养10 d。取种子培养基中菌丝体于离心管中,用无菌水清洗2次,滤纸吸干水分。按照每300 mg菌丝加入1 mL酶液的比例[15]置于恒温混匀摇床中进行酶解。酶解结束后采用G3砂芯漏斗过滤菌液,以除去残留菌丝体。滤液5 000 r/min离心10 min,弃上清,所得沉淀用0.6 mol/L甘露醇稳渗液冲洗,得到的原生质体溶于适量的0.6 mol/L甘露醇稳渗液中,用血球计数板计数。
1.2.2 常压室温等离子体诱变处理时间的研究
取1×107个/mL的猴头菌原生质体,加入等体积的10%(V/V)甘油做保护剂,取20μL原生质体均匀涂于载片上,置于氦气处理源下,处理距离为2 mm,功率为120 W,气流量为8 SLM,处理时间为0 s、10 s、20 s、30 s、40 s、50 s。计算原生质体在不同处理剂量下的致死率。
1.2.3 猴头菌原生质体ARTP诱变及优势菌株初筛
利用ARTP对稀释到适当浓度的猴头菌原生质体悬浮液进行辐照。辐照结束后,迅速将100μL原生质体样品涂布于突变体筛选平板上。试验在暗室中进行,为避免光修复,使用红光照射,每轮试验涂布100个平板,连续5轮。将诱变后的猴头菌原生质体于26℃恒温黑暗培养,24 h后去黑暗继续26℃恒温培养,5 d后对再生单菌落进行考察。每轮辐照后,以未经过ARTP辐照的再生菌株为对照,将再生速度快、菌丝致密的优势再生菌株进行传代培养,持续5代。经过5代筛选,获得性状优良、遗传稳定的菌株。
1.2.4 优势菌株的复筛
将筛选到的菌丝生长速度快且遗传稳定的优势突变菌株进行摇瓶发酵,发酵获得的菌丝体经无菌水洗涤3遍,5 000 r/min离心10 min,得到湿菌丝,冷冻干燥后获得干菌丝,测定其生物量。摇瓶发酵所得的干菌丝经粉碎机粉碎成菌丝体粉末,与10倍体积的95%(V/V)乙醇混合静置过夜,过夜混合物10 000 r/min离心10 min,弃上清后得到的匀浆用蒸馏水进行稀释,以1∶10的料液比在100℃沸水浴中提取2 h,得到的混合液10 000 r/min离心15 min并收集上清液,将离心后剩下的匀浆继续以1∶10的料液比添加蒸馏水,在100℃沸水浴中提取2 h,反复3次[16]。将3次提取收集的上清液旋转蒸发至合适的体积并加入4倍体积的95%(V/V)乙醇过夜沉淀,10 000 r/min离心15 min获得多糖,用苯酚硫酸法对获得的优势菌株菌丝胞内多糖进行测定。
1.2.5 优势菌株的生物学鉴定
1.2.5.1 拮抗实验 筛选获得的最佳优势菌株和出发菌株(CK)分别取0.5 cm×0.5 cm大小菌块一起接种到PDA培养基平板上,两菌块距离1 cm,26℃避光培养,2周后观察菌株之间的拮抗反应现象。
1.2.5.2 RAPD分析 用改良的CTAB法[17]提取最佳突变菌株的DNA,并对其用6条随机引物:GGTGACGCAG(S7)、GTCCACACGG(S8)、GGAGGGTGTT(S15)、AGGGAACGAG(S17)、TTCCGAACCC(S35)、CAAACGTCGG(S39)进行RAPD多态性扩增和分析。RAPD-PCR扩增总体系为25μL,包括10×buffer(含 Mg2+)2.5μL,dNTPs 2μL,引物 0.5μL,DNA模版 1μL(100 ng),Taq酶 0.5μL,ddH2O 18.5μL;RAPD-PCR扩增条件:94℃预变性5 min;94℃变性1 min,37℃退火1 min,72℃延伸5 min,35个循环;72℃延伸10 min。PCR产物用1.2%(W/V)的琼脂糖凝胶电泳检测。
1.2.6 优势菌株抗氧化能力的测定
1.2.6.1 羟基自由基清除能力的测定 羟基自由基清除能力的测定参考邵晓东等[18]的方法并加以改进。用超纯水配制0.1 mol/L Na2CO3溶液、0.05 mol/L Na2CO3溶液和0.05 mol/L NaHCO3溶液,称取1.77 mg鲁米诺加入10 mL 0.1 mol/L Na2CO3溶液得1 mmol/L鲁米诺溶液,将0.05 mol/L NaHCO3溶液逐滴加入到0.05 mol/LNa2CO3溶液中使得混合液(碳酸钠缓冲液CBS)的pH为8.5,配制1 mmol/L CuCl和1 mmol/L邻菲罗啉作为反应液。配制6%H2O2溶液为微孔板发光检测仪泵1缓冲液,碳酸钠缓冲液CBS∶1mmol/L鲁米诺溶液为17∶1的混合液作为微孔板发光检测仪泵2缓冲液。取溶解好的粗多糖样品10μL并加入10μL 1 mmol/L CuCl和10μL 1 mmol/L邻菲罗啉,放置于微孔板发光检测仪中检测。
1.2.6.2 Trolox等价抗氧化能力的测定 Trolox等价抗氧化能力(TEAC)的测定参考Zhang等[16]的方法。以水溶性维生素E为参照物,配制7.4 mmol/L的ABTS溶液,称取13.2 mg过硫酸钾加入到20 mL 7.4 mmol/L的ABTS溶液中,放置暗处室温搅拌12—16 h,产生暗蓝绿色溶液,此溶液用PBS稀释,得到在734 nm时吸光值为0.70的溶液。在4 h内测定样品的抗氧化活性,所测样品及Trolox预先溶于PBS缓冲液中,取100μL样品液加入到3.90 mL已反应过的ABTS溶液中20 min后,在734 nm下测其吸光值(A)。
样品的自由基清除能力按如下方程计算:自由基清除能力=(1-A/A0)×100%,其中A、A0分别为溶液中存在和不存在ABTS·+自由基的吸光值。
1.2.6.3 铁还原抗氧化离子的测定 铁还原抗氧化能力(FRAP)的测定参考Zhang等[16]的方法。准备多糖样品溶液100μL,与新鲜的900μL FRAP试剂在37℃下混合均匀,室温下孵育2 h。待反应结束,设定紫外分光光度计吸收波长为593 nm,测定样品的吸光值。根据硫酸亚铁的标准曲线,将吸光值转换为FRAP值。
2 结果与分析
2.1 ARTP诱变致死率的分析
ARTP照射时间不同,对菌体的致死率也不同[19]。如图1所示:ARTP照射处理时间在0—30 s时,随着处理时间的延长,猴头菌原生质体的致死率快速上升,在30 s时原生质体致死率达到73.6%;照射时间继续延长,致死率不断上升,在40 s时原生质体致死率达到100%。因此,选择照射处理时间为30 s,致死率为73.6%进行诱变。
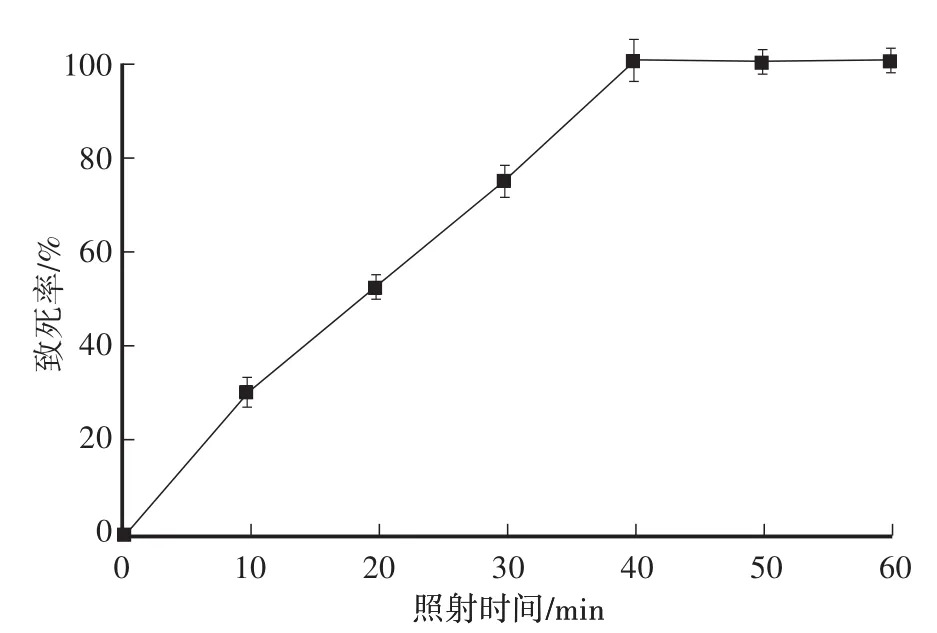
图1 猴头菌原生质体ARTP诱变致死曲线Fig.1 ARTPmutagenic lethal curve of H.erinaceus protoplasts
2.2 ARTP诱变及优良菌株的初筛
对猴头菌原生质体进行ARTP照射处理后,以再生速度快、菌丝致密的再生菌株为筛选对象进行传代培养。经过5代传代培养,获得5株遗传稳定且生长速度快的优势菌株。如表1所示,5株优势菌株每代的菌丝生长速度均大于出发菌株(CK),且每代菌丝体生长速度相对稳定。
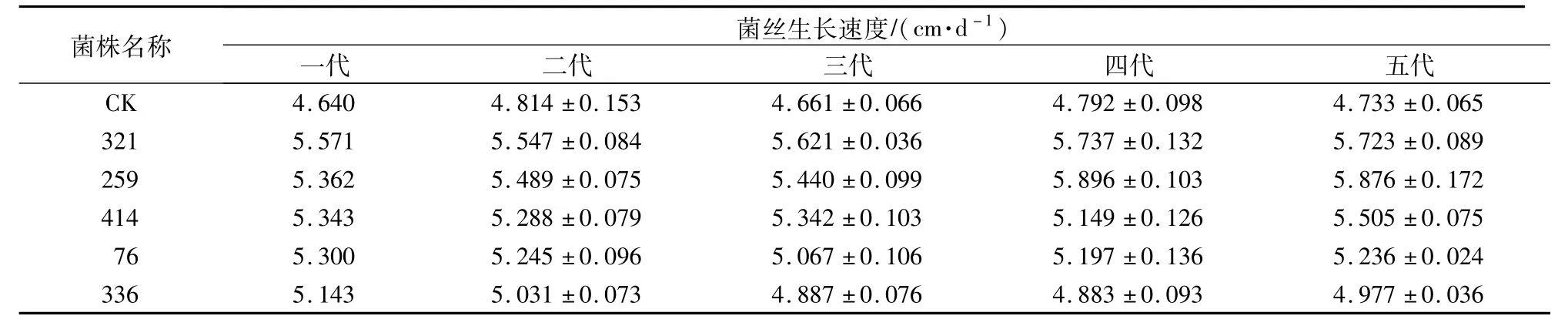
表1 各代猴头菌株菌丝生长速度Table 1 M ycelial grow th rate of each generation of H.erinareus
2.3 优良菌株的复筛
为了得到性状优良、遗传稳定、高产胞内多糖的猴头菌株,以出发菌株作为对照,对初筛得到的5株优良菌株以摇瓶发酵生物产量能力和菌丝体胞内多糖含量为指标进行复筛。如表2所示,5株优良菌株的生物量和胞内多糖含量与对照相比,均有不同幅度的提高,且5株菌株的多糖含量均高于出发菌株10%以上。其中,菌株321的生物量提高率和多糖含量提高率最高,分别为30.37%和47.45%。
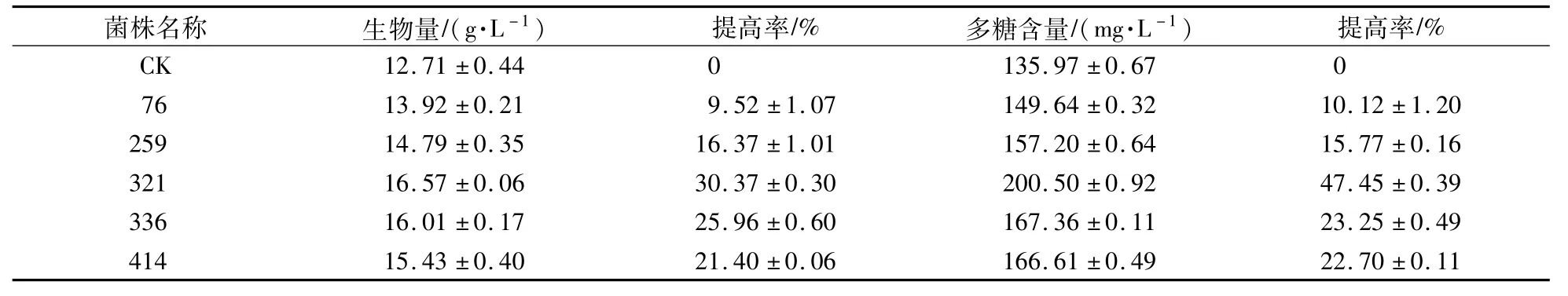
表2 ARTP诱变对猴头菌株菌丝发酵生物量和胞内多糖含量的影响Table 2 Effects of ARTPmutagenesis on m ycelial fermentation biomass and intracellular polysaccharide content of H.erinareus
2.4 突变菌株的生物学鉴定
2.4.1 拮抗实验
菌丝之间的拮抗反应是菌株间遗传特性不同的重要表现,亲缘关系越远,株系间的拮抗越强[20]。如图2所示,菌株321与出发菌株(CK)之间产生了明显的拮抗线,表明两菌株生长相互抑制,且菌株321与出发菌株相比有显著的生长优势。该结果暗示ARTP辐照猴头菌原生质体可能使其遗传物质发生了改变。
2.4.2 RAPD分析
RAPD分析具有时间短、效率高和灵敏度高等优点,可以在整个基因组DNA水平上分析不同菌株的亲缘关系[21]。如图3所示,菌株321与出发菌株(CK)的电泳图谱相比较,RAPD多态性扩增结果出现了不同程度的差异,从分子水平上证实了菌株321的遗传物质发生了改变,表明菌株321为突变新菌株。
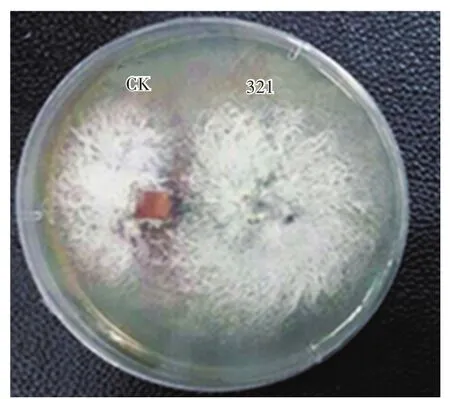
图2 菌株321与出发菌株(CK)的拮抗实验Fig.2 Antagonistic experiment between original strain(CK)and strain 321

图3 菌株321的RAPD电泳图谱Fig.3 RAPD electrophoretogram of strain 321
2.5 ARTP辐照对猴头菌菌丝体多糖抗氧化活性的影响
2.5.1 诱变前后猴头菌菌丝多糖羟基自由基清除能力的比较
为了考察ARTP诱变对猴头菌菌丝体多糖羟基自由基清除能力的影响,对菌株321菌丝体多糖和出发菌株菌丝体多糖进行了比较,结果显示:菌株321菌丝体胞内多糖羟基自由基清除率为42.86%,出发菌株菌丝体胞内多糖羟基自由基清除率为27.72%。试验表明,优势菌株321菌丝体胞内多糖和出发菌株菌丝体胞内多糖对羟基自由基均有清除作用,但优势菌株321菌丝体胞内多糖的羟基自由基清除能力强于出发菌株,提高了54.7%,表现出了更强的羟基自由基清除能力。
2.5.2 诱变前后猴头菌丝多糖TEAC和FRAP比较
为了考察ARTP诱变对猴头菌菌丝体多糖总抗氧化能力和Fe2+还原能力的影响,对菌株321和出发菌株的菌丝体多糖进行了比较。从图4可以看出,出发菌株(CK)和优势菌株321菌丝体胞内粗多糖都具有抗氧化能力,但优势菌株321菌丝体胞内粗多糖抗氧化(TEAC和FRAP)能力均大于出发菌株。优势菌株321对Fe2+还原及清除ABTS·+自由基的能力分别为14.75μmol Fe2+/g和132.81μmol Trolox/g,分别较出发菌株提高了19.7%和26.8%,表明优势菌株321菌丝体胞内多糖比出发菌株具有更强的抗氧化作用。

图4 菌株321与出发菌株(CK)的抗氧化能力Fig.4 Antioxidant ability of strain 321 and original strain(CK)
3 讨论
猴头菌具有多种显著的药理活性,近年来被众多学者广泛研究,其营养保健作用也日益被消费者所熟知,市场相关产品也越来越多,如猴菇饼干、猴菇米稀、猴菇饮料等。研究表明,猴头菌类产品中发挥主要活性作用的是猴头多糖[22]。因此,通过菌种选育获得可应用于工业生产的高产多糖猴头菌株,对进一步拓展猴头菌资源的开发和利用是非常有意义的。常压室温等离子体诱变作为一种新兴的诱变方法,在一定程度上较好地弥补了传统诱变热点钝化的缺陷[23]。王楠等[24]利用紫外诱变猴头菌得到一个优势突变菌株,该菌株与出发菌株相比生物量和菌丝体多糖含量分别提高了9.00%和28.88%。本研究将ARTP应用于猴头菌株显示了良好的诱变效果,经筛选获得5株性状稳定的优良突变菌株,摇瓶发酵菌丝干重和菌丝体胞内多糖含量与对照相比均有不同程度的提高,其中菌株321的生产能力表现最佳,生物量和多糖含量分别提高了30.37%和47.45%。研究结果显示,筛选获得优势突变菌株的单位菌丝干重对应的多糖含量不尽相同,暗示ARTP的作用机制可能比较复杂,推测其糖生物合成途径可能受到了影响,糖代谢途径也可能受到了影响。拮抗实验和RAPD分析证实,菌株321遗传物质发生了改变,为突变新菌株。RAPD分析结果同时暗示ARTP诱变可以导致出发菌株细胞DNA发生多位点突变。抗氧化结果显示,突变菌株321的体外抗氧化能力和羟基自由基清除能力均优于出发菌株,表明ARTP诱变不仅可以促进猴头菌株生产能力的提高,也可以提高菌丝体胞内多糖的抗氧化活性。综上,ARTP是一种高效的诱变技术,本研究通过利用ARTP诱变选育获得了高产胞内多糖猴头菌株,为猴头资源更好的开发和利用奠定了基础,同时为ARTP诱变技术应用于其他担子菌提供了依据。

