db/db2型糖尿病模型小鼠肠道多形拟杆菌、史氏产甲烷短杆菌与GLP-1分泌的相关性研究
王 烨, 易金阳, 韩 雪, 王晓晓, 谢婧雯, 李琳琳
(1新疆医科大学药学院药理教研室, 乌鲁木齐 830011; 2湖南省药物安全评价中心实验动物中心, 长沙 410331;3新疆医科大学第二附属医院药学部, 乌鲁木齐 830063)
2型糖尿病(Type 2 diabetes mellitus,T2DM)是遗传和环境等多种因素联合作用而导致的胰岛素抵抗(Insulin resistance,IR)与胰岛素相对分泌不足,致使葡萄糖、氨基酸及脂质代谢综合紊乱的一种全身慢性代谢性疾病。据2017年JAMA发表的研究文章显示[1],中国糖尿病患病率为10.9%,糖尿病前期约为 35.7%。糖尿病患者全球已逾1.7亿,其中2型糖尿病占90%左右,目前发病率呈逐年上升趋势,已经成为继心血管疾病和肿瘤之后的第三位主要非传染性疾病[2]。
T2DM的发病机制尚不明确,但近年来有大量的研究显示,肠道微生态与糖尿病的发生、发展存在密切的相关性[3]。此外胰高血糖素样肽1(Glucagon-like peptide 1,GLP-1)已成为近年来糖尿病治疗领域中的热点之一。有研究发现,接受胃旁路手术的2 型糖尿病患者或动物的糖尿病症状得到明显改善的原因,与肠道拟杆菌、史氏产甲烷短杆菌数量的改变[4-5]或GLP-1释放增加有关[6-7]。本研究以db/db 2型糖尿病模型小鼠为研究对象,采用RT-qPCR技术检测小鼠肠道内容物多形拟杆菌和史氏产甲烷短杆菌的数量,同时检测肠道GLP-1的分泌情况,并分析菌群变化与GLP-1分泌的相关性,拟为以肠道菌群为靶点的糖尿病机制及治疗提供新证据。
1 材料
1.1 动物c57BL/KsJ db/db2型糖尿病模型小鼠6只,6周龄雄雌各半,其对照c57BL/KsJ db/m小鼠6只,6周龄雄雌各半(购自江苏南京鹏晟生物科技发展有限公司),饲养于新疆医科大学SPF级动物实验中心。
1.2 主要试剂QIAamp DNA Stool Mini Kit 试剂盒(德国Qiagen公司),SYBR Green PCR kit(德国Qiagen公司),50 bp Marker (北京博迈德科技发展有限公司),溴乙靛(天根生化科技),琼脂糖凝胶DNA回收试剂盒(北京百泰克生物技术有限公司),胰高血糖素样肽1(GLP-1)、C肽(C -peptide)酶联免疫测定试剂盒(上海研辉生物有限公司)。
1.3 主要仪器血糖仪(罗氏),凝胶成像仪(AIphaImager HP),电泳仪、全自动酶标仪、PCR扩增仪、实时荧光定量仪(美国Bio-Rad公司),低速大容量多管离心机(上海安亭科学仪器厂),电热恒温水浴锅(上海精宏实验设备有限公司),电子分析天平(北京赛多利斯天平有限公司),组织匀浆仪(宁波新芝生物科技股份有限公司),厌氧罐及厌氧袋(日本三菱)。
2 方法
2.1 样本采集及处理
2.1.1 动物分组及粪样的收集 6周龄db/db2型糖尿病模型小鼠和对照组db/m小鼠适应性饲养1周后,开始监测小鼠(7-12周)的体质量和空腹血糖(FBG),收集每天下午4∶00-5∶00的新鲜粪样于冻存管中密封,迅速液氮冷冻后放入厌氧袋中,转存至-80℃冰箱保存备用。
2.1.2 血样 实验终末期用乙醚将小鼠麻醉后剖开腹部,收集门脉血及腹主静脉血,3 000 r/min离心15 min后分离血清,迅速放入液氮冷冻后,转存至-80℃冰箱保存备用。
2.1.3 组织 小鼠处死后,收集结肠部位的内容物及结肠组织,迅速液氮冷冻后,转存至-80℃冰箱保存备用。
2.2 肠道多形拟杆菌、史氏产甲烷短杆菌的检测
2.2.1 结肠内容物和粪样肠道微生物总DNA提取 按照QIAamp DNA Stool Mini Kit试剂盒(德国Qiagen公司)的使用说明提取结肠内容物和粪样中的细菌总DNA。
2.2.2 总DNA浓度测定及纯度鉴定 以TE对照液,取2 μLDNA样品,DanoDrop1000测定总DNA在260 nm和280 nm处的吸光度。取5 μL总DNA和2 μL loading buffer电泳经1%琼脂糖凝胶电泳,80 V电压40 min,凝胶成像仪照像,检测总DNA的纯度与完整性。
2.2.3 多形拟杆菌、史氏产甲烷短杆菌16S rRNA V6区PCR扩增 在16S rRNA V6可变序列区进行细菌特异性引物的设计,用于引导16S rRNA V6可变区的PCR扩增反应,序列见表1。
2.2.3.1 普通PCR体系和反应程序 反应体系(20 μL):2×PCR mix10 μL,上、下游引物(表1)各0.5 μL,细菌总DNA 2 μL,Nuclease-Free-wate7 μL。反应程序:预变性95℃、3 min;变性95℃、30 s,退火(表1)、30 s,延伸72℃、1 min,共39个循环;终延伸72℃、5 min,4℃保持。
2.2.3.2 PCR产物鉴定 PCR产物经2.5%琼脂糖凝胶电泳, 80 V电压40 min,凝胶成像仪下观察结果。

表1 多形拟杆菌、史氏产甲烷短杆菌PCR扩增引物及退火温度
2.2.3.3 多形拟杆菌、史氏产甲烷短杆菌RT-qPCR检测
2.2.3.3.1 标准曲线的建立 将多形拟杆菌、史氏产甲烷短杆菌的PCR产物经切胶、回收后作为DNA标准品,将标准品稀释为浓度梯度为101~108copies/μL的DNA样本作为阳性模板,同时以Nuclease-Free-water为阴性对照,每个样平行重复3次,反应体系(20 μL): 上、下游引物各0.5 μL,荧光染料(SYBR GreenI)10 μL,DNA模板2 μL,Nuclease-Free-water 7 μL,反应程序:预变性95℃、2 min,变性95℃、5 s,退火(表1)、30 s,35个循环。由实时荧光定量PCR仪自动绘制扩增曲线、熔链曲线, 产物通过熔链曲线证实。反应结束后用PCR仪附带软件分析,自动生成标准曲线。
2.2.3.3.2 小鼠粪样及结肠内容物多形拟杆菌、史氏产甲烷短杆菌的检测 按上述“2.2.3.3.1 ”中的反应体系和程序进行实时荧光定量PCR反应,检测小鼠粪样及结肠内容物中的多形拟杆菌、史氏产甲烷短杆菌。
2.3 GLP-1的检测酶联免疫法(ELISA)检测门脉血、结肠匀浆液中GLP-1的含量:按照试剂盒的使用说明进行操作。
2.4 检测空腹C肽水平,计算胰岛素抵抗指数(HOMA-IR)、分泌指数(HOMA-IS)空腹C肽采用ELISA法检测,按照试剂盒的使用说明进行操作。用空腹C肽代替胰岛素采用改良HOMA(CP)公式评价胰岛素抵抗和胰岛素的分泌指数[8]。
3 结果
3.1 小鼠体质量、血糖的监测与对照db/m组小鼠相比,db/db组小鼠的体质量和空腹血糖明显偏高(P<0.01),见图1。
3.2 肠道多形拟杆菌、史氏产甲烷短杆菌的检测
3.2.1 肠道微生物总DNA纯度及浓度测定 提取小鼠结肠内容物和粪便样本肠道微生物总DNA,检测总DNA浓度,A260/A280的比值均在1.6~1.8,说明样品的DNA的纯度较高。1.0%的琼脂糖凝胶电泳可见清晰条带(图2),提示DNA样品完整性良好。
3.2.2 肠道多形拟杆菌、史氏产甲烷短杆菌16S rRNA V6区PCR扩增
3.2.2.1 16S rRNA V6区普通PCR扩增 多形拟杆菌、史氏产甲烷短杆菌PCR目的片段产物未见非特异性扩增,电泳鉴定结果见图3、4。
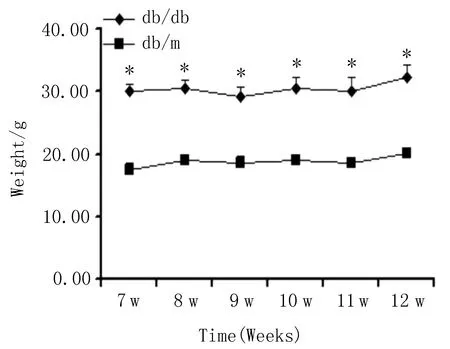

图1 db/db2型糖尿病模型和对照db/m组小鼠的体质量、空腹血糖

图2 结肠内容物微生物基因组DNA电泳图

图3 多形拟杆菌 16S rRNA V6区PCR扩增产物电泳图

图4 史氏产甲烷短杆菌16S rRNA V6区PCR扩增产物电泳图
3.2.2.2 肠道多形拟杆菌、史氏产甲烷短杆菌的实时荧光定量PCR
3.2.2.2.1 多形拟杆菌实时荧光定量检测 结肠内容物中多形拟杆菌RT-PCR结果显示:与对照db/m组相比,db/db2型糖尿病模型组小鼠结肠中多形拟杆菌的数量增加,差异有统计学意义(P<0.05), 见图5。
3.2.2.2.2 史氏产甲烷短杆菌的实时荧光定量分析 结肠内容物中史氏产甲烷短杆菌RT-PCR结果显示:与对照db/m组小鼠相比,db/db组小鼠结肠内容物史氏产甲烷短杆菌数量增加,差异有统计学意义(P<0.05),见图6。
3.3 GLP-1的检测与对照db/m组小鼠相比,db/db2型糖尿病模型鼠门脉血、结肠组织匀浆中的GLP-1含量均降低,差异有统计学意义(P<0.05),见图7。
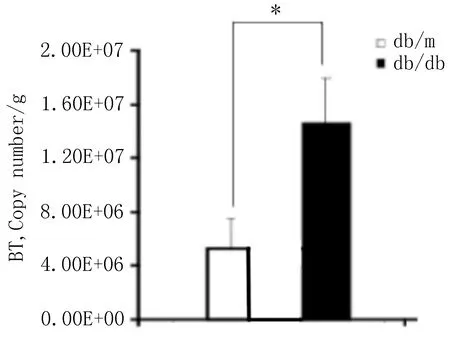
图5 db/db2型糖尿病模型和对照db/m组小鼠结肠内容物多形拟杆菌的比较

图6 db/db2型糖尿病模型和对照db/m组小鼠结肠内容物史氏产甲烷短杆菌的比较

图7 小鼠门脉血、结肠匀浆液中GLP-1含量的比较
(注:*P<0.05)。
3.4 小鼠的空腹C肽水平及胰岛素抵抗指数、分泌指数的检测db/db2型糖尿病模型和对照db/m组小鼠相比,空腹C肽水平下降(P<0.05),HOMA-IR升高(P<0.05),HOMA-IS下降(P<0.05),见图8。
3.5 多形拟杆菌、史氏产甲烷短杆菌与体质量、空腹血糖、GLP-1的相关性分析
3.5.1 多形拟杆菌与2型糖尿病一般指标的相关性分析 Pearson相关性分析显示,肠道多形拟杆菌的数量与小鼠体质量(r=0.60,P<0.01)、空腹血糖(r=0.58,P<0.01)呈正性相关,见图9;与小鼠空腹C肽水平(r=-0.41,P<0.01)呈负性相关,与胰岛素抵抗指数(r=0.46,P<0.01)、胰岛分泌指数(r=0.26,P<0.01)呈正性相关,见图10。

图8 小鼠血清空腹C肽、胰岛素抵抗指数及胰岛素分泌指数的比较
3.5.2 史氏产甲烷短杆菌与2型糖尿病一般指标的相关性分析 Pearson相关性分析显示,肠道史氏产甲烷短杆菌的数量与小鼠体质量(r=0.59,P<0.01)、空腹血糖(r=0.50,P<0.01)呈正性相关,见图11;与小鼠空腹C肽水平(r=-0.44,P<0.01)、胰岛分泌指数(r=-0.39,P<0.01)呈负性相关,与胰岛素抵抗指数(r=0.49,P<0.01)呈正性相关,见图12。
3.6 GLP-1与多形拟杆菌、史氏产甲烷短杆菌的相关性分析模型组db/db小鼠结肠内容物多形拟杆菌数量与门脉血、结肠GLP-1含量(r=-0.63,P<0.01;r=-0.35,P<0.01)呈负相关;史氏产甲烷短杆菌数量与门脉血、结肠GLP-1含量(r=-0.17,P<0.01;r=-0.46,P<0.01)呈负相关,见图13。
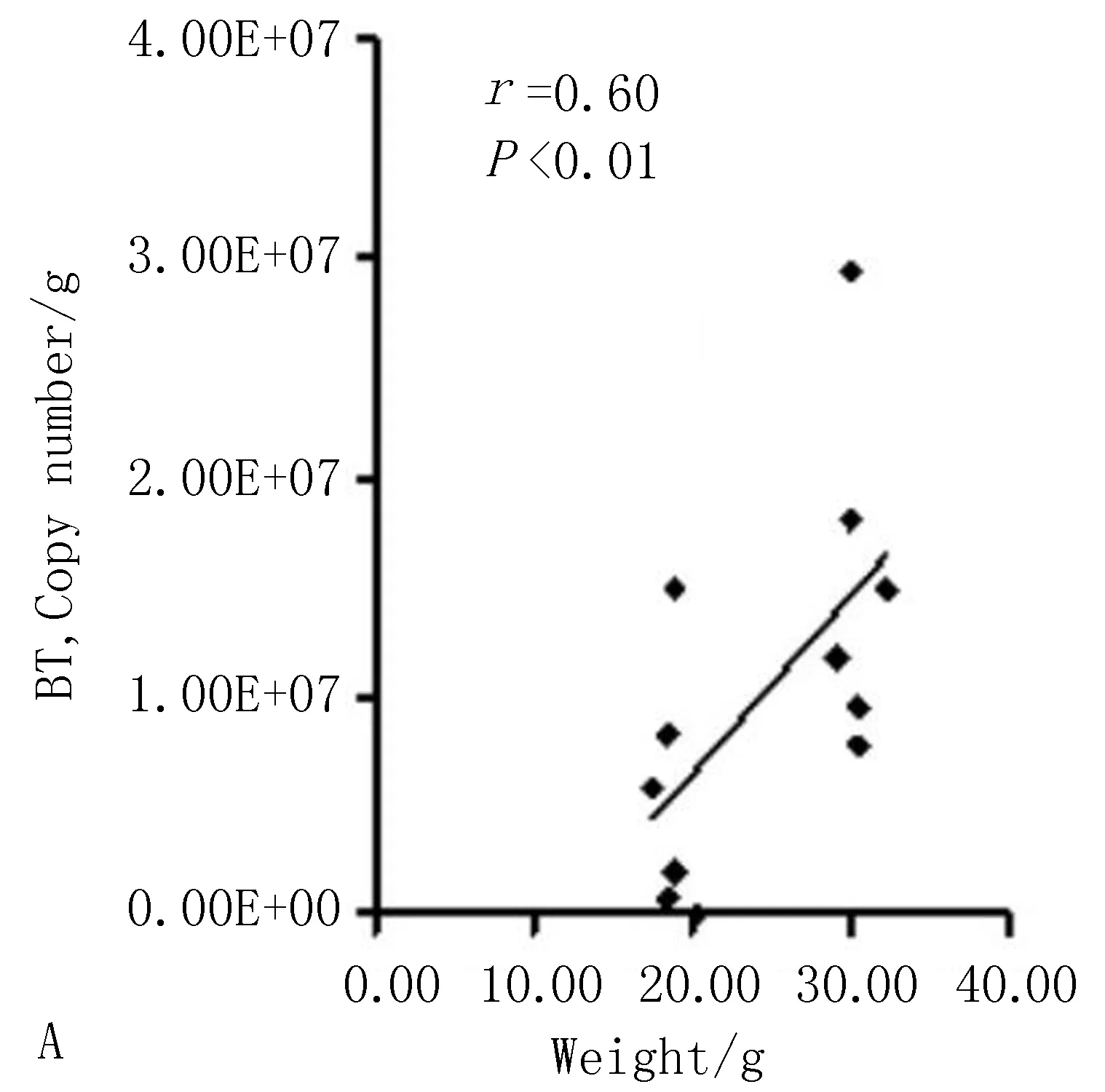

图9 结肠内容物多形拟杆菌与体质量、空腹血糖的相关性
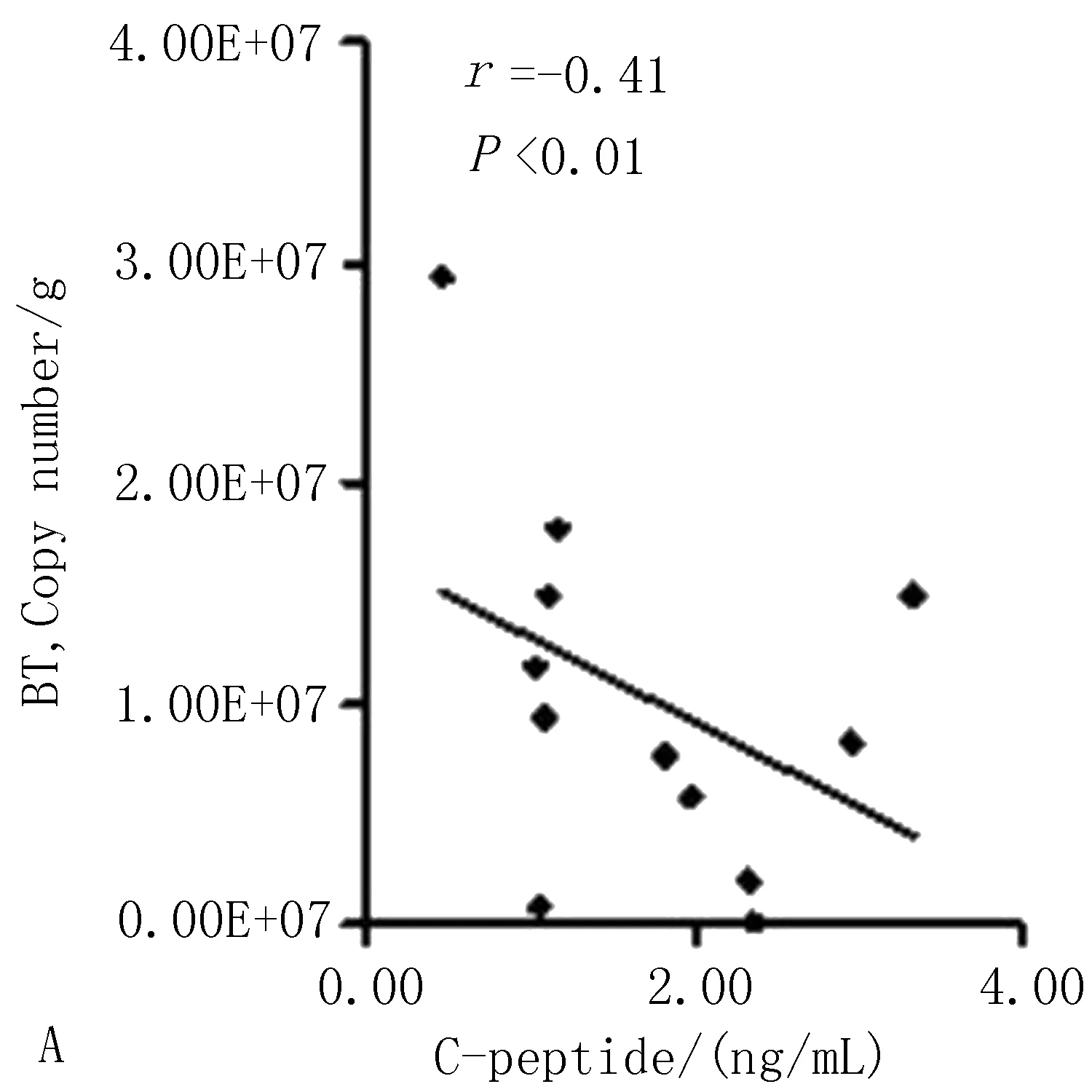
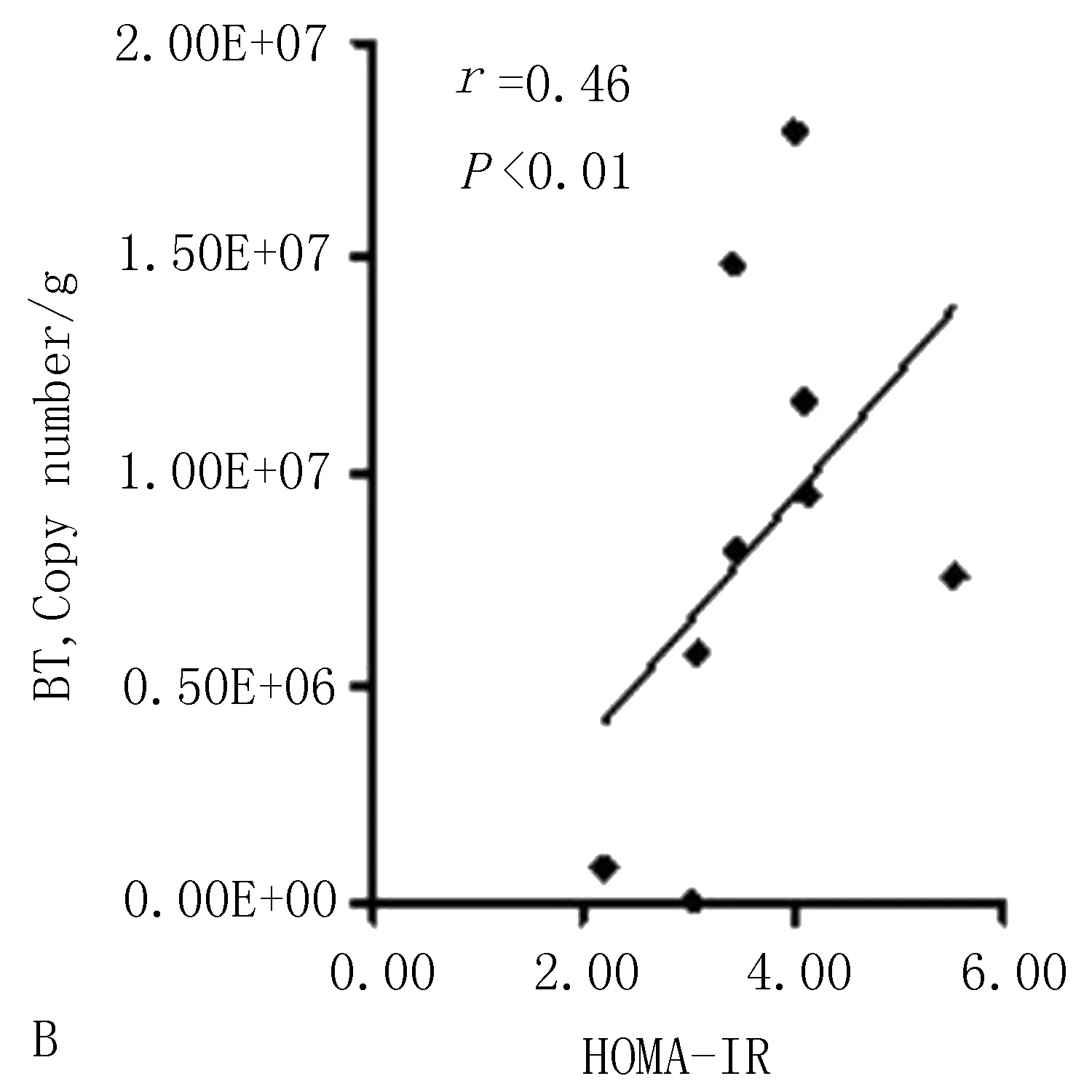
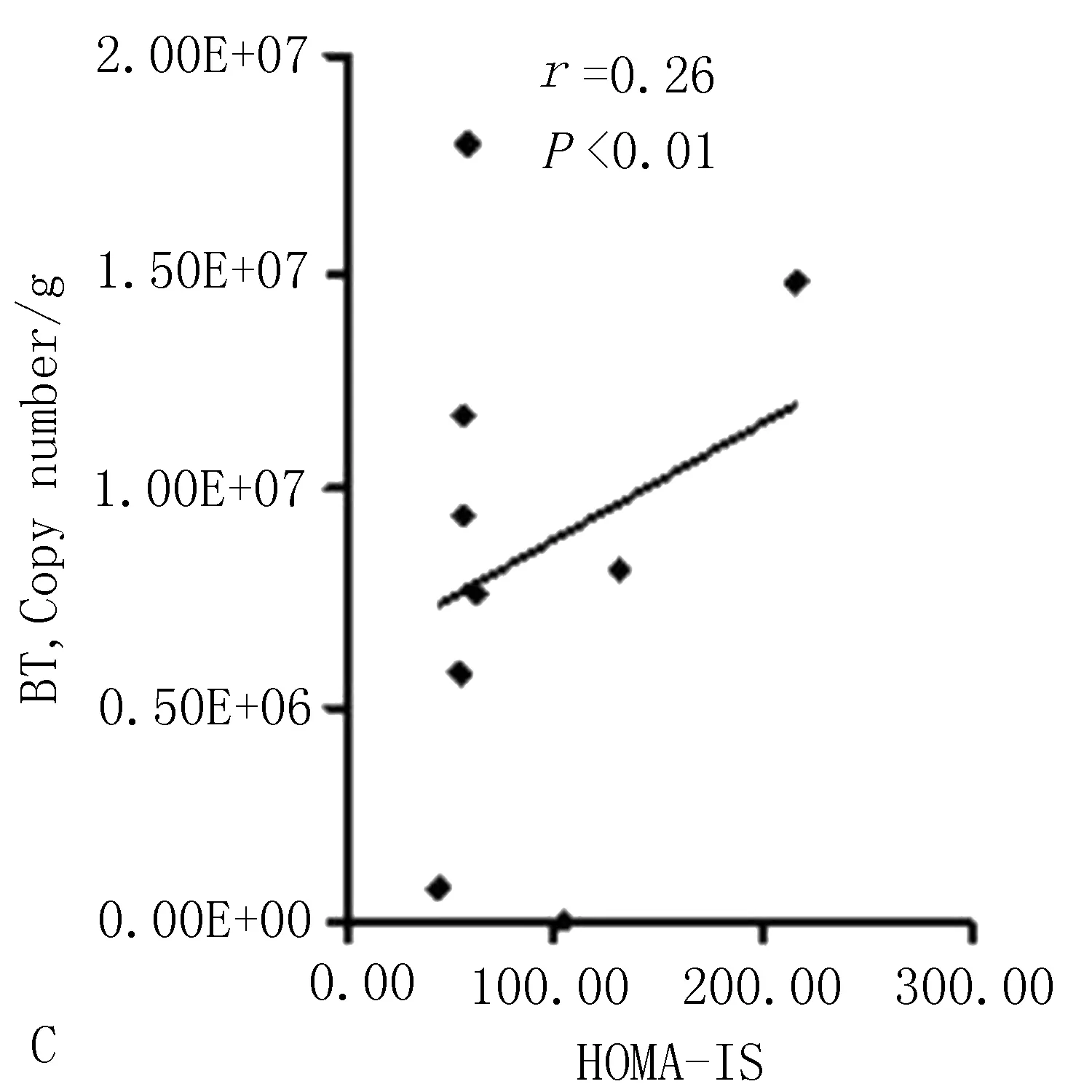
图10 结肠内容物多形拟杆菌与空腹C肽水平、胰岛素抵抗指数、胰岛素分泌指数的相关性


图11 结肠内容物史氏产甲烷短杆菌与体质量、空腹血糖的相关性
4 讨论
近期越来越多的研究表明肠道微生态与2型糖尿病的发生、发展密切相关。Nadja等[9]通过与正常青年人群相比,2型糖尿病青年人群肠道中的多形拟杆菌门/厚壁菌门比例较高,多形拟杆菌与血糖呈正相关。Olli等[10]的研究证实大量的肠道拟杆菌可以影响实验大鼠体质量。这种作用可能是通过改变肠道微生物群的组成或通过微生物代谢物介导的。此外,多形拟杆菌与其他微生物共定殖可以提高细菌多糖发酵的效率,改变细菌多糖发酵的特性[11]。史氏产甲烷短杆菌能以二氧化碳为电子受体,氢气或甲酸为电子供体促进多糖的利用。人体肠道还存在硫酸盐还原菌,它们利用氢气还原硫酸盐产生硫化氢,产生腐败物质,由于竞争与史氏产甲烷短杆菌的氢气的利用,所以影响多糖的利用[12]。且有文献报道多形拟杆菌联合史氏产甲烷短杆菌可有效增加对多糖的利用,使血糖增高[13]。本实验中db/db小鼠肠道中多形拟杆菌、史氏产甲烷短杆菌数量的增多,可能是引起小鼠血糖升高的重要原因。



图12 结肠内容物史氏产甲烷短杆菌与C肽、胰岛素抵抗指数、胰岛素分泌指数的相关性
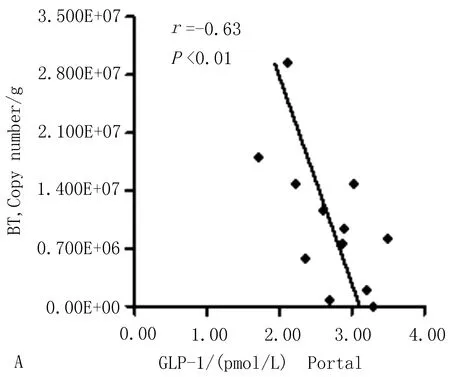
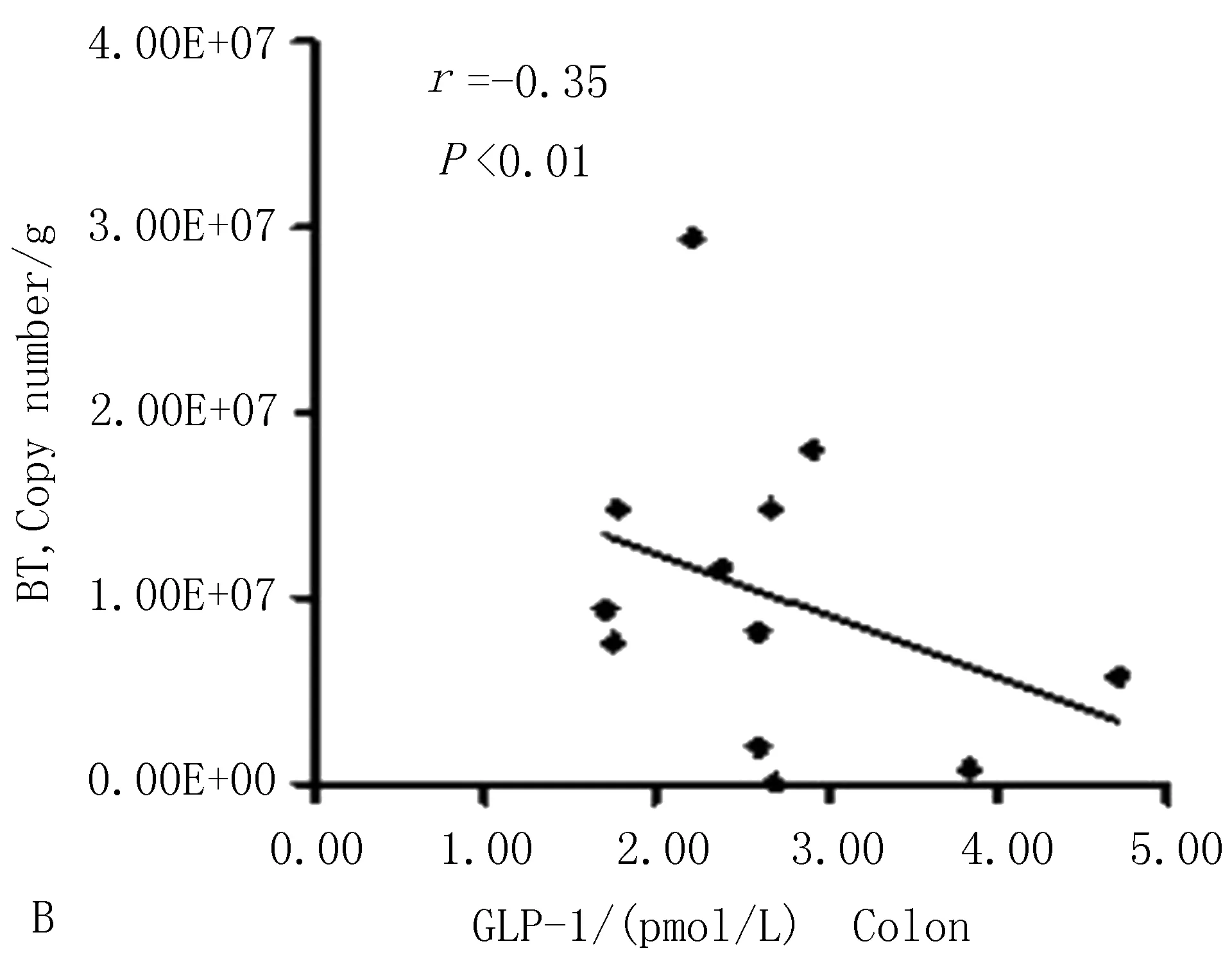


图13 门脉血血清、结肠匀浆液GLP-1水平与肠道多形拟杆菌、史氏产甲烷短杆菌的相关性
2型糖尿病的发病机制相当复杂,研究已明确证实GLP-1与胰岛素抵抗、高胰岛素血症、糖耐量异常等2型糖尿病的发生发展密切相关。GLP-1和肠道菌群均主要存在于肠远端,2型糖尿病患者胃旁路术后,发现多形拟杆菌和肠道GLP-1都产生了相应的变化[8]。近年来的无菌动物研究也证实肠道菌群的存在与GLP-1的表达有关[14-15]。本研究中发现,多形拟杆菌、史氏产甲烷短杆菌与GLP-1的分泌呈负相关,与血糖呈正相关。有研究表明调控肠促胰岛素来控制血糖稳态的可能机制是通过特定的膳食纤维来调节肠道菌群,以改善代谢紊乱[16]。多形拟杆菌、史氏产甲烷菌已被证实可发酵果聚糖等膳食纤维,多聚糖的发酵产物短链脂肪酸是Gpr41的配体分子[17],Gpr41可能是肠促激素分泌的重要调控因素,相关机制还有待于进一步的深入研究。

